依达拉奉对心肺复苏术后心肌缺血再灌注损伤的作用机制研究
2023-05-10石新烨孙经武王佳森刘振刘婧玚董文敬张翠
石新烨 孙经武 王佳森 刘振 刘婧玚 董文敬 张翠
中国心血管病患病率及死亡率处于上升阶段,其中心血管病死亡率居首位,明显高于肿瘤及其他疾病,占疾病死亡构成的40%以上[1],而存在各种心血管基础性疾病的患者更容易发生心脏骤停。心脏骤停指人体心脏的射血功能突然停止,伴有心音与大动脉波动消失等症状,严重威胁患者的生命安全,其在使死亡率升高的同时还易引起相关并发症,对患者生活质量造成严重影响。对心脏骤停患者应用早期心肺复苏在心脏骤停院前急救中发挥重要意义[2]。研究发现,自主循环恢复(Return of spontaneous circulation,ROSC)后患者主要死于全身缺血再灌注引起的心脑功能障碍[3]。心肌缺血再灌注损伤(Myocardial ischemia-reperfusion injury,MIRI)是指在冠状动脉发生完全或部分梗阻后,重新获得血流时心肌组织的损伤反而会进行性加重[4]。其涉及多种生物学过程和信号传导途径,包括细胞内氧自由基的大量产生[5]、钙离子超负荷[6]、线粒体通透性转换孔开放[7]、内皮细胞功能受损[8]、过度炎症反应[9]及细胞凋亡等。近年有研究显示细胞焦亡在MIRI 中发挥重要作用,MIRI 主要通过NOD 样受体蛋白3/天冬氨酸特异性半胱氨酸蛋白酶1/焦孔素D(NLRP3/Caspase-1/GSDMD)信号通路介导心肌细胞焦亡,其特征是心肌缺血再灌注过程中被激活的Caspase 特异性剪切GSDMD[10],将N-末端从具有自我抑制作用的C-末端中释放出来,随后GSDMD-N 与脂质结合形成非选择性孔隙,不依赖于增加渗透压使细胞破裂。释放出的细胞内活性物质激发机体免疫反应,使心肌梗死面积扩大,加重心肌功能障碍及结构紊乱。既往研究表明,依达拉奉作为一种自由基清除剂,对MIRI 有保护作用,其可降低因自由基大量生成所导致的细胞膜损伤和蛋白质核酸不可逆的破坏作用,也可以通过降低心脏骤停后的氧化应激来改善心肌功能损伤[11]。本研究通过探讨依达拉奉是否通过抑制细胞焦亡通路对心脏骤停心肺复苏后MIRI 发挥保护作用,同时降低炎症因子含量进而减少对心肌的损伤,以期为心脏骤停心肺复苏后MIRI 新的治疗方法提供理论基础。
1 材料与方法
1.1 实验仪器及试剂实验仪器:多导生理信号记录仪及配套生理信号采集处理系统(成都泰盟科技有限公司),动物呼吸机(成都仪器厂成都泰盟科技有限公司),心电图机(飞利浦有限公司),电泳槽、电转装置、电泳仪(Bio-rad 公司),水平摇床(北京六一生物科技有限公司),酶标仪(美国Thermo 公司),台式低温离心机(德国Eppendorf 公司),化学发光成像系统(山东爱博科技贸易有限公司),光学相差显微镜(奥林巴斯公司),Microm Gmbh 切片机(德国Microm International GmbH 公司)。实验试剂药品:戊巴比妥钠(滨州医学院附属医院),10%氯化钾(中国大冢制药有限公司),依达拉奉(先声药业有限公司),肾上腺素(北京市永康药业有限公司)。SDSPAGE 凝胶配制试剂盒、PMSF、RIPA 裂解液、BCA蛋白浓度测定试剂盒、5×蛋白上样缓冲液(武汉塞维尔生物科技有限公司),Anti-GAPDH antibody、Anti-NLRP3 antibody、Anti-IL-1βantibody、Anti-Caspase-1 antibody、Anti-GSDMD antibody(Abcam公司)、HRP 标记羊抗兔二抗(博士德生物工程有限公司)。大鼠特异性 ELISA 试剂盒IL-1β、IL-6、TNF-α(博士德生物工程有限公司)。EDTA 抗原修复液、SABC 免疫组化染色试剂盒、DAB 显色试剂盒(博士德生物工程有限公司),HE 染色试剂盒(Solarbio 公司)。
1.2 动物及分组选择36 只250~300g 雄性 SD 大鼠,购自济南杰瑞康生物科技有限公司。每3 只合笼饲养,标准饲料购自滨州医学院附属医院实验中心。予以日常光照,不限食物和水。36 只SD 雄性大鼠随机选择12 只作为假手术组,只行颈外静脉及尾动脉置管、气管插管、Ⅱ导联心电图。其余大鼠制备心脏骤停后心肺复苏模型,模型完成后随机分为2 组,分别为生理盐水组、依达拉奉组,每组12 只,ROSC 后依达拉奉组大鼠静脉注射依达拉奉3mg/kg,生理盐水组注射相同剂量的生理盐水。
1.3 实验方法
1.3.1 制作模型 本研究采用高钾合并窒息方式制备心脏骤停后心肺复苏大鼠模型,此法改良自Sharp 等[12]的制备方法。实验前大鼠禁食12h,期间自由饮水。戊巴比妥钠(30mg/kg)腹腔麻醉,行气管插管连接呼吸机(参数:通气频率70 次/min,潮气量6ml/min,呼吸比1:3),经四肢皮下电极探针常规记录Ⅱ导联心电图。右侧颈静脉置管以0.3ml/kg的剂量脉冲式注射10% KCl 溶液,注射时一次性给药,给药时间1s 左右。尾动脉置管后连接多导生理信号记录仪及配套生理信号采集处理系统。待大鼠发生心脏骤停后,立刻关闭呼吸机使呼吸受抑制,计时5min 后,立即打开呼吸机开始心肺复苏,胸外心脏按压频率180~200 次/min,按压深度为大鼠胸廓前后径的1/3,按压放松时间比1:1,按压时间3~5min,1min 后静脉注射0.04mg/kg 肾上腺素,若无效于4min 后重复1 次,5min 自主循环仍未恢复则视为复苏失败。若心肺复苏成功,ROSC 后生理盐水组与依达拉奉组立即经颈静脉分别给予生理盐水/依达拉奉(3mg/kg)。待大鼠自主呼吸恢复后即可拔除气管插管。取材:诱导大鼠ROSC 6h 后处死,用手术剪沿胸骨下缘剪开大鼠胸部以暴露心脏,左心室取血,离心后分装血清于-80℃冰箱保存组织。分离心脏后一部分心肌组织用预冷的4℃PBS 漂洗干净后,置于-80℃冰箱中保存,另一部分置于4%多聚甲醛缓冲液固定。
心脏骤停判断标准:有创动脉压显示动脉搏动波消失,且平均动脉压<20mmHg;心电图显示为无脉性电活动、心室颤动或呈一条直线。ROSC 标准:心电图显示出现室上性节律(包括窦性、房性或交界性);平均动脉血压维持30mmHg 以上。见图1。

图1 大鼠心脏骤停实验过程中的心电图表现
1.3.2 大鼠血流动力学监测 经四肢皮下电极探针常规记录Ⅱ导联心电图后,监测心率(HR)、收缩压、舒张压,生理盐水组及依达拉奉组在ROSC 30min后再次经尾动脉记录HR、收缩压、舒张压。
1.3.3 蛋白印迹法(Western Blot)检测各组大鼠细胞焦亡信号通路表达情况 取暂存于-80℃冰箱的大鼠心肌组织,匀浆,提取蛋白,依次进行蛋白变性、蛋白定量、电泳、转膜,室温封闭2h,洗膜并加入Caspase-1、GSDMD 及IL-1(1:1 000)抗体,以GAPDH(1:5 000)为内参,4℃孵育过夜,洗膜加二抗室温孵育2h,显像,采用凝胶成像系统分析蛋白相对内参表达量。
1.3.4 HE 染色 心肌组织切片经二甲苯脱蜡,乙醇脱水,苏木素溶液、伊红溶液染色,乙醇再次脱水,封片后光镜下观察各组心肌组织病理变化。
1.3.5 免疫组化 心肌组织切片置于60℃温箱中烤片2h,脱蜡、水化后,EDTA 热抗原修复,3% H2O2室温孵育20min,PBS 液漂洗(3 次×5min)后加山羊血清封闭液,室温下放置15min 后加入NLRP3、Caspase-1、GSDMD 抗体(1:100)4℃过夜。次日PBS漂洗后滴加生物素标记山羊抗大鼠抗体,37℃孵育30min,PBS 漂洗后DAB 显色2min,自来水充分冲洗后苏木素复染3min,梯度酒精脱水、二甲苯透明、树胶封片。在光学显微镜下观察图像并拍照,每张切片随机选取5 个视野,通过ImageJ 软件分析图像。
1.3.6 ELISA 检测炎症因子 将采集的大鼠血液在4℃离心机中以3 000r/min 离心15min,获取血清,使用ELISA 试剂盒检测血清IL-1β、IL-6、TNF-α水平,用酶标仪检测450nm 处吸光度值,计算各因子含量。
1.4 统计学方法采用SPSS 25.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 三组血流动力学比较造模前各组大鼠的体重、HR、收缩压、舒张压差异均无统计学意义(P>0.05)。见表1。ROSC 后30min,与假手术组相比,生理盐水组大鼠HR 增快,生理盐水组及依达拉奉组大鼠收缩压与舒张压大幅度下降,差异有统计学意义(P<0.05);与生理盐水组相比,依达拉奉组大鼠HR 减慢,收缩压及舒张压位于正常范围内且平稳,差异有统计学意义(P<0.05)。见表2。
表1 三组实验前基线水平比较(±s)

表1 三组实验前基线水平比较(±s)
分组HR(次/min)收缩压(mmHg) 舒张压(mmHg)体重(g)假手术组233.91±14.91105.12±11.1298.53±12.22263.72±9.65生理盐水组246.50±18.77108.05±10.55102.74±9.40249.91±16.80依达拉奉组241.17±22.29107.46±10.68101.38±12.08266.36±15.90 F 1.2640.2400.4290.413 P 0.2960.7880.6540.666
表2 三组ROSC 30min 后HR、血压水平比较(±s)

表2 三组ROSC 30min 后HR、血压水平比较(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与生理盐水组比较,#P<0.05,##P<0.01
分组HR(次/min)收缩压(mmHg) 舒张压(mmHg)假手术组233.91±14.92105.12±11.1298.53±12.22生理盐水组 281.46±36.02**53.47±7.79**50.10±9.99**依达拉奉组 239.83±37.34#82.27±15.88**## 77.14±14.39**##F 8.27856.07047.032 P 0.0010.0000.000
2.2 三组心肺复苏后大鼠心肌组织形态的变化HE染色结果显示,假手术组大鼠心肌细胞无水肿,心肌纤维条理清晰呈束状排列,细胞形态及结构正常。生理盐水组细胞排列紊乱,且部分细胞断裂,伴有周围炎性细胞浸润,依达拉奉组上述情况缓解。见图2。
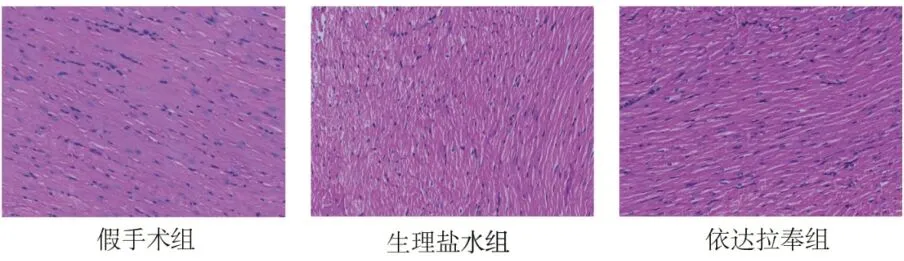
图2 各组大鼠心肌组织HE 染色(×40)
2.3 三组炎症因子表达情况与假手术组相比,生理盐水组IL-1β、IL-6、TNF-α 表达量明显增多,差异有统计学意义(P<0.05),依达拉奉组IL-1β、IL-6、TNF-α 表达量稍下降,但差异无统计学意义(P>0.05);与生理盐水组相比,依达拉奉组IL-1β、IL-6、TNF-α 显著下降,差异有统计学意义(P<0.05)。见表3。
表3 三组大鼠血清中炎症因子水平比较(pg/ml,±s)

表3 三组大鼠血清中炎症因子水平比较(pg/ml,±s)
注:与假手术组比较,*P<0.05,**P<0.01;与生理盐水组比较,#P<0.05,##P<0.01
分组IL-1βIL-6TNF-α假手术组67.09±12.7838.32±23.4076.58±7.67生理盐水组 122.14±33.37*112.57±20.56*145.92±58.96**依达拉奉组 61.68±12.81##36.82±9.22##67.77±6.73##F 11.64231.98010.594 P 0.0020.0000.001
2.4 三组心肌细胞焦亡信号通路情况比较Western blot 及免疫组织化学分析检测细胞焦亡通路关键蛋白在大鼠心肌中表达情况显示:与假手术组相比,生理盐水组中NLRP3、Caspase-1、GSDMD 蛋白含量在ROSC 后均升高,差异有统计学意义(P<0.05);与生理盐水组相比,依达拉奉组上述蛋白含量均降低,差异有统计学意义(P<0.05)。Western blot 检测IL-1β:与假手术组相比,生理盐水组中IL-1β 蛋白表达量升高,差异有统计学意义(P<0.05);与生理盐水组相比,依达拉奉组蛋白表达量降低,差异有统计学意义(P<0.05)。见图3、4,表4。
表4 三组大鼠心肌组织中NLRP3、Caspase-1、GSDMD蛋白表达情况(%,±s)

表4 三组大鼠心肌组织中NLRP3、Caspase-1、GSDMD蛋白表达情况(%,±s)
注:与假手术组比较,*P<0.05,**P<0.01;与生理盐水组比较,#P<0.05,##P<0.01
分组NLRP3Caspase-1GSDMD假手术组1.38±0.291.67±0.931.20±0.36生理盐水组44.74±5.03**15.95±2.72**13.50±6.71**依达拉奉组8.18±1.53#5.70±0.59**##2.44±1.15#F 175.87762.65214.794 P 0.0000.0000.010

图3 Western blot 检测各组焦亡细胞通路蛋白的表达情况

图4 免疫组化检测各组焦亡细胞通路蛋白的表达情况
3 讨论
本研究通过制作大鼠心脏骤停后心肺复苏造成MIRI 模型,ROSC 后给予依达拉奉,观察药物对细胞焦亡通路蛋白表达的影响,进而研究对心肌的保护作用机制。
炎症反应是机体针对有害刺激的重要生理反应,在免疫反应中起重要作用。有研究证明[13,14],心肺复苏后全身缺血再灌注损伤诱导炎症反应激活,多种炎症因子及炎症介质释放可直接抑制循环和心肌功能,最终导致心肌梗死、纤维化及心力衰竭等不良后果。炎症反应发生时,中性粒细胞、单核细胞等炎症细胞募集到心肌缺血区域,释放大量炎症因子,包括IL-1β、TNF-α 及IL-6 等,其中TNF-α 是较早释放的具有多种生物效应的重要促炎细胞因子,可诱发“次级”炎症因子IL-6 的产生,再通过IL-6 刺激各种细胞群在身体防御中发挥核心作用[15],是炎症介质网络的重要组成部分。本实验结果显示心脏骤停后心肺复苏模型生理盐水组的炎症因子IL-1β、IL-6、TNF-α 水平较假手术组均升高。Wallert 等[16]应用维生素E 最强的抗氧化形式α-生育酚(α-TOH)对大鼠左冠状动脉前降支结扎60min 后制备MIRI 模型,结果证明α-TOH 通过抑制MIRI 诱导的氧化和炎症反应,最终实现保护心功能。西红花素可以通过Nrf2 减轻炎症和未折叠蛋白,在心脏保护机制中发挥关键作用[17]。基于既往研究及本实验研究证明,抗炎是治疗心脏骤停心肺复苏后MIRI 的一种策略。
在心肌缺血的情况下,线粒体功能障碍和溶酶体不稳定会增加钾离子外流,从而激活NLRP3 炎症小体,促进细胞焦亡[18]。NLRP3 炎症小体介导的无菌性炎症贯穿MIRI 整个过程,其引起大量炎症介质释放至细胞外,大量促炎刺激信号引起中性粒细胞、巨噬细胞及其他类型白细胞持续向炎症部位募集。炎症体衍生的细胞因子IL-1β 诱导大鼠释放活性IL-18 介导左室收缩功能障碍,加重MIRI[19]。同时有研究[20]发现,MIRI 模型中使用药物抑制NLRP3 炎性小体,可限制大鼠心肌缺血再灌注后继发性炎症损伤和梗死面积;Yue 等[21]发现钙蛋白酶的沉默可通过抑制NLRP3/ASC/Caspase-1 轴的激活来改善MIRI 所致的心肌功能障碍。本实验检测细胞焦亡通路相关蛋白发现,NLRP3、Caspase-1、GSDMD 蛋白在大鼠心脏骤停心肺复苏后心肌组织中的含量均增加,与上述研究结果相同,表明细胞焦亡参与心脏骤停心肺复苏后MIRI。
依达拉奉是一种具有抗炎、抗氧化、改善缺血再灌注损伤的药物[22],临床上用于急性脑梗死的治疗,可降低脑缺血再灌注损伤。随着对其研究深入,其在临床上的应用范围呈现逐渐扩展趋势,发现对于心肌缺血再灌注保护同样具有十分重要的意义。本实验结果发现依达拉奉组血清中的IL-1β、IL-6、TNF-α 炎症因子较生理盐水组均下降,同时通过Western blot 检测心肌组织中IL-1β 的表达也验证MIRI 过程中有大量IL-1β 炎症因子释放,同时表明依达拉奉能够减轻炎症因子介导的MIRI,从而改善微循环保护心肌细胞。有研究表明[23]依达拉奉治疗急性心肌梗死行CABG 术的患者,通过有效控制血清TNF-α、IL-6、NO 水平,从而保护心肌细胞,改善心功能,提高临床疗效;林菁等[24]发现依达拉奉能有效降低心脏骤停心肺复苏成功后患者的血清TNF-α、IL-1β 等促炎性细胞因子水平,均与本实验结果一致。本实验中Western blot 检测依达拉奉组细胞焦亡通路相关蛋白表达量较生理盐水组均有所下降,在免疫组化中再次验证结果相同。因此,依达拉奉可能通过抑制细胞焦亡通路蛋白的表达,进而对大鼠心脏骤停心肺复苏后MIRI发挥保护作用。
综上所述,依达拉奉对大鼠心脏骤停心肺复苏后MIRI 起保护作用,可能机制是通过控制级联放大炎症反应,降低NLRP3、Caspase-1、GSDMD 蛋白表达,进而抑制细胞焦亡有关。
