TRV027在血管紧张素Ⅱ下调心肌细胞缝隙连接蛋白43表达中的作用
2023-05-10陈馨嵘范鑫司丹妮王明明龙章佑孙润民余静
陈馨嵘 范鑫 司丹妮 王明明 龙章佑 孙润民 余静
肾素-血管紧张素系统(Renin-angiotensin system,RAS)是调节、参与心血管系统功能和结构变化的重要组成部分,对心血管功能稳态、电解质和体液平衡的维持,以及血压的调节均有重要作用。血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)作为RAS 的关键调节因子,在病理状态下,可直接与心肌细胞膜上的Ang Ⅱ1 型受体(Angiotensin Ⅱtype 1 receptor,AT1R)结合,增加细胞内活性氧的产生,促进细胞肥大、凋亡,引起细胞内质网应激和抑制自噬等,最终影响心肌细胞的结构和功能[1~3]。
缝隙连接蛋白43(Connexin 43,Cx43)是心肌细胞间缝隙连接的主要蛋白成分,在成熟的心肌细胞中,Cx43 主要位于心肌细胞闰盘上,能在心肌细胞之间传递电流、允许化学信号和能量底物交换,是协调细胞功能所必需的结构[4]。AngⅡ可以通过减少心肌细胞Cx43 的表达而引起心肌结构和功能的异常改变[5~8]。
TRV027 是一种新型AT1R 偏向性配体,能够竞争性阻断AngⅡ与AT1R 的结合、选择性地激活β-arrestin 通路,从而抑制AngⅡ介导的交感神经兴奋、血管收缩、水钠潴留等,并且可以增强心肌细胞的收缩能力,增加心输出量,改善心功能[9~11]。因此本研究针对AngⅡ与Cx43 之间的关系,探索TRV027 是否通过抑制Ang Ⅱ并激活β-arrestin 通路对心肌细胞Cx43 产生影响。
1 材料与方法
1.1 材料
1.1.1 实验对象 选取大鼠心肌细胞H9C2 细胞株(和元生物技术股份有限公司)作为研究对象,细胞培养于含10%胎牛血清(美国Gibco 公司)、1%双联抗生素(链霉素、青霉素,美国Gibco 公司)的DMEM 高糖培养基,培养条件为37℃、5%CO2,选取第3~5 代细胞进行实验。
1.1.2 主要试剂和仪器 Ang Ⅱ、TRV027(美国AbMole 公司),GAPDH、β-arrestin 抗体、荧光二抗(中国Proteintech 公司),Cx43 抗体(美国abcam 公司),TBgreen(中国TaKaRa 公司);电泳仪、Bio-Tek 酶标仪(美国Bio-tek 公司),全自动化学发光图像处理系统(中国天能科技公司),实时荧光定量PCR 仪(美国Bio-rad 公司),倒置荧光显微镜(日本OLYMPUS 公司)。
1.2 方法
1.2.1 实验分组及处理方法 将H9C2 细胞分为对照组、AngⅡ组、TRV027 组、AngⅡ+TRV027 组。AngⅡ组用1×10-5mol/L Ang Ⅱ干预48h;TRV027 组用1×10-8mol/L TRV027 干预24h;Ang Ⅱ+TRV027组用1×10-5mol/L AngⅡ干预24h 后,给予1×10-8mol/L TRV027 干预24h,对照组细胞正常培养,无药物干预。1.2.2 蛋白质印迹(WB)法检测Cx43 和β-arrestin在H9C2 细胞内的表达 将四组细胞培养至6 孔板中,干预48h,收集细胞,加入裂解液,冰上裂解30min,12 000r/min 4℃离心20min,收集上清,按照BCA 试剂盒说明书测定蛋白浓度、计算上样蛋白量,进行SDS-PAGE 电泳,结束后将蛋白转至PVDF膜,5%脱脂牛奶封闭1.5h,TBST 洗膜,加入稀释的Cx43 一抗(1:1 000)和β-arrestin 一抗(1:700),4℃孵育过夜,TBST 洗膜,加入辣根过氧化物酶标记的二抗,室温孵育1h,TBST 洗膜,将ECL 超敏化学发光液滴加于膜上,显影、定影、拍照。用ImageJ 计算Cx43 蛋白相对表达水平。
1.2.3 RT-PCR 检测H9C2 细胞中Cx43、β-arrestin mRNA 的表达 将四组细胞培养至6 孔板中,干预48h,按照Trizol 试剂盒说明书提取总RNA,逆转录合成cDNA,取逆转录模板进行PCR 扩增。反应体系包括:模板cDNA 2μl,上下游引物各0.1μl,Taq DNA 聚合酶12.5μl,灭菌水8.5μl。扩增条件:95℃预变性30s,95℃变性5s,60℃退火30s,72℃延伸30s,共40 个循环。Cx43 上游引物:正向:5'-TGAAG TTCAGACAAGGCTCAAAGA-3',反向:5'-AATGTTGA TAGAAGCCGTTTGGTG-3';β-arrestin 上游引物:正向:5'-TGGGCAACTCAAGCACGAA-3',反向:5'-AGCTT CACCTTGACCCTGTAGGA-3'。以β-actin 为内参基因,采用2-△△CT法计算Cx43、β-arrestin mRNA相对表达水平。
1.2.4 免疫荧光法观察H9C2 细胞 将四组H9C2 细胞培养至24 孔板中,干预48h,用4%多聚甲醛固定30min,用PBS清洗5次,每孔加300μl 0.1%Triton(Cx43 检测组不加Triton),用PBS 清洗5 次,加入10%正常山羊血清37℃温箱封闭1.5h,滴加一抗100μl(Cx43 1:400,β-arrestin 1:200),置于4℃冰箱摇床孵育过夜,次日取出至室温复温1h,PBS 清洗5 次,加入荧光二抗100μl(1:400),室温避光孵育1h,PBS 清洗5 次,用1:10 染色5min,PBS 清洗5 次,置于荧光显微镜下应用FITC 通道观察H9C2细胞内Cx43、β-arrestin 的蛋白表达情况,DAPI 通道观察细胞核染色。用ImageJ 计算细胞内Cx43、β-arrestin 的相对表达水平。
1.3 统计学方法采用统计学软件SPSS 22.0 分析数据,计量资料以均数±标准差(±s)表示,组间两两比较采用LSDt检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组Cx43 和β-arrestin 的蛋白水平比较AngⅡ组H9C2 细胞Cx43(t=6.425、P=0.003)和β-arrestin(t=4.511、P=0.0004)的蛋白表达量明显低于对照组;Ang Ⅱ+TRV027 组H9C2 细胞Cx43(t=-6.530、P=0.0001)和β-arrestin(t=-7.982、P=0.00001)的蛋白表达量明显高于Ang Ⅱ组;TRV027 组Cx43(t=-5.524、P=0.0003)和β-arrestin(t=-6.137、P=0.0001)的蛋白表达量也高于Ang Ⅱ组。见表1、图1。
表1 各组H9C2 细胞Cx43 和β-arrestin 的蛋白表达水平比较(±s)

表1 各组H9C2 细胞Cx43 和β-arrestin 的蛋白表达水平比较(±s)
分组Cx43β-arrestin对照组0.63±0.010.65±0.02 Ang Ⅱ组0.42±0.040.47±0.06 TRV027 组0.71±0.060.73±0.02 AngⅡ+TRV027 组0.76±0.060.79±0.01

图1 各组H9C2 细胞Cx43 和β-arrestin 的蛋白水平比较
2.2 各组Cx43 和β-arrestin 的 mRNA 水平比较Ang Ⅱ组H9C2 细胞Cx43(t=1.682、P=0.048)和β-arrestin(t=2.869、P=0.022)的mRNA 表达量明显低于对照组;Ang Ⅱ+TRV027 组H9C2 细胞Cx43(t=-6.052、P=0.003)和β-arrestin(t=-4.748、P=0.0002)的mRNA 表达量明显高于Ang Ⅱ组;TRV027 组Cx43(t=-4.529、P=0.012)和β-arrestin(t=-3.148、P=0.019)的mRNA表达量也高于Ang Ⅱ组。见表2。
表2 各组H9C2细胞Cx43和β-arrestin mRNA水平比较(±s)

表2 各组H9C2细胞Cx43和β-arrestin mRNA水平比较(±s)
分组Cx43β-arrestin对照组0.012±0.0050.0006±0.0001 Ang Ⅱ组0.005±0.0030.0002±0.0001 TRV027 组0.015±0.0010.0006±0.0001 AngⅡ+TRV027 组0.018±0.0010.0009±0.0002
2.3 各组免疫荧光相对表达量比较根据荧光效果图及半定量分析可见,与对照组相比,Ang Ⅱ组Cx43、β-arrestin 的绿色荧光强度降低;与Ang Ⅱ组相比,Ang Ⅱ+TRV027 组Cx43、β-arrestin 的绿色荧光强度升高。荧光半定量分析结果显示,Ang Ⅱ组H9C2 细胞Cx43(t=7.038、P=0.00002)和β-arrestin(t=11.926、P=0.000001)的荧光相对表达量明显低于对照组;Ang Ⅱ+TRV027 组H9C2细胞Cx43(t=-14.049、P=0.00001)和β-arrestin(t=-6.517、P=0.00003)的荧光相对表达量明显高于Ang Ⅱ组;TRV027 组Cx43(t=-4.856、P=0.001)和β-arrestin(t=-11.426、P=0.00001)的荧光相对表达量也高于Ang Ⅱ组。见图2、表3。
表3 各组H9C2 细胞Cx43 和β-arrestin 的萤光相对表达量比较(±s)

表3 各组H9C2 细胞Cx43 和β-arrestin 的萤光相对表达量比较(±s)
分组Cx43β-arrestin对照组48.49±3.3065.19±1.71 Ang Ⅱ组28.35±3.7032.75±4.39 TRV027 组40.73±2.4264.26±1.88 AngⅡ+TRV027 组59.70±1.1351.61±2.42
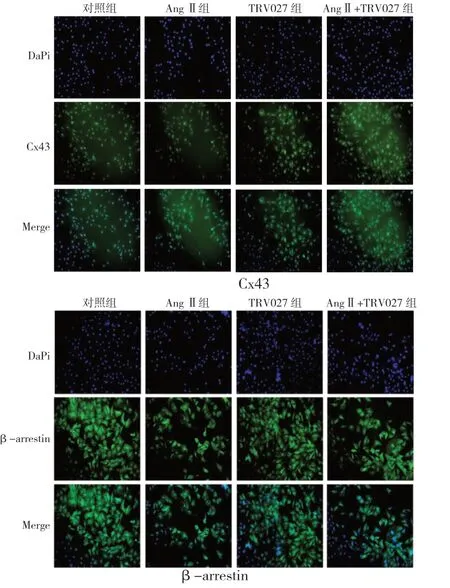
图2 各组H9C2 细胞Cx43 和β-arrestin 荧光效果图
3 讨论
心血管疾病(Cardiovascular disease,CVD)的发病率在全球范围内仍然呈上升趋势,是全球死亡和导致残疾的主要原因[12]。而RAS 的过度激活可以通过诱发炎症、细胞及组织结构重构,造成心脏和血管损伤,是CVD 发病及病情恶化的重要因素之一[13,14]。Ang Ⅱ作为RAS 的重要活性成分发挥了核心作用,例如Ang Ⅱ可引起动脉血管收缩以及钠水潴留,促进高血压、心律失常、心肌梗死、心力衰竭等CVD 的发生发展。而Ang Ⅱ主要依赖于和细胞膜表面高度特异受体的结合而发挥作用,目前已知的Ang Ⅱ受体亚型主要有两种,AT1R 和AT2R,二者都属于G 蛋白偶联受体,其中AT1R 是Ang Ⅱ发挥作用的主要受体[15]。当Ang Ⅱ和AT1R 结合后,通过激活下游的G 蛋白偶联受体介导的信号通路,在循环系统内发挥着收缩血管、调节血压和水钠平衡等作用。在高血压、充血性心力衰竭等CVD 的治疗中广泛使用的Ang Ⅱ转换酶抑制剂和AT1R 阻断剂就是通过限制Ang Ⅱ的产生或者阻断Ang Ⅱ与AT1R 受体的结合来发挥疗效。因此,阻断Ang Ⅱ的作用进而抑制RAS 的过度激活,对CVD 的防治具有重要意义。
Cx43 作为缝隙连接的主要蛋白,其数量减少和分布异常与心律失常、心力衰竭、高血压等疾病相关[16~18]。研究发现,Ang Ⅱ可以通过减少心肌细胞Cx43 的表达,增加Ⅰ型胶原蛋白的含量,从而导致心脏间质纤维化[5~7]。Ang Ⅱ还可以通过下调大鼠心房组织中Cx43 的表达,加重心房纤维化程度[19]。有学者在大鼠心肌梗死模型中发现,梗死区Cx43的表达降低,而给予VX765(一种caspase-1 抑制剂)上调了Cx43 的表达后,心肌梗死后大鼠心脏细胞间的信息传递得到了改善[20]。另有研究显示,在大鼠心肌梗死后给予Ang Ⅱ受体拮抗剂(氯沙坦),梗死区的Ang Ⅱ水平明显降低,而Cx43 在心肌组织不同区域表达增高,说明Ang Ⅱ的激活导致了Cx43 的表达降低[8]。在人体实验中也发现,给予晚期心衰患者心内膜注射过表达Cx43 可以提高注射段心肌运动能力和生存能力[21]。以上研究说明Ang Ⅱ可以下调心脏组织中Cx43 的表达,而通过阻断Ang Ⅱ可以改善Cx43 的异常表达,进而对心脏产生保护作用。而本研究结果显示Ang Ⅱ可以降低大鼠心肌细胞Cx43 的表达,这与以上研究结论相似,表明Ang Ⅱ可能通过下调心肌细胞Cx43的表达来影响心肌细胞功能。
TRV027 作为新型的AT1R 偏向性配体,一方面,TRV027 能够竞争性阻断Ang Ⅱ与AT1R 的结合,抑制Ang Ⅱ通过AT1R 介导的下游G 蛋白偶联信号通路对心血管系统的作用;另一方面,TRV027可以选择性的激活β-arrestin 介导的非G 蛋白偶联信号通路,发挥正性肌力作用,改善心脏功能[9~11]。TRV027 选择性激活β-arrestin 蛋白在病理环境中比普通AT1R 阻断剂有更好地保护心脏和脉管系统的作用[22,23]。既往研究发现,给自发性高血压大鼠中枢输注TRV027 可降低基线平均动脉压,降低血管对Ang Ⅱ的反应性[11]。体内实验研究显示,TRV027 通过与AT1R 结合、激活β-arrestin 在新生小鼠心脏中以剂量依赖性方式起到了长效正性肌力作用[24]。有学者证明了TRV027 在人体中的安全性和可耐受性,同时还发现TRV027 可以降低稳定性心力衰竭患者的平均动脉压[25,26]。这说明TRV027 能够通过阻断Ang Ⅱ与AT1R 的结合抑制Ang Ⅱ发挥作用,同时激活β-arrestin 信号通路对心脏和脉管系统起到保护作用。本研究结果显示TRV027 提高了Ang Ⅱ下调的心肌细胞Cx43 的表达,也提高了β-arrestin 蛋白的表达,机制可能是TRV027 在抑制Ang Ⅱ作用的同时激活了β-arrestin信号通路,从而改善了Cx43 的异常表达。
本研究结果表明,Ang Ⅱ可以降低大鼠心肌细胞中Cx43、β-arrestin 的表达,而TRV027 可以改善这一作用,增加大鼠心肌细胞中Cx43 和β-arrestin 的表达。因此,TRV027 可能通过阻断Ang Ⅱ与AT1R 结合、激活β-arrestin 通路,上调心肌细胞中Cx43 的表达,改善心肌细胞功能。
本研究仅限于在心肌细胞当中进行干预,没有对Ang Ⅱ介导的下游信号通路及β-arrestin 相关通路进行验证,缺少对心肌细胞功能和损伤相关检测,而且未从动物层面来探讨TRV027 的作用,后续实验将对上述问题重点研究,进一步验证TRV027对心肌细胞及心血管系统的作用机制。
