颈内静脉穿刺置管术后罕见并发症1例
2023-05-10史丽敏杜志强张有福
史丽敏,杜志强,张有福
1山西省中医药研究院,山西 太原 030000
2山西省中医院普外科,山西 太原 030000
中心静脉穿刺置管术(central venous catheterization,CVC)是指通过穿刺将特制的导管置入中心静脉,可以迅速打开中心静脉通道,进而快速展开补液、抢救等治疗,故其广泛应用于休克、急性循环衰竭等危重症的治疗中。主要的中心静脉指颈内静脉、锁骨下静脉及股静脉,其中,颈内静脉因其容易穿入且危急生命的并发症发生率较低而被常用,另因右侧颈内静脉无大的分支,几乎呈直线从上至下汇入上腔静脉,因此,右侧颈内静脉较左侧颈内静脉更为常用。CVC诱发心包积液的病例十分罕见,1991年,Cathcart-Rake Mowery[1]的研究显示,1例患者经Hickman 导管穿过上腔静脉壁进入心包并注入5-氟尿嘧啶(5-fluorouracil,5-FU)后出现了心包炎、心律失常,但未出现心包填塞。2019年Bosemani等[2]的研究显示,1例患者经右侧颈内静脉穿刺置管术后,行肺CT血管造影术(computerized tomography angiography,CTA)输注造影剂时诱发上腔静脉心包瘘。大量心包积液使心包压塞,如不及时诊治,会给患者的生命健康造成严重威胁。故本文对右侧颈内静脉穿刺置管术后出现心包积液的患者1例进行回顾性分析,以期为提高CVC术后并发症的诊断与治疗效果提供切实详尽的参考,现报道如下。
1 病历资料
患者女性,62岁,因“上腹部疼痛3天”就诊于山西省中医院,以“急性胰腺炎”收治入院。既往史:患者10年前曾因腹痛诊断为胰腺炎,经治疗后好转出院,3天前患者饭后再次出现上腹部疼痛,伴恶心呕吐。入院时查体:腹软,上腹部压痛阳性,无反跳痛及肌紧张。血常规:白细胞计数20.5×109/L,嗜中性粒细胞百分比84.2%。胰腺检查:胰淀粉酶87.5 IU/L,脂肪酶45.9 U/L。上腹部计算机断层扫描(computer tomography,CT)示胰腺走行自然,胰周间隙模糊(图1)。胸部数字X射线摄影(digital radiography,DR)示双肺未见明显异常,心影不大(图2)。

图1 CVC术前患者上腹部CT图
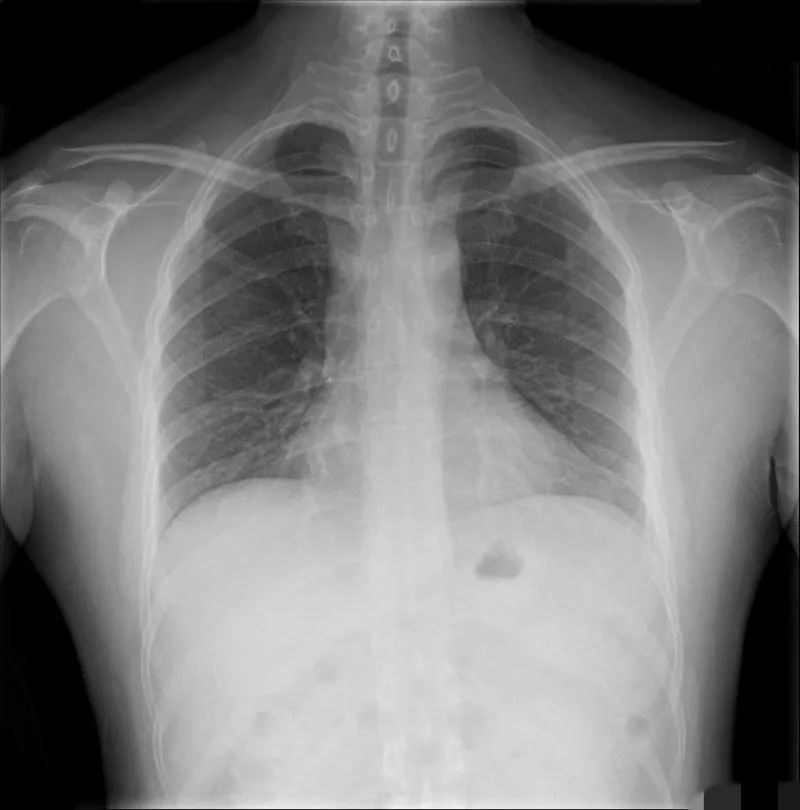
图2 CVC术前患者肺部DR图
根据患者病史、症状、体征及相关辅助检查结果初步诊断为“急性胰腺炎”,给予禁饮禁食、胃肠减压、抑酸护胃、抑制胰酶分泌、保肝、补液、营养支持等治疗,评估患者病情后于入院当日16:03行CVC(右侧颈内静脉),手术过程顺利,患者生命体征平稳。
次日14:30患者诉头晕,额头出汗,不伴恶心、呕吐,血压130/90 mmHg(1 mmHg=0.133 kPa),血糖12.2 mmol/L。15:35血压降低至70/50 mmHg,心率110次/分钟,血氧饱和度92%。立即对患者采取抢救措施,使用多巴胺、去甲肾上腺素等药物治疗,抢救后血压为120~160/50~70 mmHg。继续使用多巴胺、去甲肾上腺素维持治疗血压,根据血压调整泵速,血压维持尚可后给予乌司他汀、参麦注射液等对症治疗,检查血常规、血生化、血气分析、心肌酶谱等。心肌酶谱:肌酸激酶同工酶MB 2.4 ng/mL,肌钙蛋白Ⅰ0.08 μg/L,肌红蛋白22.0 g/L,B型钠尿肽前体798.0 pg/mL。血浆凝血酶原时间13.2 s。血气分析:血乳酸2.5 mmol/L,酸碱度pH值7.48,二氧化碳分压21.70 mmHg,实际碳酸氢盐16.00 mmol/L,标准碳酸氢盐19.50 mmol/L,阴离子隙20.8 mmol/L,剩余碱-5.90 mmol/L,动脉血氧分压65.00 mmHg,动脉血氧含量6.75 mmol/L,肺泡-动脉氧分压差95.00 mmHg。D-二聚体1045.0 μg/L,白蛋白38.3 g/L,丙氨酸氨基转移酶276.6 U/L,天门冬氨酸氨基转移酶66.2 U/L,总胆红素21.37 μmol/L,钾3.34 mmol/L,钠132.1 mmol/L,氯98.7 mmol/L。17:50患者诉心前区及后背疼痛,不除外主动脉夹层,患者在多巴胺、去甲肾上腺素维持治疗下行彩色多普勒超声,发现中量心包积液(图3)。因患者入院时胸部查体及胸部DR 未见心包积液,故考虑与颈内静脉穿刺置管术有关,随即将其拔出后于18:42在彩色多普勒超声引导下行心包积液穿刺引流术,引流液约300 ml,淡黄色,无血性。心包减压后心率为80~90次/分钟,血压平均为140/86 mmHg,胸部疼痛症状缓解。心包引流液检查结果发现,葡萄糖含量显著上升,为109.49 mmol/L(表1)。2天后复查心脏彩色多普勒超声示心包引流液量减少(图4),故将心包引流管拔除,继续行抑制胰酶分泌、保肝、抗炎、补液及营养支持等治疗,患者病情好转后出院。
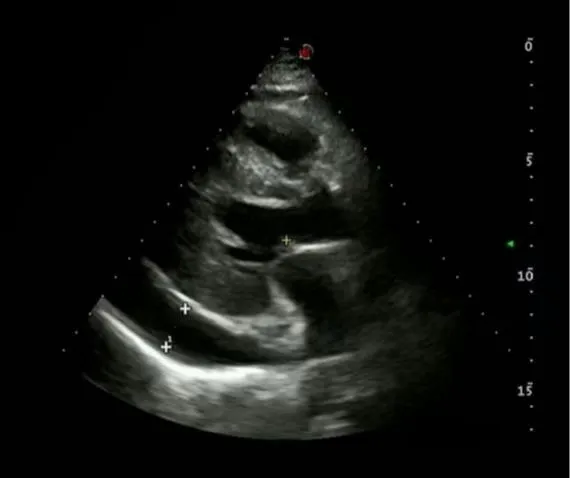
图3 CVC术后次日患者彩色多普勒超声检查
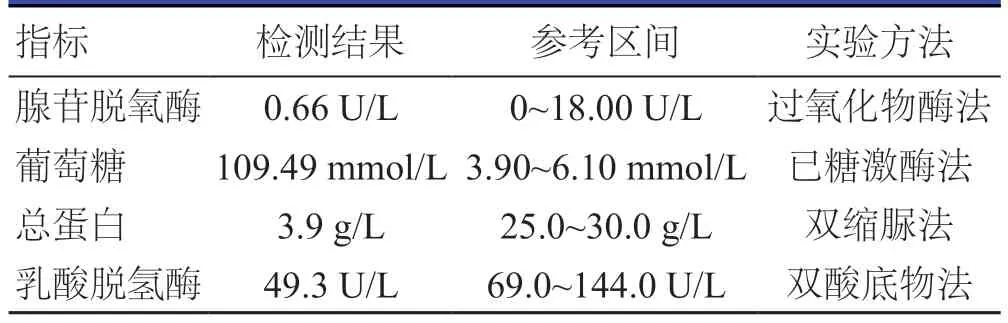
表1 心包积液测定
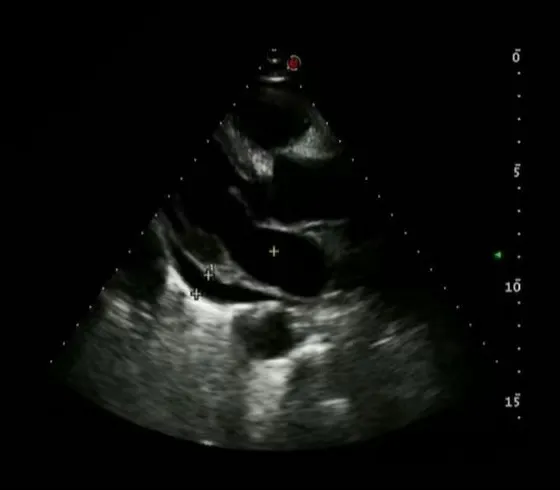
图4 CVC术后2天复查心脏彩色多普勒超声检查
2 讨论
CVC是临床医师必须掌握的基本技能之一,在迅速开展补液、抢救等治疗中发挥着不可替代的作用,但受操作医师水平以及患者本身血管条件等因素的影响,临床操作过程中的常见并发症包括穿刺误入、损伤动脉、穿刺失败、导管感染等[5-9]。许靖熠等[10]的研究显示,右侧颈内静脉穿刺时误穿入颈总动脉,拔除导管、压迫血肿时力度过大导致患者脑供血不足,穿刺时导管直接贯穿颈内静脉置于颈总动脉内。
右侧颈内静脉自上而下逐渐增粗,在甲状软骨中段以上的位置深,由后向前走行,相邻解剖结构复杂,尤其是动脉系统,其中有颈动脉窦,颈总动脉在此分出颈内和颈外动脉,其周围的脑神经也较多;环状软骨下缘的下方和甲状软骨中段以上的颈内静脉多位于颈动脉的上方,在此穿刺易形成动静脉瘘。故右侧颈内静脉穿刺置管盲穿时,定位多位于甲状软骨中段上方、环状软骨下缘上方、胸锁乳突肌前缘下方、平行于颈总动脉处外侧。右侧胸膜顶相对较低,穿刺过程中损伤胸膜顶的机会较小,并发症少,故右侧颈内静脉成为中心静脉穿刺的首选部位[11]。
在进行颈内静脉穿刺时,需注意穿刺时确保穿刺针位于静脉内,穿刺针回抽到血液时用测压针进行测压,若探针没有血液流出,说明穿刺针位于静脉内,若无测压针,可观察针管内血液有无搏动,若无搏动,亦说明穿刺针位于静脉内。穿刺成功后,置入导丝要注意深浅合适,研究显示,应从穿刺点至胸锁关节的距离加上右侧头臂静脉再加上腔静脉长度,为13.3~14.3 cm,操作者穿刺成功后经导管造影检查证实导管均已插入上腔静脉注入右心房入口处,当穿刺深度超过上述深度较多时有可能导致发生上腔静脉心包瘘[12]。
本例患者入院时查体以及胸部检查均未见心包积液,行右侧颈内静脉穿刺置管术后彩色多普勒超声发现心包积液,急诊检查心包积液发现其中葡萄糖含量显著上升,考虑与治疗过程中经中心静脉管输注含糖液体有关。Bosemani和Sakthivel[2]研究显示,上腔静脉心包瘘的瘘管可自行愈合,无需进行手术干预。本研究显示,拔除颈内静脉管并行心包穿刺引流术后患者病情明显好转,虽未行血管造影,但根据病情演变情况及辅助检查,也可推测本例患者可能发生上腔静脉心包瘘,分析原因可能与颈内静脉穿刺有关。由于患者病情危急,故出现休克症状时立即采取了相应的对症处理措施,患者病情好转。但回顾此病例,也许当时不拔除中心静脉管,只是暂时不用此通路,行心包积液穿刺引流术观察患者病情变化、经中心静脉导管造影或诊断性胸腔镜探查[2],均可加准确判断出心包积液是否与CVC 有直接关系。
B超引导下CVC相较于传统的盲穿能够有效降低相关并发症的发生率[13]。传统的盲穿技术基于解剖结构的体表定位和静脉旁动脉触诊等技巧进行,对操作者的经验和手法均有较高要求。当患者存在解剖变异、血管异常或无法触及动脉等特殊情况时,穿刺的成功率将会受到很大影响。相比之下,B超能够直观、精准的定位血管,能够探查到血管及局部解剖结构的异常,清晰地观察到穿刺过程中穿刺针的运动轨迹以及针刺的深度,故而能够显著降低穿刺导致的血肿、气肿、气胸、误穿动脉、动静脉瘘等并发症的发生率,可有效提高穿刺成功率。
综上所述,虽然颈内静脉穿刺置管术后出现心包积液的病例十分罕见,但临床医师也需严格掌握CVC相关解剖、操作步骤,当盲穿有困难时可以借助B超来提高其穿刺成功率,熟悉穿刺中及穿刺后可能出现的并发症及其相应的诊疗措施,有疑似并发症出现时应当及时、积极处理,确保患者生命安全。
