椎动脉起始部支架内再狭窄的治疗及预后分析
2023-05-10朴柄达钟红亮杨洪超贾建文
李 谈,朴柄达,钟红亮,杨洪超,贾建文,汪 阳,刘 赫
1 首都医科大学附属北京朝阳医院血管外科,北京 100020
2 首都医科大学附属北京朝阳医院神经外科,北京 100020
椎动脉的动脉粥样硬化性狭窄引起的后循环缺血事件占后循环脑卒中的25%~30%[1-3],椎动脉起始部是常见的发生部位[4-5]。传统药物治疗的效果并不理想,随着神经介入医学的不断发展,支架成形术逐渐成为治疗椎动脉起始部狭窄的主要方法[6]。支架内再狭窄(in-stent restenosis,ISR)是后循环支架置入治疗中的重要并发症,发生率为11%~43%[7-9]。关于椎动脉起始部发生ISR后如何治疗及相关预后的研究报道尚少,本研究对椎动脉起始部支架成形术后发生ISR的治疗情况及预后进行了分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2008年1月至2022年7月首都医科大学附属北京朝阳医院收治的因动脉粥样硬化性重度狭窄而行椎动脉起始部支架成形术治疗的患者的临床资料。纳入标准:(1)椎动脉起始部狭窄率≥70%;(2)规范化药物治疗无效;(3)侧支循环代偿差;(4)存在动脉粥样硬化相关危险因素。排除标准:(1)具有手术禁忌证,如重要脏器功能衰竭或对比剂过敏;(2)非动脉粥样硬化性椎动脉狭窄,如动脉夹层、动脉炎等;(3)存在严重的出血倾向,如血液系统疾病。根据纳入、排除标准,最终共纳入147例因动脉粥样硬化性重度狭窄而行椎动脉起始部支架成形术治疗的患者,其中,男性119例,女性28例;年龄50~84岁,平均(65.7±9.1)岁;入院时症状:头晕患者79例,视物不清患者1例,步态不稳患者7例,肢体无力患者22例。
1.2 ISR 的诊断及标准
根据数字减影血管造影(digital subtraction angiography,DSA)检查结果评估狭窄情况,其中,狭窄程度(%)=(1-狭窄管径/正常管径)×100%,支架成形术后狭窄程度(%)=(1-支架内最狭窄处管径/支架远端正常管径)×100%。支架内狭窄率﹥50%判定为发生ISR。治疗方式的选择:(1)对非优势供血侧且无后循环缺血症状的ISR患者首选继续进行双抗血小板药物治疗。(2)对优势或均势供血侧的ISR患者实施球囊扩张或再次支架成形术。(3)对发生支架断裂的ISR患者实施再次支架成形术。
1.3 抗血小板药物治疗方法
所有患者术前规律口服双抗血小板药物阿司匹林100 mg/d 和氯吡格雷75 mg/d,口服时间为5~7 d。使用血栓弹力图对血小板功能抑制情况进行检测,血小板功能抑制检测结果均合格后对狭窄动脉行支架成形术。若血小板功能抑制检测结果未合格,则于术前及术后将氯吡格雷剂量加倍(150 mg/d)或加服西洛他唑50 mg,每天2次,或将氯吡格雷替换为口服替格瑞洛90 mg,每天2次,使花生四烯香酸(arachidonic acid,AA)及二磷酸腺苷(adenosine diphosphate,ADP)途径诱导的血小板抑制率达到合格。无论患者术后是否发生ISR,均需口服双抗血小板药物12个月。
1.4 血小板抑制率检测方法
采集患者静脉血并将其装入一个肝素化抗凝管和一个枸橼酸抗凝管,使用血栓弹力图将所有样本于2 h 内进行检测,包括阿司匹林作用于AA通道的血小板抑制率和氯吡格雷作用于ADP通道的血小板抑制率。分别根据AA通道、ADP通道的抑制率对阿司匹林和氯吡格雷的血小板抑制效果进行评定,具体标准如下:AA通道血小板抑制率﹤50%为阿司匹林抵抗,ADP通道血小板抑制率﹤30%为氯吡格雷抵抗[10]。
1.5 手术方法
首先于腹股沟处进行局部麻醉,术中进行全身肝素化。采用Seldinger技术置入动脉鞘,通过导引导管在导丝的配合下留置于锁骨下动脉起始部或无名动脉,为了增加稳定性,经导引导管再送入一条微导丝至肱动脉。将0.014英寸微导丝经头端送至V2段。将球囊扩张支架输送至适当位置后充盈球囊,狭窄血管形态扩张满意后将球囊撤出,留置支架。对于ISR后需要进行球囊扩张或支架成形术的患者,在微导丝的配合下将外周球囊或球囊扩张支架(其直径型号一般是狭窄远端正常管腔直径的80%)送至狭窄病变,充盈扩张或释放球囊扩张支架。
1.6 随访及观察指标
术后,采用门诊复查的方式对全部患者进行影像学随访,随访检查方式包括DSA 或计算机断层扫描(computer tomography,CT)血管造影、椎动脉彩色多普勒超声。分析支架成形术前与术后狭窄率情况,ISR发生情况及ISR症状与椎动脉直径、供血侧别的关系,以及不同ISR症状患者的治疗情况。
1.7 统计学方法
应用SPSS 26.0软件对数据进行统计学分析,计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法;正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;非正态分布的资料以M(P25,P75)表示,组间比较采用秩和检验。P﹤0.05为差异有统计学意义。
2 结果
2.1 手术情况
147例因动脉粥样硬化性重度狭窄而行椎动脉起始部支架成形术治疗的患者中,行支架成形术的椎动脉共149条,共留置149个支架,手术成功率为100%(147/147)。术后1个月,头晕、视物不清、肢体无力等临床症状均得到不同程度的缓解。术后影像学复查结果显示,147例患者中,发生ISR 患者共20例,症状加重的ISR患者9例,症状未加重或无症状的ISR患者11例(无症状闭塞患者2例)。
2.2 支架成形术前与术后随访狭窄率
未发生ISR 患者和发生ISR 患者的术前动脉狭窄率分别为(73.7±7.6)%、(76.4±8.3)%,术后动脉狭窄率分别为7.4%(6.1%,9.6%)和8.9%(7.4%,10.3%)。症状加重的ISR 患者的术前动脉狭窄率为(79.4±7.1)%,术后动脉狭窄率为9.4%(8.2%,11.4%);症状未加重的ISR 患者的术前动脉狭窄率为(75.2±8.1)%,术后动脉狭窄率为7.5%(6.8%,8.6%)。
2.3 随访情况
首次术后随访时间为(8.9±3.3)个月,术后随访率为93.2%(137/147)。137例患者中,68例患者随访复查DSA,14例患者随访复查CT血管造影,55例患者随访复查椎动脉彩色多普勒超声。对再次行球囊扩张或支架成形术后患者随访复查DSA,随访时间为(7.6±2.6)个月,无患者再次发生ISR。不同病变动脉直径、供血侧别动脉粥样硬化性重度狭窄患者的术后ISR发生情况及症状情况比较,差异均有统计学意义(P﹤0.05)(表1、表2)。20例发生术后ISR的患者中,再次介入手术治疗率为35%(7/20),其中,椎动脉直径≥3.5 mm和椎动脉直径﹤3.5 mm的患者分别是4例和3例;优势及均势供血侧、非优势供血侧的患者分别是4例和3例。20例发生ISR的患者中,9例患者出现了头晕等症状或原有的症状加重,经进一步治疗后症状改善;2例患者接受再次支架成形术;5例患者接受再次球囊扩张术。随访期间,20例发生ISR的患者均未见新发症状及症状未再次加重。

表1 动脉粥样硬化性重度狭窄患者术后ISR发生情况与术前椎动脉直径、供血侧别的关系
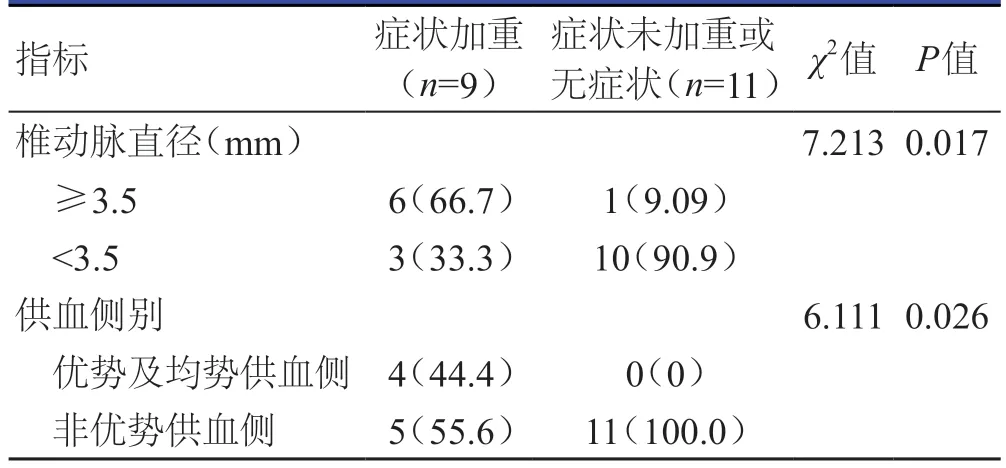
表2 动脉粥样硬化性重度狭窄患者术后ISR症状与椎动脉直径、供血侧别的关系
3 讨论
相对于其他部位,如颈动脉颅内段、颅外段,椎动脉颅内段及基底动脉等部位,椎动脉起始部支架成形术后ISR的发生率较高[11],ISR是限制椎动脉支架置入的重要因素[12-13],ISR通常发生于支架成形术后6~12个月[14]。发生ISR的主要影响因素如下:(1)直径较小的动脉具有较高的ISR发生风险。Chen等[15]的研究指出,在直径较小的椎动脉起始部行支架成形术更容易发生ISR。有研究同样发现较小的动脉直径与术后较高的ISR发生率有关[16]。本研究发现,以3.5 mm为界限,椎动脉直径﹤3.5 mm的ISR发生率高于椎动脉直径≥3.5 mm的ISR发生率。(2)ISR的发生与血流动力学情况有关,双侧椎动脉最终汇入基底动脉,双侧之间存在血流动力的相互影响[17]。本研究发现,相较于优势及均势供血侧,非优势供血侧ISR的发生率更高。因此,本研究认为,由于向基底动脉供血时,双侧椎动脉前向血流相互影响,非优势供血侧的前向血流偏弱,故优势及均势供血侧单位时间内的血流量更大,非优势供血侧的血流量相对较缓,进而导致ISR的发生。然而,本研究未采集到相关的血流动力学数据,该观点仍需进一步的证据证实。
本研究结果显示,动脉粥样硬化性重度狭窄患者术后发生ISR后的症状与椎动脉直径、供血侧别密切相关。在发生ISR的20例患者中,11例患者无症状或症状未加重;2例患者发生了无症状闭塞,9例患者出现了症状加重的情况,但对于椎动脉直径≥3.5 mm的支架成形术后患者,虽然ISR的发生率较低,但发生ISR后出现的头晕、走路不稳的症状可能较为严重。本研究亦发现,在发生ISR的20例患者中,仅有7例患者的椎动脉直径≥3.5 mm,却有6例患者出现了头晕、步态不稳的症状或原有症状明显加重,经治疗后症状缓解,因此,椎动脉起始部重度ISR患者的症状与椎动脉直径、供血侧别有关。对于椎动脉直径﹤3.5 mm,尤其是非优势供血侧的病变,发生ISR后症状加重不明显。另外,优势及均势供血侧有4例患者发生ISR,症状加重患者4例;非优势供血侧有16例患者发生ISR,症状加重患者5例。因此,虽然优势及均势供血侧ISR的发生率相对较低,一旦发生ISR,患者的症状可能加重得更明显,需要再次进行治疗。
对于已经发生ISR的患者,应积极进行相应的治疗,并阻止狭窄的发展进程。通常来说,药物治疗必不可少[18-19],同时需要根据具体情况有选择性地再次实施球囊扩张或支架成形术,这通常与发生ISR后的症状有关。因为椎动脉直径﹤3.5 mm或非优势供血侧椎动脉发生ISR的患者,其症状通常不会加重或无症状,所以不建议再次积极地进行血管内治疗,这样患者既可以避免手术风险,也无需面临术后依旧较高的再狭窄发生风险。药物治疗(双抗血小板治疗,阿司匹林100 mg/d、氯吡格雷75 mg/d)不仅可以延缓动脉狭窄的进程,还可以使另一椎动脉有相对较长的代偿时间。然而,对于直径≥3.5 mm或优势及均势供血侧椎动脉发生ISR的患者,症状通常更严重,甚至可能危及生命。在症状持续加重的情况下,应及时行球囊扩张或支架成形术,改善血流,为其他动脉代偿的建立争取时间[17]。
椎动脉开口连接的锁骨下动脉位于胸廓内且相对固定,随着颈椎的过度屈伸、旋转,椎动脉远端在横突孔内进行各种维度的运动,同时也受到胸廓呼吸活动的影响,因此,椎动脉起始部的支架更容易因金属疲劳性而致支架断裂、塌陷,最终导致ISR的发生[20]。本研究发现,在20例发生ISR的患者中,有2例患者出现了支架断裂并引发ISR,此时因无法单纯实施支架内球囊扩张术而实施再次支架成形术,其余患者均采用支架内球囊扩张术。第二次支架成形术后的随访率为85.7%(6/7),治疗效果均较好,患者均未再次发生ISR。本研究中,支架置入术后随访率较高,但需要扩大样本,延长随访时间,从而得出更加客观、准确的结论。
综上所述,椎动脉起始部支架成形术后椎动脉直径﹤3.5 mm或非优势供血侧更易发生ISR,但发生ISR后大部分患者的症状较轻,可通过介入治疗或药物治疗获得较好的预后。椎动脉直径≥3.5 mm或优势及均势供血侧的ISR发生风险较低,一旦发生ISR,患者的症状可能更严重,可以通过再次进行球囊扩张或支架成形术获得较好的预后。
