人骨髓间充质干细胞来源外泌体分离、鉴定及卵巢摄取
2023-05-08杨雨涛王袁谢嘉欣付霞霏
杨雨涛,王袁,谢嘉欣,付霞霏
骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)为一种成体干细胞,因其自我更新、诱导分化等特点,对神经系统等疾病有治疗作用[1]。外泌体(exosome,Exo)是一种直径为30~150 nm 的细胞外囊泡,可传递蛋白质、脂质和核酸,具有靶向细胞功能,是间充质干细胞发挥作用的重要途径[2-3]。研究已证实Exo 在心脏、骨等相关疾病及再生方面发挥重要作用[4-6]。颗粒细胞是卵巢的基础功能单位,位于卵母细胞透明带外侧,支持卵母细胞生长、发育和成熟[7]。早发性卵巢功能不全(premature ovarian insufficiency,POI)是一种常见的妇科内分泌疾病,4%~30%POI 的发生有自身免疫失调参与[8]。研究发现,颗粒细胞中Epg5基因表达失调可以导致POI发病,可见颗粒细胞异常在POI发生发展中起关键作用[9]。目前研究多集中于干细胞治疗自身免疫性POI,但人骨髓间充质干细胞(human bone mesenchymal stem cell,hBMSC)来源Exo治疗自身免疫性POI相关研究甚少。本研究通过提取hBMSC来源Exo,观察人卵巢颗粒细胞(KGN)及自身免疫性POI小鼠卵巢组织摄取Exo的情况,为探索该Exo治疗自身免疫性POI的生物学作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 3 只SPF 级雌性BALB/c 小鼠(7~8 周龄),体质量18~22 g,均购自南方医科大学实验动物中心,动物生产许可证号:SCXK(粤)2020-0052。小鼠均在适宜温度(30±2)℃和光照周期(14 h 光照/10 h 黑暗)下自由摄食饮水。
1.1.2 主要试剂与仪器 hBMSC 由南方医科大学珠江医院再生医学研究所提供;KGN 细胞购自广州捷威斯生物公司;胎牛血清(fetal bovine serum,FBS)购自上海依科赛生物公司;DiR 染料购自苏州宇恒生物公司;CD63 兔单克隆抗体购自英国Abcam 公司,CD9、肿瘤易感基因(TSG)101 兔单克隆抗体购自华安生物公司;羊抗兔抗体购自康为世纪生物公司;ZP3蛋白多肽购自中国捷威生物科技公司;荧光倒置显微镜、共聚焦显微镜(德国莱卡公司);纳米流式仪(厦门福流公司);低速离心机(德国Eppendorf公司);高速冷冻离心机、超高速冷冻离心机、透射电镜(日本日立公司);超灵敏度化学发光成像系统(美国Bio-Rad 公司);IVIS Spectrum 小动物活体光学成像系统(上海PerkinElmer公司)。
1.2 方法
1.2.1 无Exo FBS制备 将普通FBS于1×105r/min,4 ℃超高速离心12 h,得到上清液,用0.22 µm 滤膜过滤后得到无Exo FBS。
1.2.2 hBMSC 及KGN 细 胞 培 养 hBMSC 及KGN 细 胞 均 于37 ℃、5%CO2细胞培养箱中培养。取P3 至P9 代hBMSC,加入完全培养基培养细胞,当其生长至70%~80%时,更换培养基,PBS 清洗,用无Exo FBS 与DMEM/F12 配制成10%无Exo完全培养基继续培养48 h,收集上清液于-80 ℃冰箱冷冻储存。取P4代hBMSC,在倒置显微镜下观察细胞形态。
1.2.3 超高速离心法提取Exo 将冻存的细胞上清液于4 ℃过夜融化,在4 ℃下以2 000 r/min离心20 min,去除细胞碎片等沉淀物,再在4 ℃下以10 000 r/min离心30 min去除亚细胞成分,然后以1×105r/min 超离心90 min 得到沉淀物,尽可能完全清除上清液,将每管中的沉淀重悬于PBS中,以1×105r/min超离心90 min,得到的最终沉淀物即为Exo。
1.2.4 纳米流式仪测Exo粒径 将分离到的Exo待测样本用1 mL经过滤的PBS混匀,按照纳米流式仪说明书缓慢注入机器进行上样,检测粒径。
1.2.5 透射电镜(transmission electron microscope,TEM)观察Exo形态 将Exo样本交由广东省科学院微生物研究所检测其形态。吸取Exo样品滴于铜网上,2 min后用滤纸从铜网边缘吸去多余的液体。滴加3%磷钨酸(pH=7.0)于铜网,2 min后用滤纸从铜网边缘吸去多余染液。滴加纯水于铜网,用滤纸从铜网边缘吸去多余水,待干后用于TEM观察。
1.2.6 Western blot 检测Exo CD63、CD9、TSG101 膜蛋白表达 BCA 法测定Exo 蛋白浓度,将Exo 蛋白样品经SDSPAGE 电泳、转膜、封闭,加入CD63(1∶1 000)、CD9(1∶500)、TSG101(1∶1 000)单克隆抗体4 ℃过夜孵育,室温摇床孵育二抗90 min。在膜上滴加适量ECL化学发光液,通过化学发光成像系统分析蛋白表达。
1.2.7 Exo 荧光标记 按照DiR 说明书的步骤进行操作。hBMSC-Exo悬液中加入50µmol/L DiR在37 ℃孵箱中避光孵育30 min。然后加入一定量的PBS液重悬,1×105r/min,4 ℃,超高速离心70 min,弃掉上清液,使已标记的Exo与未结合的DiR染料分离。
1.2.8 共聚焦显微镜观察Exo 内化 将KGN 细胞种板在共聚焦小皿中,加入20 mg/L DiR标记的Exo,避光,37 ℃共孵育24 h 或48 h。然后PBS 轻柔清洗2 次,加入1 mL 4%多聚甲醛溶液固定5 min,PBS 清洗3 次,每次5 min。加入DAPI 染料,避光孵育5 min,PBS清洗3次,每次5 min。最后加入50µL抗荧光淬灭封片剂,避光,通过共聚焦显微镜观察KGN细胞能否摄取Exo(KGN 细胞核周围有红色荧光即DiR 标记的Exo)及摄取量。
1.2.9 活体成像观察POI 小鼠摄取Exo 将ZP3 蛋白多肽(NSSSSQFIHGPR)以1 g/L溶解于蒸馏水,再将其乳化成等体积的完全弗氏免疫佐剂(complete Freund's adjuvant,CFA)和不完全弗氏免疫佐剂(incomplete Freund's adjuvant,IFA)。在所有小鼠后脚和腹部皮下注射0.15 mL 含75µg ZP3 多肽的CFA乳剂。14 d后用0.15 mL含75µg ZP3多肽的IFA乳剂在相同部位进行第2次皮下注射。第2次免疫6周后,小鼠出现动情周期不规则或延长的现象,提示成功建立自身免疫性POI 小鼠模型。建模后第1 天,小鼠腹腔注射150µg DiR 标记的Exo;建模后第7 天,再次腹腔注射150 µg DiR 标记的Exo。在第2次注射Exo后的第14天,通过活体成像仪观察小鼠摄取Exo的情况。
2 结果
2.1 hBMSC细胞形态 hBMSC在达到80%~90%汇合后呈纺锤状,大小均一,贴壁良好,见图1。
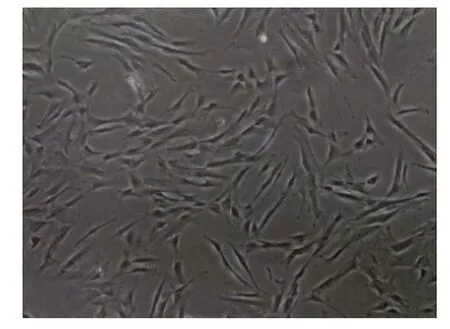
Fig.1 The morphology of hBMSC(×400)图1 hBMSC的形态(×400)
2.2 Exo 粒径及形态分析 所提取出的Exo 平均直径为(81.12±17.23)nm,与Exo粒径范围(30~150 nm)相符合,见图2。TEM 下可见Exo 呈典型的双层膜状,见图3。
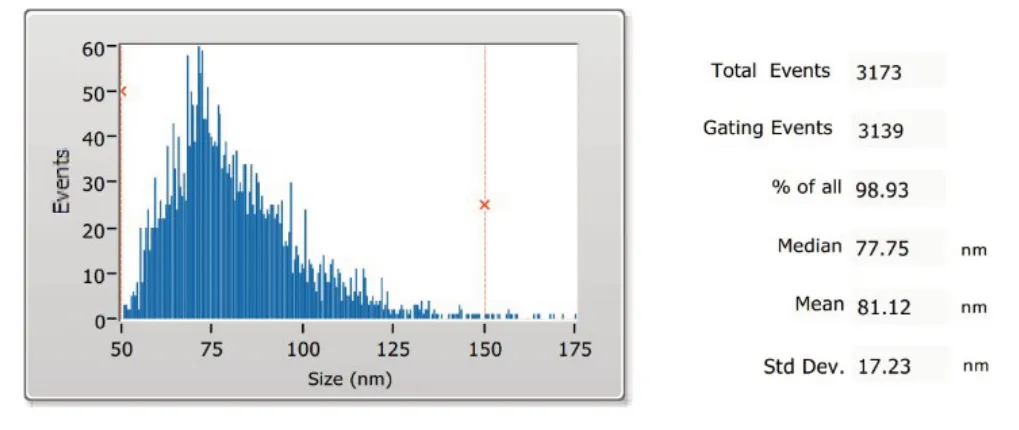
Fig.2 The particle size of hBMSC-derived Exo图2 hBMSC来源Exo的粒径
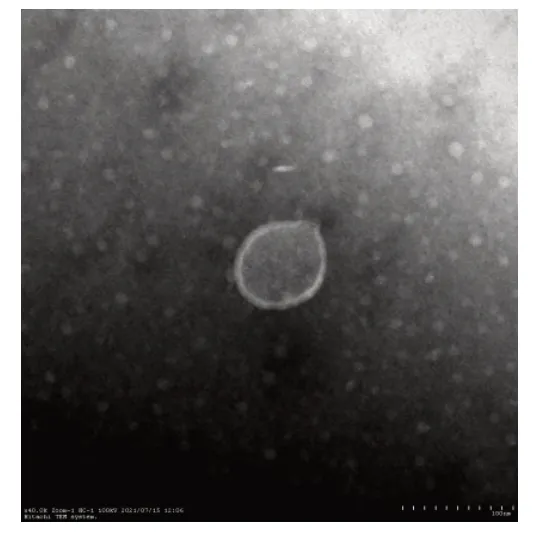
Fig.3 The morphology of hBMSC-derived Exo(The scale is 100 nm)图3 hBMSC来源Exo的形态(比例尺为100 nm)
2.3 Exo中CD63、CD9、TSG101膜蛋白表达 CD63、CD9和TSG101膜蛋白在hBMSC来源Exo中呈阳性,见图4。
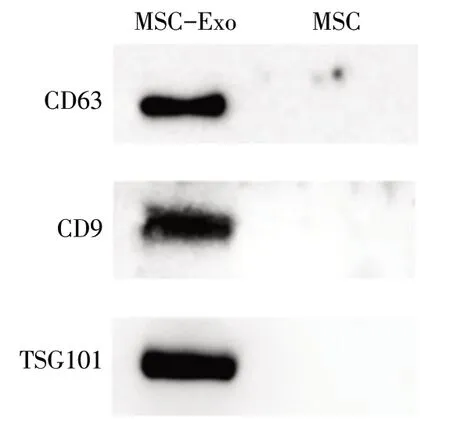
Fig.4 Expression of CD63,CD9 and TSG101 membrane proteins in Exo图4 Exo中CD63、CD9、TSG101膜蛋白表达
2.4 KGN 细胞摄取Exo 情况 与共孵育24 h 相比,共孵育48 h 的细胞核周围红色荧光强度更强,摄取Exo量更多,见图5。
2.5 小鼠卵巢组织摄取Exo 活体成像仪观察到3只小鼠卵巢部位有发光信号,通过腹腔注射,Exo可被小鼠卵巢组织摄取,见图6。
3 讨论
近年来,随着更多标准化的纯化和分析程序的开发,BMSC 来源Exo 的提取效率得到提高,在疾病治疗中受到广泛关注及应用[10-11]。POI 严重威胁女性的生殖健康和生活质量,免疫因素是其常见病因,目前缺乏有效治疗方法,临床上以激素补充等对症治疗为主,但达不到满意的疗效。相较于干细胞而言,MSC 来源的Exo 具有低免疫原性、低恶性潜能、易于储存和移植等优点,在POI治疗中受到关注[12]。本研究通过超高速离心提取hBMSC 来源Exo,观察到KGN 细胞及自身免疫性POI 小鼠卵巢组织摄取Exo,提示hBMSC来源Exo有望成为治疗自身免疫性POI的新思路。
Rhim 等[13]应用ZP3 诱导小鼠出现自身免疫性卵巢炎,类似于人类自身免疫性POI,此后大量学者均采用该方法构建免疫性POI 模型进行实验研究。本课题组经多次实验验证,建模后的模型动物在卵巢组织结构和功能上均与人类自身免疫性POI表现相似,拟合度及成功率较高,因此选用ZP3多肽构建自身免疫性POI动物模型。自1980年Exo在网织红细胞成熟过程中首次被分离出后,越来越多研究证明,大多数细胞如间充质干细胞、B 细胞、T 细胞、上皮细胞、内皮细胞及少突胶质细胞等均可释放Exo[6]。本研究通过超速离心法得到纯度较高的hBMSC 来源Exo。Exo 的分离和纯化方法包括超速离心法、超滤法、尺寸排斥色谱法和基于微孔板的磁免疫捕获法[14-15]。虽无统一鉴定标准,但超速离心法在不同的研究中均被证明有效,且其分离Exo 纯度和回收率高,同时最大限度减少蛋白质聚集体和其他膜粒子的共纯化,有利于保护Exo的功能,是目前分离提纯Exo的主要技术[16]。
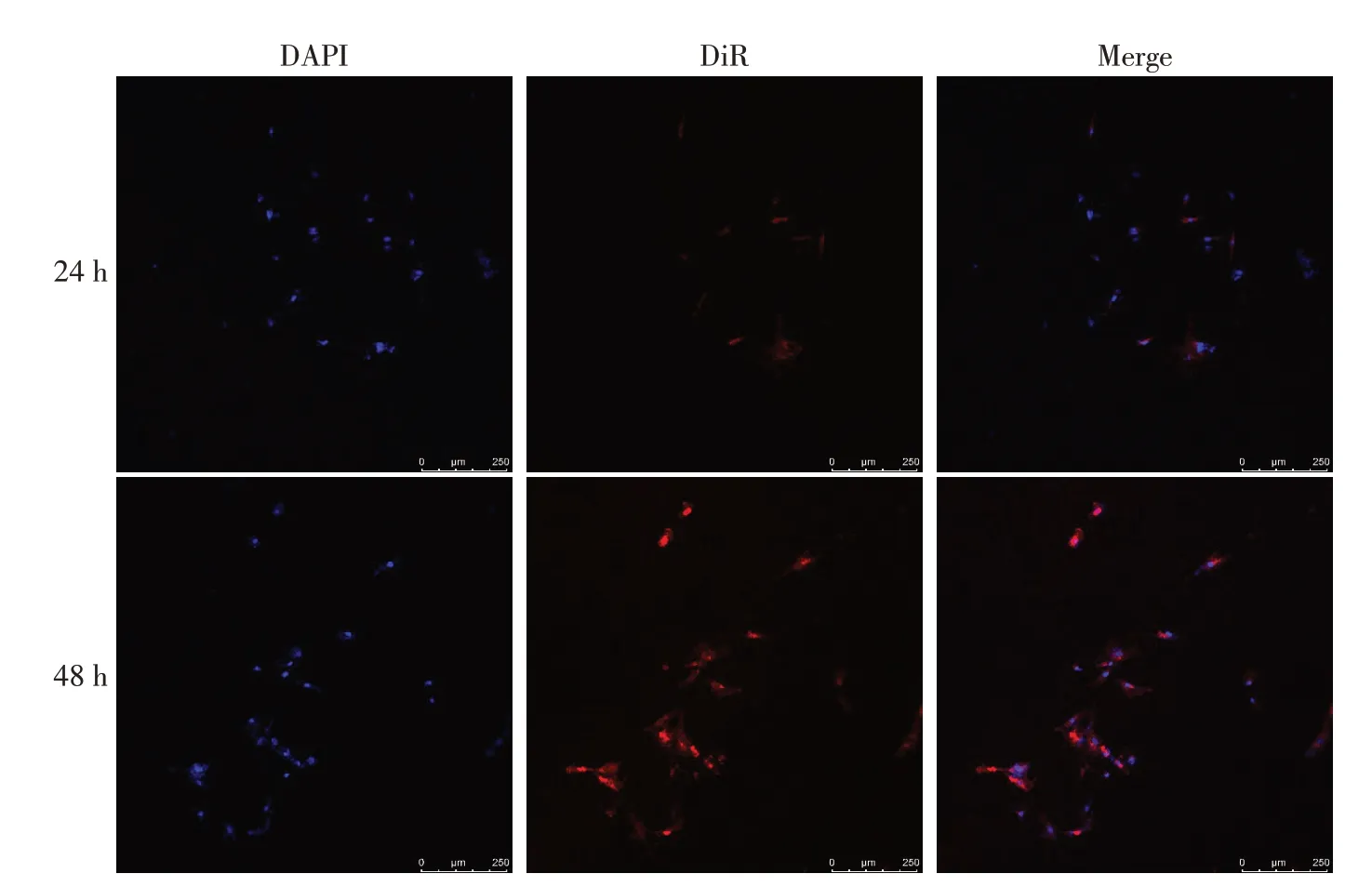
Fig.5 The uptake of hBMSC-derived Exo by KGN cells observed by confocal microscopy图5 共聚焦显微镜观察KGN细胞摄取hBMSC来源Exo
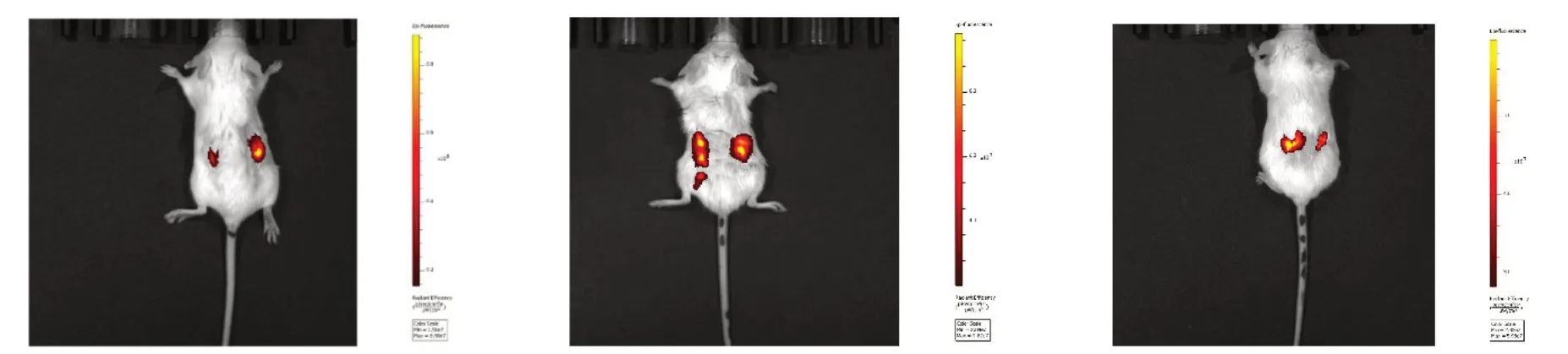
Fig.6 Exo uptake in ovarian tissue observed by fluorescence imaging in vivo图6 活体荧光成像观察卵巢组织摄取Exo
BMSC 作为最经典的间充质干细胞,取材方便,易分离培养。BMSC 分泌的Exo 可携带多种物质如蛋白、miRNA 及脂类等,抑制外周血单个核细胞分泌干扰素γ,并具有免疫调节、组织修复刺激、迁移、增殖、抗炎和抗氧化作用[17]。在体外,鼠源BMSCExo 可被化疗损伤的颗粒细胞内吞,抑制颗粒细胞凋亡;在化疗导致的卵巢早衰模型中,小鼠卵巢原位注射Exo 后可促进卵巢内血管生成,改善小鼠的卵巢结构和功能[18]。本研究中KGN 细胞成功摄取了hBMSC 来源Exo,且与共孵育24 h 相比,48 h 的摄取量更多,初步说明Exo 能被体外细胞摄取,且Exo 摄取量与共孵育时间也有一定关系。在免疫性POI小鼠体内观察到腹腔注射Exo 后其卵巢组织摄取Exo的现象,证明Exo可到达小鼠卵巢组织,被卵巢组织摄取内吞,但还需进一步明确hBMSC 来源Exo 在自身免疫性POI的治疗作用及其机制。
在体内,不同的注射方式会影响Exo 摄取。动物体内注射Exo 常用方法有尾静脉、腹腔及原位注射,其中尾静脉注射较为常用。静脉注射Exo在肝、脾和肺中富集,容易导致静脉堵塞,被血液中的巨噬细胞清除掉,影响Exo 到达靶器官从而减弱治疗作用。腹腔注射Exo 可形成更分散的分布模式,且在内脏脂肪组织中可观察到明显的Exo积累[19]。与静脉或腹腔注射Exo相比,原位注射Exo虽然可减少脱靶递送并增加靶组织的暴露并减少Exo 的清除[20],但其更具有创性,易造成动物的大量失血或感染甚至死亡。在Exo治疗化疗致POI的研究中,多数研究者采用尾静脉注射方式进行体内动物实验[18,21],极少数会采取原位卵巢注射及腹腔注射方式[22-23]。本研究采取腹腔注射Exo的方式,观察到Exo在第2次注射后的第14天可以归巢到小鼠卵巢中,证明腹腔注射的可行性。
综上所述,本研究顺利分离提纯出hBMSC来源Exo,并观察到KGN细胞及自身免疫性POI小鼠卵巢组织能够摄取Exo,为相关研究者提供参考。
