电沉积合成镍/氢氧化镍/聚苯胺薄膜及其电容特性
2023-05-08邹呈骏洪佳斌吴永麟王春香李之锋
邹呈骏, 洪佳斌, 吴永麟, 王春香, 李之锋*
(江西理工大学,a.材料冶金与化学学部;b.江西省动力电池及材料重点实验室,江西 赣州 341000)
近年来, 金属氧化物/氢氧化物作为赝电容电极材料有着高理论比容量而引起许多研究者的广泛关注。 其中,Ni(OH)2因环境友好、氧化还原活性好、成本低等优点而备受关注[1-6]。 然而,由于 Ni(OH)2的导电性较差,且具有较高的电荷转移电阻,使得其实际储能性能远低于理论比容量[7];此外,在充放电过程中Ni(OH)2体积变化大,使得活性材料从电极表面脱落[8-9],这些导致 Ni(OH)2循环稳定性和电容性能较差。 因此,将 Ni(OH)2作为赝电容电极材料在一定程度上受到了限制[10]。
为了克服上述缺点, 一种有效的策略是通过Ni(OH)2与其他导电材料复合的方式来提高其循环稳定性和电容性能[11]。 目前,碳纳米材料和导电聚合物是超级电容器中研究较多的导电材料。 其中石墨烯、碳纳米管成本较高,而导电聚合物具有良好的导电性、低成本和制备简单等优点,使之成为超级电容器电极材料最有希望的候选材料之一。 例如:聚苯胺(PANI)因其合成简单、环境友好和显著的电化学性能而广受关注。MADHUMITA 等[12]采用化学聚合法构建 Ni(OH)2@PANI 纳米片复合材料,在 2 A/g 时表现出 622 F/g 的比电容;ZHANG 等[13]采用两步水热法制备了PANI/Ni(OH)2复合材料,在电流密度为 0.5 mA/cm2时,比电容达 55.50 F/g;HUO 等[14]采用化学聚合法合成PANI/Ni(OH)2复合材料,在电流密度为1 mA/cm2时,比电容为310 F/g。 值得注意的是,构建此类复合材料的大多数方法通常是耗时的过程,且需要使用黏结剂附着于基底,这导致了内阻增加以及性能降低。因此研发低成本、简单、高效的制备方法可以促进Ni(OH)2/PANI 复合电极材料的推广应用。
电化学合成具有绿色环保、成本低、反应时间短和反应条件容易控制等特点。 为此,采用电化学合成方法合成无需黏结剂的Ni/Ni(OH)2/PANI 复合电极材料,该电极中纳米级金属 Ni 和 Ni(OH)2两相共存结构可有效改善 Ni(OH)2的导电性能,在 Ni/Ni(OH)2基体上沉积一层纳米片状的PANI,可以改善复合电极与电解液的界面接触,降低电荷转移阻抗。 测试结果表明,形成此类复合结构可有效提高Ni(OH)2电极材料的电容特性和电化学循环稳定性。
1 实验方法
1.1 材料制备
所用药剂乙酸镍(Ni(CH3COO)2)、氯化钠(NaCl)、硫酸钠(Na2SO4)和苯胺(C6H7N)均为分析纯。 铜箔(2 cm×3 cm)用做沉积基底,首先将其用砂纸打磨。然后用盐酸清洗,最后用蒸馏水超声清洗后,放置于50 ℃真空干燥箱中干燥备用。
将醋酸镍(0.249 g)和氯化钠(0.058 g)溶解于100 mL 去离子水中, 形成各物质浓度为0.01 mol/L的混合溶液作为电解质。首先在以铜箔为阴极和阳极的双电极系统中进行直流电沉积合成Ni/Ni(OH)2,电压为1.5 V,沉积时间30 min,电沉积结束后,用去离子水清洗 Ni/Ni(OH)2沉积薄膜,并在 50 ℃的鼓风干燥箱中烘干,Ni/Ni(OH)2纳米复合膜在铜箔基体上的面密度为0.508 mg/cm2; 然后采用传统的三电极体系在Ni/Ni(OH)2纳米复合膜上制备聚苯胺(PANI),以 Ni/Ni(OH)2为基体、Pt 电极和Ag/AgCl 电极(3 mol/L KCl)分别作为工作电极、辅助电极和参比电极, 电化学聚合的电解质为0.1 mol/L C6H7N(0.186 g)和 0.1 mol/L KNO3(0.202 g)组成的水溶液, 在1.25 V 恒定电压下, 电聚合时间分别为50、100、150、200、250 s 下获得 Ni/Ni(OH)2/PANI 纳米复合膜;最后用去离子水洗涤,并在鼓风干燥箱中50 ℃干燥备用。 按照电聚合时间由小到大的顺序Ni/Ni(OH)2/PANI 纳米复合膜的面密度分别为0.613、0.787、0.906、1.100、1.180 mg/cm2。
1.2 结构和性能表征
通过扫描电子显微镜 (SEM, Zeiss EVO/MA10)和透射电子显微镜(TEM, JEOL JEM 2100)对样品的形貌和微观结构进行表征。 采用X 射线光电子能谱(XPS, Kratos Axis Ultra DLD) 测定样品元素的组成与价态。 采用傅里叶变换红外光谱仪 (FT-IR,Nicolet/IS10)对样品的化学键和官能团进行分析。 在武汉科斯特电化学分析仪上进行了电化学测量,将剪裁好的样品(1 cm×1 cm)、铂片电极和 Ag/AgCl 电极分别作为工作电极、辅助电极和参比电极,以1 mol/L NaOH 水溶液为电解质,在三电极体系中采用循环伏安法(CV)、恒电流充放电法(GCD)和电化学阻抗谱法(EIS)对样品的电化学性能进行测试。
2 结果与讨论
2.1 Ni/Ni(OH)2/PANI 复合膜的形貌和结构
图1 所示为 Ni/Ni(OH)2(图 1(a))和不同电沉积时间的 Ni/Ni(OH)2/PANI 复合膜(图 1(b)—图 1(f))的 SEM 图,图 2 所示为 Ni/Ni(OH)2的 TEM 和 SAED图以及 PANI 和 Ni/Ni(OH)2/PANI 的 EDS 图谱。从图 1(a)中可以看出,纳米片状的 Ni/Ni(OH)2复合材料垂直沉积在铜箔集流体表面,形成蜂窝状构型,这种构型可以增加 Ni(OH)2与电解液的接触面积。 Ni/Ni(OH)2复合材料的结构与成分由透射电镜图进一步验证,在图 2(a)中显示 Ni/Ni(OH)2为纳米片构型,与图 1(a)结构相似。 从图 2(b)可以发现 Ni/Ni(OH)2两相共存,证实了纳米片状的材料为 Ni/Ni(OH)2复合材料,同时这种共存结构可以提升Ni(OH)2的导电性能。从图1(b)—图 1(f)可以看出,随着电沉积时间的延长,沉积在 Ni/Ni(OH)2材料表面的微米片状 PANI 颗粒逐渐增加。 电沉积时间达到 150 s 时 (图 1(d)),PANI 颗粒均匀分布在 Ni/Ni(OH)2材料表面,当时间到达 200 s 以上时(图 1(e)—图 1(f)),PANI 微米片发生严重的堆积与团聚, 这种形貌会在一定程度上阻碍电解液离子的运输,不利于电解液离子与Ni(OH)2材料的接触。 微米片状的颗粒为PANI 通过EDS 图得到了证实,如图2(c)所示。图 2(d)所示为 Ni/Ni(OH)2/PANI复合膜的 EDS 图谱,N、O 和 Ni 元素均匀分布, 说明Ni/Ni(OH)2/PANI 均匀沉积在铜箔集流体表面。

图2 Ni/Ni(OH)2 的 TEM 和 SAED 像以及 PANI 和 Ni/Ni(OH)2/PANI 的 EDS 图谱Fig. 2 TEM and SAED images of Ni/Ni(OH)2 and EDS of PANI and Ni/Ni(OH)2/PANI
将Ni/Ni(OH)2/PANI 复合材料从铜箔集流体上刮下后进行红外光谱测试(FT-IR),进一步验证复合材料的组成。从图3 可以看出,复合材料在426、506、843、1 045、1 344、1 564、1 766、3 452 cm-1波段处有吸收峰。 峰值位于426、506 cm-1处分别对应于Ni-O-H和Ni-O 键的振动,进一步验证了氢氧化镍的存在[15]。此外,峰值在1 045 cm-1和1 766 cm-1处的吸收峰,归因于N-O 和C=O 的振动,表明在复合材料表面吸附了CH3COO-和 NO3-阴离子[16-17]。 而在 843、1 344、1 564、3 452 cm-1处的吸收峰是由 PANI 中的 C-H、C-N、C=C 和N-H 振动引起的, 这证明了复合材料中聚苯胺(PANI)的存在[18-20]。

图3 Ni/Ni(OH)2/PANI 红外光谱Fig. 3 FT-IR image of Ni/Ni(OH)2/PANI
为了进一步分析Ni/Ni(OH)2/PANI 复合膜的化学成分和元素价态,进行 XPS 光谱测试(图 4)。 XPS 全谱(图4(a))证实了复合膜中碳、氮、氧和镍元素的存在。 在 C 1s 光谱(图 4(b))中,结合能位于 284.4、286.2、288.1 eV 处的峰分别对应于PANI 中存在的C=C、C-N 键和吸附在复合材料表面的CH3COO-阴离子中的 C-O 键[21-22]。在图 4(c)中,N 1s 光谱被分解为 5 个峰, 其峰位置分别位于 397.8、398.8、399.7、402.9、406.5 eV 处, 对应于 PANI 中存在的-=N-、-NH-、-NH+-以及-NH2+-和复合材料表面吸附的NO3-阴离子[23-24]。 在 O 1s 光谱(图 4(d))中,结合能位于 529.8 eV 和 531.5 eV 的峰分别属于 Ni(OH)2和CH3COO-形成的 Ni-O 和 OH/CO 键。对于 Ni 2p 光谱(图 4(e)),Ni 2p3/2峰与 Ni 2p1/2峰的分离度为 17.64 eV,与 Ni(OH)2的文献数据相吻合[25]。 XPS 谱证实复合膜中存在Ni(OH)2和PANI 以及在膜表面吸附有CH3COO-和NO3-阴离子。
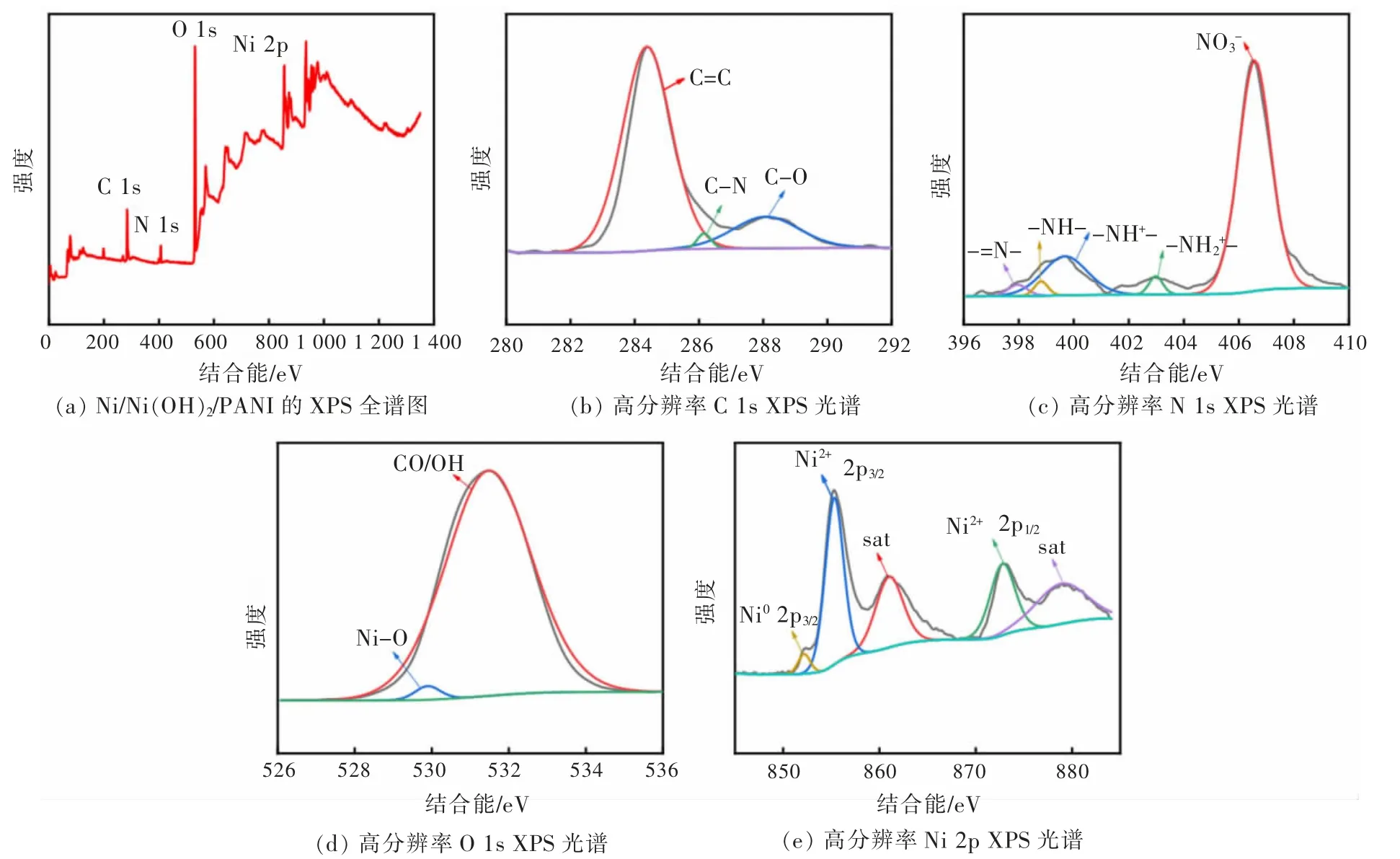
图4 Ni/Ni(OH)2/PANI 的 X 射线光电子能谱Fig. 4 XPS spectrum of Ni/Ni(OH)2/PANI
2.2 Ni/Ni(OH)2/PANI 复合膜的电化学性能
图5 所示为 Ni/Ni(OH)2/PANI 复合膜的循环伏安(CV)和恒电流充放电(GCD)曲线图。 在扫描速率为 10 mV/s 时,电沉积时间为 150 s 的 Ni/Ni(OH)2/PANI复合膜,在同一电位窗口内的电流密度最大,在1 A/g的电流密度下放电时间最长。 这与SEM 测试结果一致, 随电沉积时间的增加,PANI 在复合膜中含量增加,可以进一步增加电极比电容,但反应时间过长,会导致PANI 团聚,增加离子扩散距离,对电化学性能的发挥起到抑制作用。 因此本文采用反应时间为150 s 时形成的复合膜与原始 Ni/Ni(OH)2进行对比分析。
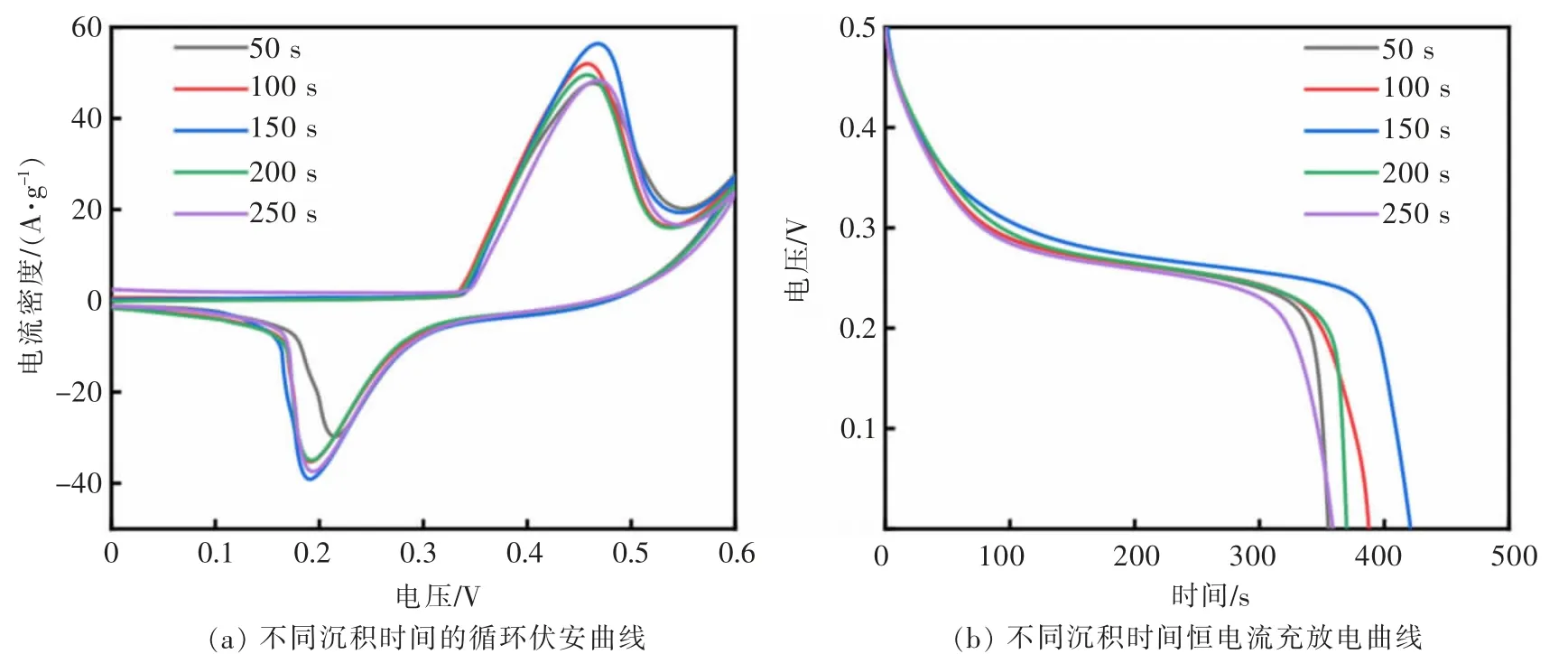
图5 不同沉积时间下CV 与GCD 曲线Fig. 5 CV and GCD curves at different deposition times
为了评价 PANI 对 Ni/Ni(OH)2复合膜性能的影响,Ni/Ni(OH)2/PANI 和 Ni/Ni(OH)2的电化学性能对比结果如图 6 所示。 在图 6(a)中,Ni/Ni(OH)2/PANI 电极在10 mV/s 扫描速率下的曲线显示出更大的环路面积,说明其具有更优越的电容,而图6(b)显示在1 A/g 电流密度下的放电曲线也有类似结果。 根据电容公式计算,Ni/Ni(OH)2/PANI 在 1 A/g 电流密度下获得了高达 1 400 F/g 的比电容, 高于 Ni/Ni(OH)2(1 295 F/g)。 这些结果表明 PANI 的引入对提升Ni/Ni(OH)2复合膜的电容性能起到积极作用,这主要是因为PANI 不仅提供容量而且可以增加Ni/Ni(OH)2电极的导电性能。
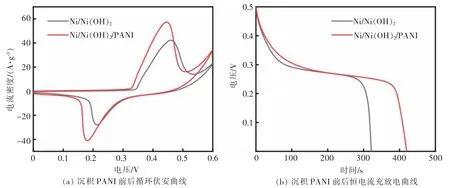
图6 沉积 PANI 前后CV 与 GCD 曲线Fig. 6 CV and GCD curves before and after PANI deposition
图7 所示为不同时间沉积PANI 的电化学阻抗谱,可阐明在 Ni/Ni(OH)2复合膜表面引入 PANI 导电聚合物对电极电化学性能的影响规律。阻抗图由高频区的半圆部分和低频区直线部分组成,分别对应于电极/电解质界面上的电荷转移阻抗(Rct)和电极内的离子扩散(W)[26-28]。 在高频区域(图 7 的插图),随着PANI 在 Ni/Ni(OH)2表面沉积,半圆直径逐渐减小,当沉积时间为150 s 时,复合膜具有最小的电荷转移阻抗(7.1 Ω),说明将导电聚合物引入 Ni(OH)2电极材料中有利于电极表面的电子转移。 但当电沉积时间到达 200 s 和 250 s 时, 电荷转移阻抗值 (分别是14.5 Ω 和 15.3 Ω)略大于 Ni/Ni(OH)2复合电极(12.5 Ω),这归因于PANI 层的堆积与团聚增加了电解液的扩散距离从而导致阻抗略微增加。 所有样品的Rs(高频区与实轴的第一个交点)值都非常接近,这是因为所有的电化学测试都是在相同的电解液中测量。在低频区域,PANI 沉积时间为150 s 时,电极表现出更垂直的线,表明其电容行为更理想。

图7 不同沉积时间下电化学阻抗对比Fig. 7 Nyquist plots at different deposition times
图8(a)所示为 Ni/Ni(OH)2/PANI 在 10~100 mV/s扫描速率下的CV 曲线。曲线出现的氧化还原峰对应于Ni(OH)2/NiOOH 的相互转换过程,氧化还原峰不对称归因于法拉第电流在高扫描速率下的电化学极化和欧姆阻抗。 随着扫描速率的增加,CV 曲线没有明显变形,电流响应发生较小位移,表明Ni/Ni(OH)2/PANI 复合膜具有优异的倍率性能。 图8(b)所示为Ni/Ni(OH)2/PANI 在 1~10 A/g 不同电流密度下的恒电流充放电曲线。 从图 8(b)可以看出,在 0.3~0.5 V的过程中,电位变化快,这主要是由于电极之间发生了OH-离子或其他电荷的物理吸附—解吸;与标准赝电容放电曲线类似,当电位低于0.3 V 时,时间与电位之间存在非线性关系, 表明电极界面发生氧化还原反应,形成法拉第电容。 根据恒电流充放电曲线计算的比电容如图 8(c)所示,Ni/Ni(OH)2在电流密度 1 A/g和 10 A/g 下,比电容分别为 1 295 F/g 和 690 F/g, 而Ni/Ni(OH)2/PANI 的比电容分别为 1 400、878 F/g,其容量保持率分别为53.2%和62.7%。通过图8(d)还可以看出,Ni/Ni(OH)2/PANI 还表现出优异的循环稳定性,在电流密度为10 A/g 的条件下连续循环2 000 次后,其电容保持率达到 76%, 优于 Ni/Ni(OH)2电极(68%)。 PANI 引入后的复合电极倍率和电化学性能均有所提高,这说明 PANI 覆盖于Ni/Ni(OH)2电极表面不但有利于电极表面的电荷转移,还对Ni(OH)2起到保护作用,提高材料电化学循环过程中的结构稳定性。

图8 Ni/Ni(OH)2/PANI 的电化学性能曲线Fig. 8 Electrochemical properties of Ni/Ni(OH)2/PANI
图9 所示为 10 A/g 电流密度下,Ni/Ni(OH)2和 Ni/Ni(OH)2/PANI 在 500 次和 2 000 次循环后的SEM 像。 显然,随着循环次数的增加,Ni/Ni(OH)2电极的多孔结构开始变形甚至脱落,表明它们之间的弱相互作用。 但在 PANI 引入后,Ni/Ni(OH)2在2 000 次循环后并未脱落还保持着良好的多孔结构。 其主要原因是PANI 纳米层在电循环过程中可以起到缓冲区域的作用, 用于保留和传送电子;同时加强Ni/Ni(OH)2与基材之间的相互作用,防止Ni/Ni(OH)2在长循环后的脱落,从而表现出更长的循环寿命。
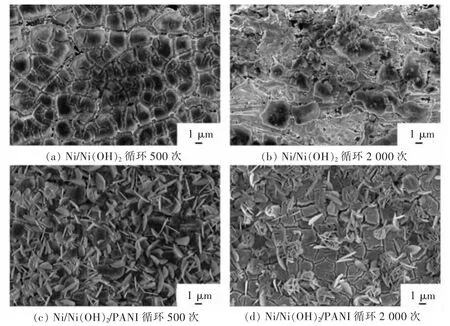
图9 Ni/Ni(OH)2 和 Ni/Ni(OH)2/PANI 循环后的 SEM 像Fig. 9 SEM images of Ni/Ni(OH)2 and Ni/Ni(OH)2/PANI after cycling
3 结 论
1) 采用简便省时的电沉积方法成功制备了Ni/Ni(OH)2/PANI 复合材料,PANI 薄片在复合材料中起着关键的作用。一方面,PANI 作为赝电容材料可以提高材料的比容量, 另一方面,PANI 层加强Ni(OH)2与基材之间的相互作用从而防止 Ni(OH)2在长时间循环后的脱落。这说明PANI 的引入对改善Ni/Ni(OH)2电极的电化学性能起积极作用。
2) PANI 引入后,Ni/Ni (OH)2/PANI 显示了更出色的比电容、倍率性能以及循环性能。 Ni/Ni(OH)2/PANI在 1 A/g 电流密度下提供 1 400 F/g 的比电容; 在1~10 A/g 电流密度下电容保持率为62.7%;在10 A/g 电流密度下2 000 次循环后的电容保持率为76%。
