铝离子电池电解质研究进展
2023-05-08陈诺郭轲郭玉玺王伟焦树强
陈诺 , 郭轲 , 郭玉玺 , 王伟 , 焦树强 *
(1. 北京理工大学先进结构技术研究院,北京 100081; 2. 北京科技大学钢铁冶金新技术国家重点实验室,北京 100083)
0 引 言
在过去的几十年中, 锂离子电池因其能量密度高、循环寿命长、无记忆效应、工作温度范围大等优点,在商业市场上占据了主导地位,广泛应用于手机、笔记本电脑等便携式电子设备领域[1-5]和电动汽车[6]等领域。然而,有限的锂资源,易燃的电解质和锂枝晶产生的安全隐患[7],以及生产过程中繁琐的电解液填充、润湿和成型过程[8],阻碍了锂离子电池的进一步发展[9]。 因此,开发高效安全、资源丰富、价格低廉的新型储能系统迫在眉睫。
铝离子电池因金属铝资源丰富及其电池体系的高安全性而被认为是下一代后锂技术的有力候选者[10-11]。 铝离子电池的优势不仅在于丰富的金属铝资源和较低的生产成本,还在于其良好的物理化学性质。 在物理性质方面,金属铝具有良好的延展性和空气稳定性使其安全易处理;而在化学性质方面,铝的质量比容量为2.98 Ah/g,仅次于锂(3.86 Ah/g),但体积比容量为 8.06 Ah/cm3,远高于锂(2.06 Ah/cm3),在所有金属元素中排行第一[12-13]。 此外,由于电解质体系不易燃,铝离子电池作为锂离子电池可能的替代品之一,具有良好的发展和应用前景。
与广泛研究的正极材料相比,目前对于铝离子电池电解质的研究相对较少。 然而,电解质作为铝离子电池的重要组成部分,其性能参数极大地影响着电池的整体性能。铝离子电池电解质可分为水系电解质和非水系电解质,水系电解质通常由强酸性铝盐水溶液组成,而非水系电解质则分为几大类,包括离子液体、无机熔盐和凝胶聚合物电解质。 近年来,有关铝离子电池电解质的研究报道逐年增加,本文系统地总结了不同电解质体系的研究进展、 优缺点及其改性策略,旨在为开发先进高效的铝离子电池电解质提供理论指导。
1 水系电解质
在离子液体出现之前,水系电解质是铝离子电池最常用的电解质体系, 在实际应用中具有独特的优势。首先,水系电解质通常使用廉价易得的铝盐制备,原料成本低,且可在空气环境下制备,大大降低了生产成本[14-16]。 其次,水系电解质离子电导率高,有助于提高电池功率密度[17]。此外,水系电解质无毒无污染,电池热效应释放稳定,安全性高,电池器件后处理简单,符合可持续发展的要求[18]。
水系铝离子电池的电解质通常以强酸性的单一铝盐水溶液为主, 这是因为铝在水溶液中的存在形式受溶液 pH 值影响,当 pH<2.6 时,Al3+才能稳定存在[19],目前常见的无机铝盐有 AlCl3、Al2(SO4)3、Al(NO3)3等。为了增强水系电解质中铝的可逆沉积溶解,WU 等[20]提出了一种以铝箔为负极,AlxMnO2/nH2O 为正极,超高浓度Al(OTF)3水溶液为电解液的新型水系铝离子电池。如图1(a)所示,该电池首圈放电容量为467 mAh/g,50 次循环后仍保有255 mAh/g 的容量, 容量始终高于使用离子液体(AlCl3/[BMIM]Cl)作为电解质的铝离子电池, 表明了这种水系电解质具有一定的优越性。 Al/Al(OTF)3-H2O/AlxMnO2·H2O 电池的储能机理在于Al3+在AlxMnO2/nH2O 正极材料中的嵌入及脱嵌,反应方程式如下:
此外, 为了有效阻止铝负极的析氢和腐蚀现象,LI 等[21]通过在AlCl3水溶液加入LiTFSI 制备混合电解质, 使得电池获得了优异的倍率和循环稳定性能。如图 1(b)—图 1(c)所示,随着电解液中 LiTFSI 的浓度增加, 析氢反应的活性逐渐降低,Al 界面的腐蚀电流逐渐减小,腐蚀电位升高,表明LiTFSI 的加入可有效抑制电极的析氢反应以及有效减弱铝界面的腐蚀。 在AlCl3、Al2(SO4)3、Al(NO3)3、Al(OTF)3、AlCl3@LiTFSI 水溶液中使用 Al 对称电池对比了Al 沉积/溶解过电位,如图 1(d)所示,可以看出前20 h 在AlCl3@LiTFSI 水溶液的过电位远小于其他电解液。 如图 1(e)—图 1(f)所示,电池在 1 A/g 的电流密度下,放电容量为223 mAh/g,电流密度提升到6 A/g 后,放电容量仍保持在50%以上,进行300 次充放电循环后,电池容量仍保有首圈的64.6%。 由于体系中存在多种金属阳离子,Al/AlCl3-LiTFSI/KVO电池的储能机理也较为复杂, 除了Al3+和Li+在正极材料中的嵌入与脱嵌以外, 还伴随着其他反应的发生,反应机理如下:
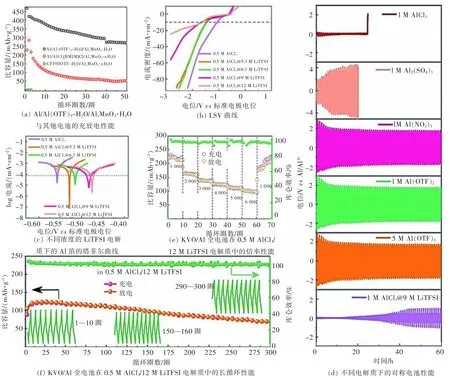
图1 Al/Al(OTF)3-H2O/AlxMnO2·H2O 电池[20]与 Al/AlCl3-LiTFSI/KVO 电池[21]Fig. 1 Al/Al(OTF)3-H2O/AlxMnO2·H2O battery[20] and Al/AlCl3-LiTFSI/KVO battery[21]
为了证明不同成分电解液对铝离子嵌入/脱嵌行为的影响, LAHAN 等[22]分别以 0.5 mol/L Al2(SO4)3、1 mol/L Al(NO3)3和 1 mol/L AlCl3为电解质,MoO3为正极材料组装电池。 如图 2(a)—图 2 (d)所示,以1 mol/L AlCl3为电解液时,MoO3电极材料的储铝容量更高、电池整体循环更稳定、界面极化更小。为了拓宽电池的电化学窗口, 减少正极材料的溶解,ZHOU 等[23]采用有机盐Al(OTF)3作为电解质,类普鲁士蓝为正极材料组装了电池。 图2(e)展示了不同电解质循环前和循环后的光学图片。 如图 2(f)—图 2(g),5 mol/L Al(OTF)3(Al-WISE)显示出可达 2.65 V 的电化学窗口, 同时在25 ℃下表现出约26 mS/cm 的高离子电导率以及 17.7 mPa·s 的黏度。 其溶剂化结构如图2(h),由于可利用的水分子减少,Al3+、H2O 以及 (CF3SO3)-形成松散离子对和模仿离子对,这些离子对有利于拓宽电解液的电化学窗口,进而有效提升电池的能量密度。 如图 2(i)所示,当使用 Al-WISE 作为电解质时,该电池具有116 mAh/g 的放电容量和100 次以上的循环稳定性,每个循环的容量衰减为0.39%。
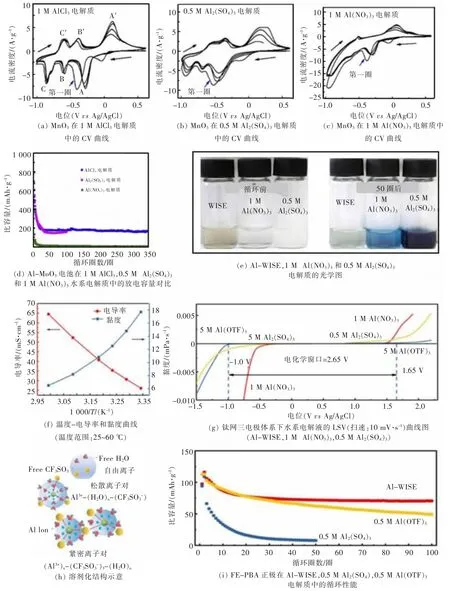
图2 Al-MoO3 电池[22]与 Al-FeFe(CN)6 电池[23]Fig. 2 Al-MoO3 battery[22] and Al-FeFe(CN)6[23]
虽然水系电解质具有成本低、电导率高、环境友好等优点,但是铝离子电池在水系系统中仍有许多缺点,比如:①表面氧化钝化膜的形成会阻隔铝负极与电解液的接触,降低电池电压和反应效率;②铝的标准电极电位较低, 在铝析出之前会先发生析氢副反应;③水系电解液的电化学窗口窄,限制了工作电压;④充放电过程中发生的析氢/析氧反应, 影响电池的循环稳定性,在密闭电池内部产生气体,容易引发安全问题。这些缺点的存在阻碍了铝离子电池水系系统的大规模应用。
2 非水系电解质
2.1 离子液体
铝离子电池离子液体电解质通常由M+X-(如吡咯烷盐或咪唑盐等)与AlCl3混合而成,其中M+表示有机阳离子,X-表示卤素阴离子(如 Cl-、Br-或 I-)。
离子液体的优点有:①对有机物、无机物电极材料的适配性强;②蒸气压低,不易挥发;③离子液体的活性易调配,即调整组成原料的比例,可以改变离子液体的溶解度等物化性质,从而定向设计符合需求的离子液体体系;④与水系电解质体系相比,离子液体具有较宽的电化学窗口;⑤离子液体的导电性、热稳定性和抗氧化性较好。
铝的沉积溶解特性是铝离子电池可逆性的首要前提,为了实现铝的可逆沉积和溶解[24]并消除铝表面的钝化膜, 室温离子液体于1984 年首次被成功运用于铝的电化学实验中, 这一实验为铝二次电池的研究奠定了基础。 2011 年, 美国康奈尔大学的JAYAPRAKASH 教授课题组[25]研发了一种以纳米线型V2O5为正极,AlCl3/ [EMIm]Cl 离子液体为电解质,金属铝为负极的新型铝离子电池。 图3(a)是电池的电压-时间曲线, 在10 次充放电循环中,Al3+嵌入与脱嵌的平台电位未发生变化,显示了电池反应良好的可逆性。 图3(b)是电池的电压-容量曲线,在0.55 V处可以观察到一个稳定的放电平台, 反映了Al3+的嵌入过程。 图 3(c)显示了电池在125 mA/g 的电流密度下20 次充放电的循环性能, 首圈放电容量为305 mAh/g,20 次循环后,容量降低至 273 mAh/g。
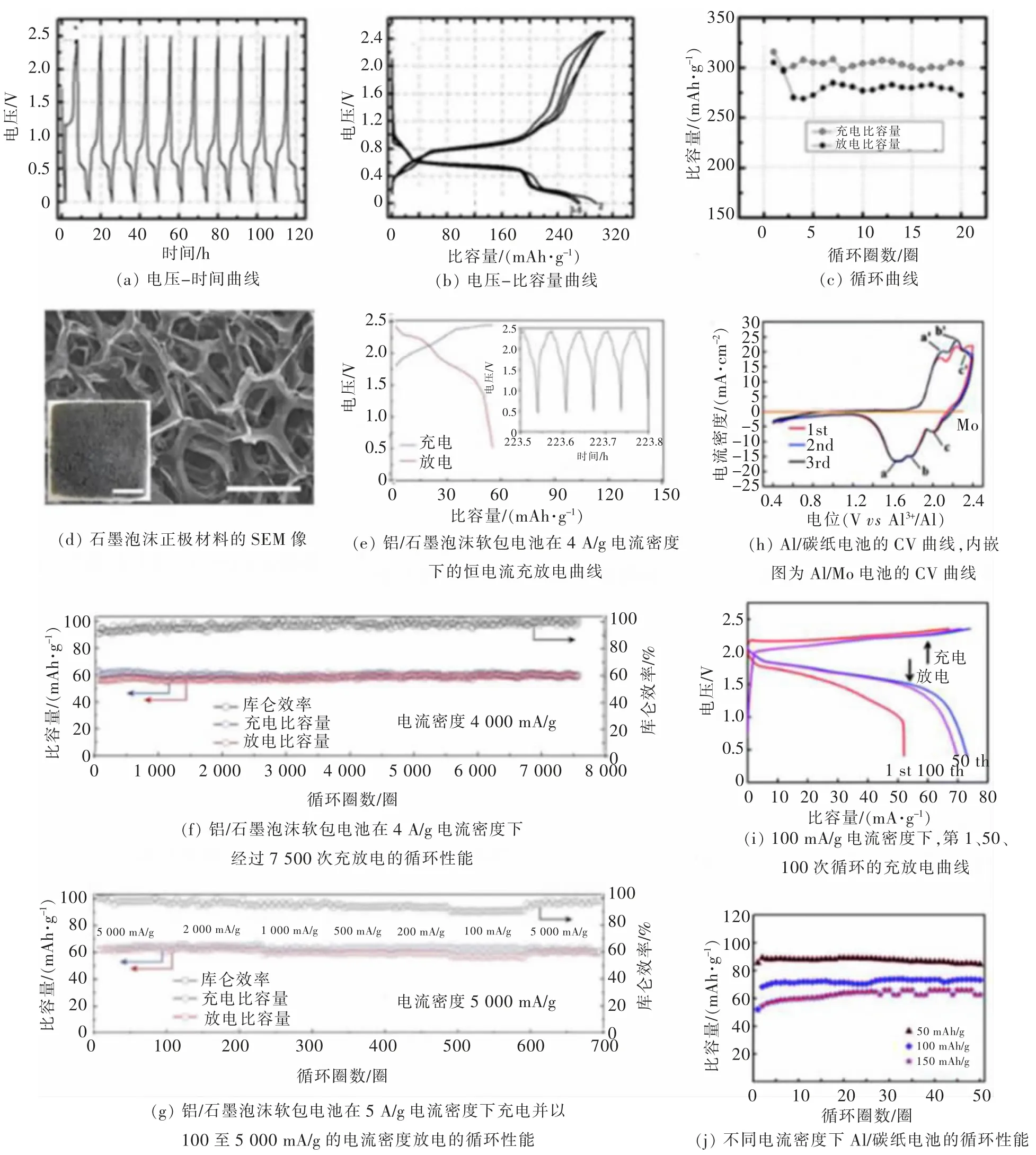
图3 Al-V2O5 电池[25]、Al-石墨电池[26]与 Al-碳纸电池[27]Fig. 3 Al-V2O5 battery[25]、Al-Graphite battery[26]and Al-Carbon Paper battery[27]
2015 年,LIN 课题组[26]以 AlCl3/ [EMIm]Cl 离 子液体为电解质,石墨及CVD 石墨烯为正极材料,铝为负极,组装成铝离子电池,实现了超长循环和超快充电铝离子电池,成为铝离子电池领域的一大突破。 该电池正极材料的SEM 图像如图3(d)所示,通过将石墨在泡沫镍板上沉积得到具有大孔洞六元环的层间材料,这大大缩短了氯铝酸盐离子的扩散距离,加快了电池反应的速率。 如图 3(e),该电池在 4 A/g 的大电流密度下,仍有接近60 mAh/g 的放电容量,内嵌图证明电池一次循环时间小于1 min, 实现了快速充放电。 图 3(f)为电池在 4 A/g 的电流密度下进行 7 500 次充放电的循环性能,放电容量为66 mAh/g,库仑效率为97%±2.3%,接近 100%,且容量几乎无衰减。 图 3(g)为100~5 000 mA/g 电流密度下的倍率性能,电池容量约为60 mAh/g, 该电池实现了在 34 min 内的快速充放电。 充放电过程中铝-石墨电池的储能机理在于AlCl4-在石墨及CVD 石墨烯中的嵌入和脱嵌, 反应方程式如下:
此外,北京科技大学的SUN 课题组[27]报道了以碳纸为正极材料、AlCl3/[EMIm]Cl 离子液体为电解质的铝离子电池。如图3(h)所示,在铝离子电池前3 个CV 循环曲线中,首圈形状与其他曲线不同,这被认为是由于石墨在第一次循环过程中进行了体积调整和电极表面一些副反应的发生,使得石墨层间结构更适合于氯铝酸盐离子的嵌入与脱出。第二圈与第三圈曲线形状一致, 说明该电池具有良好的电化学可逆性。 电池在 1.65、1.77、2.0 V 处观察到 3 个还原峰,在2.10、2.24、2.34 V 观察到对应的 3 个氧化峰。 图 3(h)内嵌图是以钼电极作为工作电极获得的CV 曲线,在1.73、1.85 V 出现一对氧化还原峰, 与铝电池的峰位基本一致,但石墨的电流密度远高于钼,因此可以忽略钼作为集流体在电池循环中的影响。电池在100 mA/g的电流密度下,第1 次、第50 次、第100 次的充放电曲线如图3(i)所示,曲线形状一致,证明了反应高度可逆,在第100 次循环时仍保有69.92 mAh/g 的放电容量,说明了电池具有良好的容量性能。 图3(j)显示了电池在不同电流密度下进行50 次充放电的循环性能, 在50 mA/g 的电流密度下, 放电容量为84.55 mAh/g, 电流密度提高到150 mA/g, 放电容量仍有62.71 mAh/g。 该电池在0.05 A/g 的电流密度下首圈容量可达90 mAh/g, 但在电流密度提升至0.1、0.15 A/g 后,电池容量逐渐衰减。 该电池通过插层反应机理,实现铝离子在碳纸中的嵌入和脱嵌。
除了1-乙基-3-甲基氯化咪唑鎓 ([EMIM]Cl)以外,1-丁基-3-乙基氯化咪唑鎓 ([BMIM]Cl)、N-丁基吡啶氯化物 ([BuPy]Cl)、 尿素 (Urea) 等都可以和AlCl3按一定比例混合成离子液体或离子液体类似物。 为了降低以咪唑为原料的离子液体的成本,XU等[28]报道了一种以廉价的Et3NHCl 为基体的阳离子活性种的室温离子液体(AlCl3/Et3NHCl),其放电过程的电池示意图如图4(a)所示。通过调节AlCl3的比例实现室温电解液中AlCl4-和Al2Cl7-的配比变化,通过拉曼光谱和27Al 的核磁谱揭示了2 种氯酸盐阴离子的比例变化(如图 4(b)和图 4(c)所示)。 通过装配成铝石墨电池进行电化学测试以研究电解液在实际工况中的反应活性。研究者选择 n(AlCl3)∶n(Et3NHCl)=1.5∶1的离子液体以1 mV/s 扫速进行循环伏安法测定,稳定的氧化还原峰表明电池循环的高度可逆性(图 4(d))。 同时电池的充放电曲线平台也与 CV 曲线的峰值相对应,展现了铝氯酸阴离子在嵌入和脱嵌过程中优异的动力学行为(图 4(e))。 此外,该种离子液体也展现了优异的长循环能力,在5 A/g 的大电流密度下,可以实现30 000 圈的快速循环并且容量保持在 112 mAh/g(图 4(f))。 总之,相较于[EMIM]Cl,Et3NHCl 这种基体材料具有较低的成本, 同时电化学性能也具有一定的优异性,Et3NHCl 的有效利用对于降低铝离子电池电解质的成本具有巨大的意义。ZHU 等[29]采用 N-丙基-N-甲基吡咯烷氯盐(Py13Cl)进行离子液体的配制,通过拉曼光谱(图 4(g)—图 4(j))详细比较了Py13Cl 和 [EMIM]Cl 在不同氯化铝添加比例下,铝氯酸根含量的变化行为,伴随着氯化铝浓度的提升, 以Py13Cl 为有机阳离子的离子液体中的铝氯酸根和以[EMIM]Cl 为有机阳离子的测试强度接近。 选择配制离子液体的有机阳离子时,需要考虑多种因素,包括离子液体黏度系数、电导率等,这些因素通常与有机阳离子的尺寸有关,有机阳离子的尺寸越大,离子液体的流动性越差,往往伴随着动力学性能的降低。

图4 以AlCl3/Et3NHCl 为电解质的铝石墨烯电池[28]与AlCl3/Py13Cl 和AlCl3/[EMIM]Cl 电解质的拉曼对比[29]Fig. 4 Aluminum-graphene battery using AlCl3/Et3NHCl as electrolyte[28] and Raman spectra of AlCl3/Py13Cl and AlCl0/[EMIM]Cl electrolyte[29]
同样, 使用尿素和AlCl3配制离子液体类似物,成本仅为AlCl3/[EMIM]Cl 的 1/50, 而且更加环保。ANGELL 等[30]以AlCl3/尿素离子液体为电解质组装了铝离子电池,其装置示意图如图5(a)所示,尿素电解质相对于[EMIM]Cl 而言,成本较低,对于实现低成本离子液体体系电池具有潜在的意义。 如图5(b)所示,AlCl3和尿素的拉曼光谱图, 同样当 AlCl3和UREA 摩 尔 比 为 1 ∶1 时 , 离 子 液 体 中 未 检 测 到Al2Cl7-,然而只有Al2Cl7-才能实现铝的可逆沉积溶解进而满足二次电池的要求, 因此需要逐步增加AlCl3的比例直到离子液体中呈现合理的AlCl4-和Al2Cl7-的配比,达到较好的电池性能。 图5(c)展示了该电解质在不同电流密度下的充放电平台,可以看出尿素电解质具有优秀的动力学效应, 随着电流密度的增加,依然可以保证良好的电化学平台。 同时,无论是倍率性能还是循环性能,以尿素为核心的电解质都可以保持稳定的状态,如图5(d)所示。 此外,为了进一步提高AlCl3和尿素电解质的流动性和电化学反应活性,LI 等[31]将 AlCl3/[EMIM]Cl/尿素 3 种物质进行比例调控, 制备出一种三元体系的离子液体电解质,由于[EMIM]Cl 的少量添加而引起共轭效应,如图5(e)所示, 电子均匀分布在整个咪唑环周围, 降低了EMIm+阳离子与周围阴离子之间的库仑相互作用。电解质的离子解离度增加,使得含有[EMIm]Cl 的电解质表现出更高的离子电导率。 同时,如图5(f)所示,伴随着[EMIm]Cl 的加入,电池容量得到了进一步提升。 离子液体的选择并不能单单考虑成本问题,核心的问题包括黏度、离子电导率、电化学窗口等都必须考虑。 总之,对于电解质,成本、动力学性能和电化学性能三者相辅相成,探寻较好的适配比最为重要。
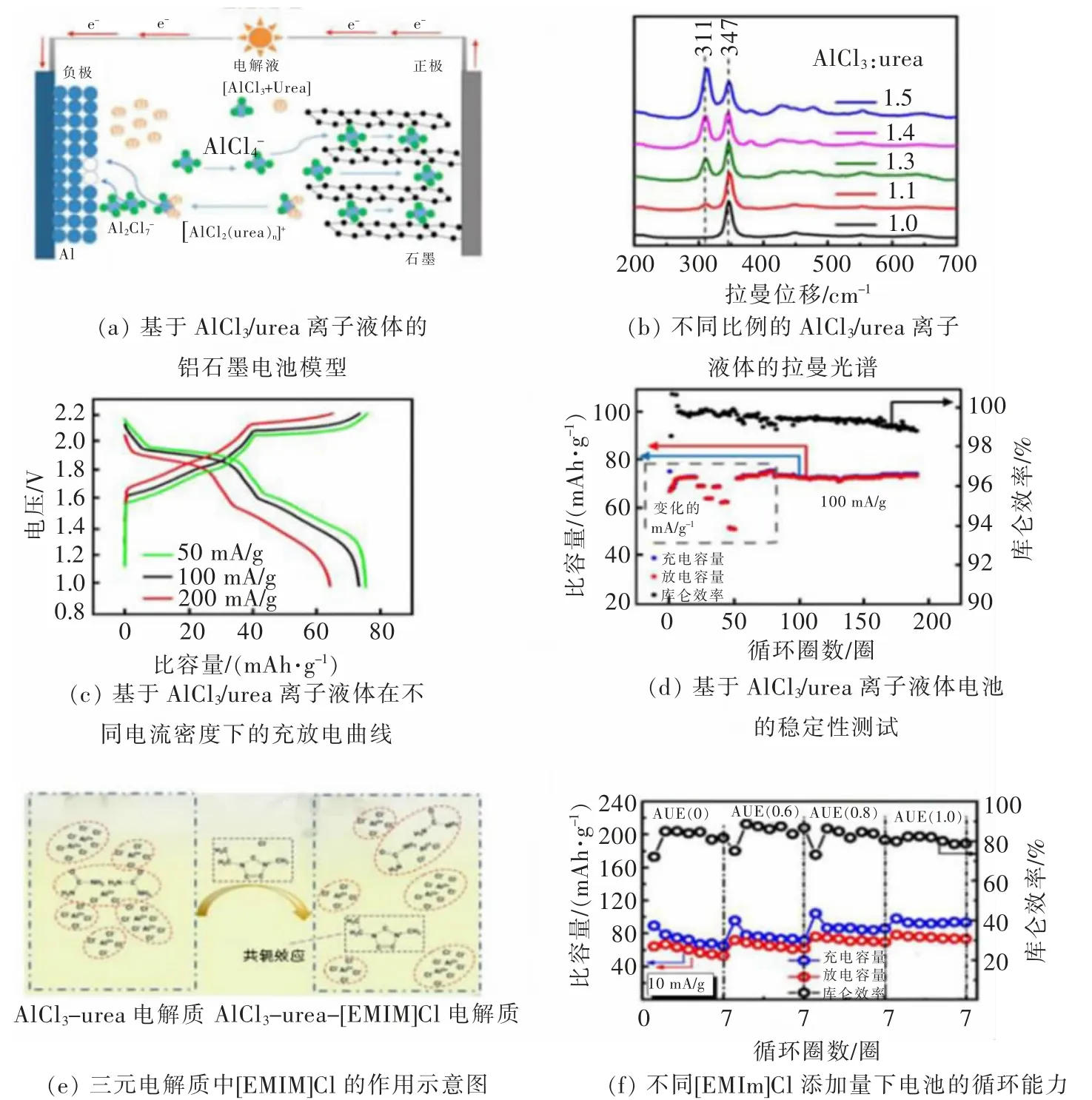
图5 以AlCl3/尿素为电解质的铝石墨电池[30]与以AlCl3/[EMIM]Cl/尿素为电解质的铝离子电池[31]Fig. 5 Aluminum-graphite battery using AlCl3/urea as electrolyte[30]and aluminum-ion battery using AlCl3/[EMIM]Cl/urea as electrolyte[31]
离子液体作为铝离子电池的电解质,具有几个明显的缺点,例如咪唑氯化物[EMIM]Cl 的价格昂贵,导致电池的成本高; 铝负极表面腐蚀及铝枝晶的形成,影响了电池的循环稳定性;正极材料溶解于离子液体电解质中,导致电池容量损失。 这些问题限制了离子液体基铝离子电池的进一步发展,无法实现商业化。
2.2 无机熔盐
基于AlCl3和氯化咪唑鎓盐的离子液体价格昂贵、腐蚀性强、空气稳定性差,而水系电解质存在电化学窗口窄、析氢副反应和铝负极钝化等问题,阻碍了铝离子电池在储能领域的大规模应用。 而无机熔盐的主要原料为无机金属氯化物,成本低、安全性高、稳定性好,能够实现可逆铝沉积和溶解,作为电解质,拥有高容量和高库仑效率以及较好的循环稳定性,性能甚至优于部分离子液体,是铝离子电池电解质的有力候选者。
无机熔盐作为铝离子电池电解质的研究最早可以追溯到20 世纪80 年代,KOURA[32]用熔融的AlCl3和NaCl 作为电解质, 开发了Al/AlCl3-NaCl/FeS2电池, 该电池在180~300 ℃范围内存在2 个明显的放电平台(0.6、0.9 V)。 近年,SONG 等[33]提出了一种以AlCl3和 NaCl(摩尔比为 1.63∶1)熔融盐为电解质的铝石墨电池,通过油浴加热将温度控制在120 ℃测试电化学性能,装置如图 6(a)所示。 如图 6(b),3 个放电平台出现在 1.95~1.8 V、1.6~1.5 V 和 1.2~1.0 V 范围内。 如图 6(c),在 500 mA/g 的电流密度下,电池容量先增大后减少,然后逐渐稳定在115 mAh/g,平均库仑效率为97.1%±2.4%。 前5 次循环中电池容量的增加,归功于石墨的层间结构和氯铝酸盐离子在石墨层间的嵌入与脱嵌。 图6(d)显示了电池在不同电流密度下良好的倍率性能, 即使在3 A/g 的电流密度下,电池容量仍有85.5 mAh/g,库仑效率接近100%。同时,对于石墨层间结构的利用,不同电流密度需要不同的充放电循环次数, 以达到电池性能的稳定。当电流密度增大(相对于500 mA/g)时,电池进行一个充放电循环的时间减少,因此需要进行更多的循环。 图6(e)显示了在4 A/g 电流密度下,电池的长循环性能,在9 000 次循环中,库仑效率为97.7%±2.2%,电池容量为64.9 mAh/g,相对于首圈,容量保持率超过66.4%。 当电流密度降低至1/2 后, 电池容量恢复至75.5 mAh/g,平均库仑效率为98.9%±1.0%。 铝-石墨熔盐电池的储能机理与离子液体中类似,主要在于AlCl4-和Al2Cl7-在石墨中的嵌入及脱嵌, 反应方程式如下:
与水系电解质和离子液体不同,无机熔盐电解质对电池所处环境温度有一定要求,这就增加了电池的运行成本。通过在二元熔盐中加入其他盐形成共晶熔体, 可以进一步降低熔点, 从而降低成本。 典型的AlCl3/NaCl 和 AlCl3/KCl 体系熔化温度分别高于108℃和 128 ℃, 但将 3 种盐混合后,AlCl3/NaCl/KCl体系的熔化温度降到100 ℃以下[34]。 TU 等[35]配制了不同体系的共晶熔盐, 包括 AlCl3/LiCl/KCl、AlCl3/NaCl/KCl、AlCl3/NaCl/LiCl 和 AlCl3/NaCl/LiCl/KCl,通过FactSage 软件计算, 熔点分别为 94.09、91.44、81.98、74.91 ℃。 如图 7(a)所示,AlCl3/NaCl/LiCl/KCl熔盐在不同温度下的离子电导率明显高于其他熔盐,意味着它更有利于传输铝络合阴离子。 图7(b)是在0.5~2.3 V 范围内以2 mV/s 的速度扫描得到的4 种铝石墨电池的CV 曲线,以4 种不同熔盐体系为电解质的电池具有相似的氧化还原反应, 但AlCl3/NaCl/LiCl/KCl 熔盐的峰位更显著,峰值更大,意味着它的电化学反应更为充分及高效。图7(c)—图7(f)显示了100 ℃、200 mA/g 的电流密度下电池的循环稳定性,4 种电池的首圈放电容量分别为 114.1、100.8、13 1.0、146.4 mAh/g, 库仑效率分别为 90.6%、91.1%、85.8%、82.8%。 AlCl3/NaCl/LiCl/KCl 四元体系的极化电位较低,电解质稳定性较差,库仑效率最低,但是它拥有最高的电池容量。 图7(g)是以AlCl3/NaCl/LiCl/KCl 四元体系为电解质的铝石墨电池在90 ℃、200 mA/g 的电流密度下的长循环性能图,由于循环过程中氯铝酸盐离子在石墨层间的嵌入/脱嵌行为,稳定和改善了铝离子的扩散动力学,使得电池容量在1 500 次循环过程中逐渐增加。 电池首圈放电容量为83.4 mAh/g,库仑效率为 86.3%,而在 1 500 次循环时, 放电容量为 114.9 mAh/g, 库仑效率为91.3%, 说明该电池拥有良好的长循环稳定性。 同时,如图7(h),该电池展现出了优秀的倍率性能,进一步表明该熔盐电池稳定性能。

图7 以4 种不同熔盐为电解质的铝石墨电池[35]Fig. 7 Aluminum-graphite batteries using four different molten salts as electrolyte[35]
无机熔盐电解液具有成本低,安全性高,稳定性好等优势。 但是熔盐熔点非常高,这些熔盐铝离子电池大都需在大于100 ℃的温度下运行,这对外部热源要求较高,只适合于特殊环境的储能装置,这限制了其实际应用。
2.3 凝胶聚合物电解质
无论是水系电解质,还是离子液体或无机熔盐,各有缺点,水系电解质中析氢反应、铝负极钝化问题难以解决,离子液体价格昂贵、湿度敏感,无机熔盐工作温度高。 因此, 将水系电解质或离子液体与固态基质混合,进行一定程度的聚合,形成凝胶聚合物电解质,降低电解质的湿度敏感性和腐蚀性。与液体电解液相比,凝胶聚合物电解质展现出较好的柔性以及不漏液的优点,在柔性可穿戴设备应用方面表现出优势。
WANG 等[36]将一定量的聚乙烯醇(PVA)粉末加入 Al(NO3)3溶液中,制备了 PVA-Al(NO3)3水系凝胶聚合物电解质,但该电解质的离子电导率较低。 为了提高凝胶电解质的离子电导率,该课题组随后又开发了明胶-聚丙烯酰胺-Al(NO3)3水凝胶电解质[37],其合成方案如图8(a)所示。 该电解质表现出20 mS/cm 的高离子电导率和约 100 μm 的超薄厚度 (图 8(b))。高电流密度下电池的高容量问题一直备受关注,如图 8(c)—图 8(d)所示,在电流密度为 1 A/g 时,电池的放电比容量为73 mAh/g。 当电流密度增加到6 A/g 时,全电池仍可以提供35 mAh/g 的特定放电容量。此外,在1 A/g 的电流密度下,即使在2 800 个循环后,电池容量仍保留首圈的86.2%,库仑效率接近100%。

图8 以明胶-聚丙烯酰胺-Al(NO3)3 水凝胶为电解质的铝离子电池[37]Fig. 8 Aluminum ion battery using gelatin-polyacrylamide-Al(NO3)3 hydrogel as electrolyte[37]
为了弥补水系凝胶电解质电化学窗口窄的缺点,SUN 等[38]将丙烯酰胺与 AlCl3络合,再混合 AlCl3/1-乙基-3-甲基咪唑氯鎓([EMIM]Cl)离子液体(摩尔比为1.5∶1), 制备了离子液体系凝胶聚合物电解质, 实现了铝的可逆沉积/溶解。 随后,YU 等[39]以AlCl3/[EMIM]Cl 离子液体( 摩尔比为 1.5∶1)、无水氯化铝、二氯甲烷,丙烯酰胺(PAM)为络合剂、偶氮二异丁腈为引发剂, 制备柔性自支撑凝胶聚合物电解质,合成示意图如图9(a)所示。 这类电解质能很好地适应机械弯曲时带来的电极—电解质界面压力,还能有效抑制充放电过程中气体的产生,即使在火烧的情况下,该电池仍能正常运行。图9(b)是该电池在0.1~2.7 V 电压范围内以1 mV/s 的扫速得到的CV 曲线,氧化峰出现在 1.88、2.37 V,还原峰出现在 1.65、2.15 V,分别对应氯铝酸盐离子的嵌入和脱出。5 次扫描得到的曲线几乎一样,说明电池运行稳定性好。 从图9(c)电池的充放电曲线上看, 电池在1.95、2.35 V 出现2 个充电平台,在2.66、2.15 V 处出现 2 个放电平台,很好地对应了CV 曲线上氧化还原峰的位置,重叠的充放电曲线显示了电池良好的可逆性。 图9(d)显示了电池在不同电流密度下良好的倍率性能, 在100、150、200、250、300 mA/g 的电流密度下, 电池容量分别为103、94、92、90、84 mAh/g,随着电流密度逐渐增大,电池的库仑效率也得到提升, 当电流密度为300 mA/g时,库仑效率提升到98%。 同时,电池在低电流密度下也表现了良好的充放电性能,如图9(e)所示,当电流密度为20 mA/g 时,电池容量高达158 mAh/g。 随后, 在25 ℃、60 mA/g 的电流密度下测试了电池的长循环性能,如图 9(f)所示,100 次循环中,电池容量均大于100 mAh/g, 库仑效率超过90%, 显示了优越的循环稳定性。 第100 次循环时,电池容量为109 mAh/g,容量保持率高达88.6%,此时库仑效率为93%。 此外,如图 9(g)所示,在火烧下,电池仍能正常点亮小灯泡,表明该电解质有较好的热稳定性。 随后,为拓宽电解质的电化学窗口, 又开发了PAM/AlCl3/Et3NHCl 凝胶聚合物电解质[40], 电化学窗口大幅拓宽,可达 0~2.9 V。 此外,组装的 Al|IL-GPE|C 柔性电池在1 000 mA/g 的电流密度下,800 个循环后仍保持 90 mA·h/g 的容量。 LIU 等[41-42]相继开发了聚酰胺(PA)/AlCl3/[EMIM]Cl 和 PA/AlCl3/Et3NHC 2 种凝胶聚合物电解质, 组装Al/石墨电池, 前者实现了电池在-10~45 ℃的宽温域使用,后者降低了电池成本。
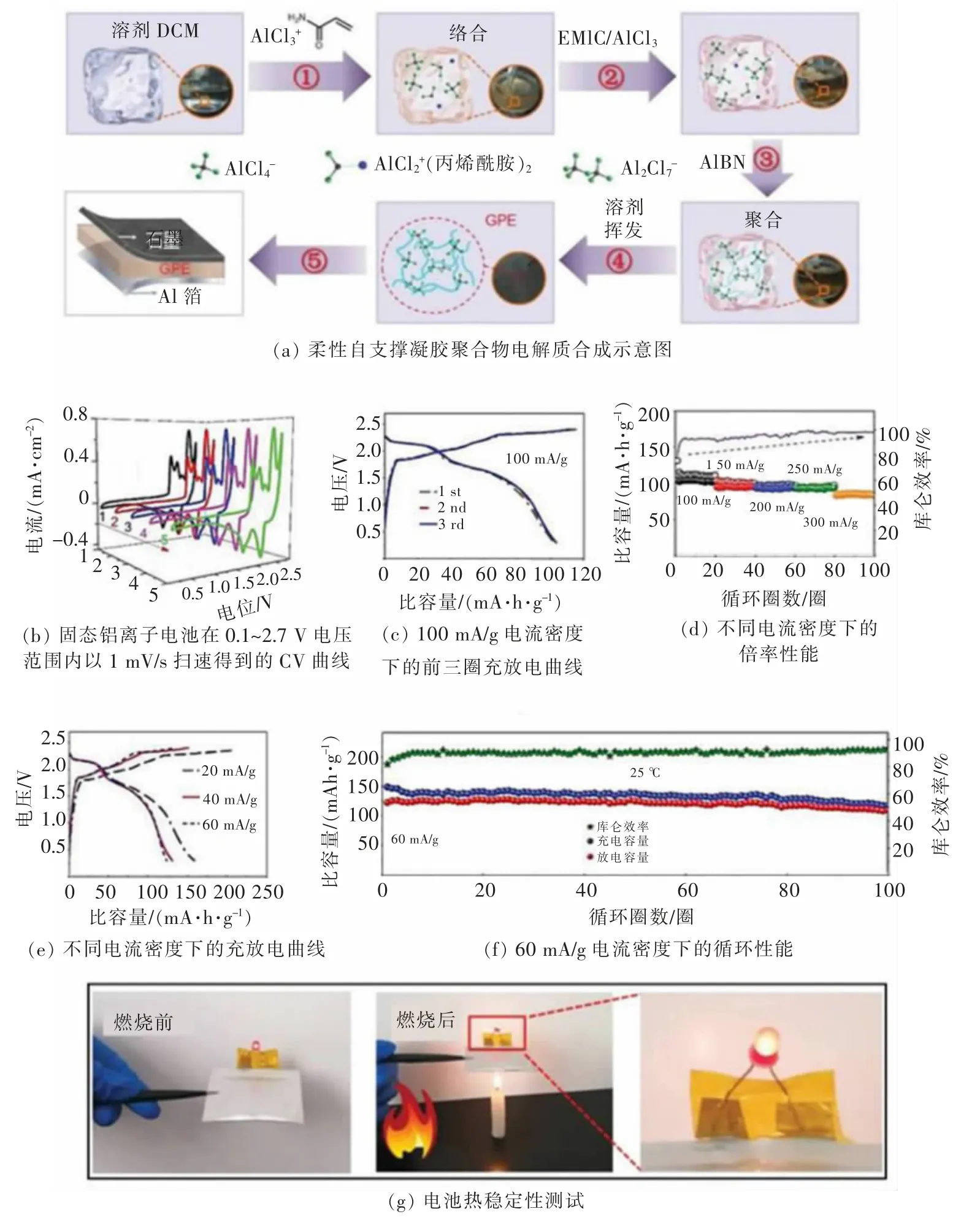
图9 一种以自支撑凝胶聚合物为电解质的铝离子电池[39]Fig. 9 A kind of aluminum-ion battery using self-supporting gel polymer as electrolyte[39]
3 挑战与展望
3.1 挑 战
铝离子电池因其电解质体系的高安全性和金属铝资源丰富而受到广泛关注。与碱金属离子电池易燃的有机电解质相比,铝离子电池的电解质具有不易燃性,可以保证电池安全高效地运行。然而,铝离子电池从实验室走向商业化的过程,在电解质方面还面临许多挑战。首先,电解质作为电池重要组成部分,必须保证其能够和铝电极发生沉积溶解反应,同时,电解质应该具备较宽的电化学窗口以获得更高的能量密度。因此,高效稳定的理想电解质是首要解决的问题。 此外,不同电解质体系各有缺点。 水系电解质难以避免析氢反应和铝的钝化氧化,充放电过程中产生的气体也影响电池的安全性和寿命;非水系离子液体电解质价格昂贵,湿度敏感,腐蚀性强,易导致正极材料的溶解和容量损失;无机熔盐电解质需要额外的加热条件来保证电池的运行,电池难以小型化;凝胶聚合物电解质本质上还是以离子液体为主,虽然降低了电解质腐蚀性和湿敏性,但其研究尚处于起步阶段,难以成为理想电解质的可靠选择。
3.2 展 望
研究表明,对于水系电解质,对铝负极进行预处理可以缓解其在水系电解质中析氢和钝化问题,同时提高水系电解质的浓度也有利于提升电池整体的能量密度;对于离子液体电解质,以尿素等其他组分代替咪唑氯化物可以降低成本,改善离子液体的黏度可以提升扩散动力学;对于熔盐电解质,通过改变无机熔盐的组分可以降低工作温度和运行成本。 尽管这些策略可以有效改善电解质的电化学性能,取得了一定成效,但铝离子电池电解质仍存在各种缺陷,还有很大的发展和探索空间。 开发具有宽电化学窗口、低腐蚀性、高安全性的固态电解质是一个重要的发展方向。 得益于电解质体系的高安全性,铝离子电池在未来的储能系统中将占据一席之地。
