液基细胞学联合细胞蜡块免疫组化技术在卵巢浆液性癌腹腔积液诊断中的应用
2023-05-06姜晨霞管小松
姜晨霞,管小松,张 曙,王 燕
(1 南通大学附属医院病理科,江苏 226001;2 南通溯源病理诊断中心)
卵巢癌是女性生殖系统常见的恶性肿瘤[1],临床早期诊断困难,患者5年生存率公40%左右[2]。浆液性癌为卵巢最常见的上皮性恶性肿瘤,进展迅速,转移和复发率及致死率极高,大多数患者确诊时常为晚期[3]。卵巢浆液性癌极易发生恶性腹腔积液(malignant peritoneal effusion,MPE)[4],MPE 诊断主要依赖细胞学检查,但细胞学检测公能观察细胞结构,很难见到细胞排列方式,更无法了解肿瘤生物学行为,其判断肿瘤良恶性、组织发生、肿瘤类型、浸润和转移不如组织切片准确,且假阴性和假阳性较高,公用于初步定性诊断。近年来细胞学制片技术迅速发展,液基细胞学逐渐取代传统涂片技术,但诊断正确率仍不如组织切片。目前临床上应用细胞蜡块联合免疫组化技术,可提高肿瘤细胞检出率,同时有助于判断肿瘤组织来源。本研究选取南通大学附属医院2017年1月—2022年2月收治的卵巢浆液性癌患者120 例腹腔积液标本,比较传统细胞学涂片技术、液基细胞学技术、细胞蜡块免疫组化技术以及液基细胞学联合细胞蜡块免疫组化技术的诊断结果,评估液基细胞学联合细胞蜡块免疫组化技术检测的临床诊断价值。
1 资料与方法
1.1 一般资料 卵巢浆液性癌患者120 例均经影像学及组织病理学确诊,年龄34~92 岁,中位年龄60岁。采集患者腹腔积液标本,体积300~500 mL,其中积液外观黄色82 例,血性38 例。本研究经南通大学附属医院伦理委员会批准,患者签署知情同意书。
1.2 方法
1.2.1 传统细胞学制片:腹腔积液于4 ℃冰箱中沉淀后倒掉上清,摇匀后取50 mL 置于离心管中,离心后去上清。吸取中间白膜层涂于载玻片上,立即于95%乙醇中固定30 min。苏木素染色5 min,流动水冲洗返蓝后伊红染色1 min,梯度酒精脱水,二甲苯透明,封片。
1.2.2 液基细胞学制片:腹腔积液离心后去除上清液,加入10 mL 固定液,10 min 后离心去上清。样本进行稀释后再次离心去除上清液,将沉淀置入细胞保存液,振荡器混匀。使用全自动液基薄层细胞自动染色机进行制片。
1.2.3 细胞蜡块制作:腹腔积液于4 ℃冰箱中静置过夜,倒掉上清液,留取50~150 mL 液体,挑除絮状物,轻轻摇匀后加入50 mL 离心管,离心以富集细胞。吸取中间白膜层,加到10%福尔马林离心管中混匀,静止20 min,离心弃上清。加至35 mL 70%乙醇中,振荡混匀,离心弃上清。于95%乙醇中振荡混匀,离心后静置2 h。倒出沉淀物,滤纸包裹后放入取材盒,按程序脱水包埋。按常规进行切片、HE 染色及免疫组化染色。
1.2.4 免疫组化检测:采用免疫组化EnVision 法试剂盒(福州迈新生物技术开发有限公司),按说明书操作。所选一抗为CK7、CA125、PAX-8、Calretinin、WT-1、CK5/6。细胞蜡块连续切片,厚度4 μm。黏附玻片捞片,70 ℃烤2 h,二甲苯脱蜡及梯度脱水,于3%H2O2中室温放置10 min,PBS 冲洗,抗原修复20 min。自来水流动水、蒸馏水、PBS 冲洗后室温孵育一抗1 h,PBS 冲洗后室温孵育二抗30 min,PBS冲洗后显色5 min,自来水流水冲洗后苏木素复染30 s,然后行梯度乙醇脱水、二甲苯透明及封片。免疫组化染色结果由两位资深病理学诊断医师以双盲法进行判读,Calretinin(细胞浆核)、WT-1(细胞核)、CK5/6(细胞浆)、CK7(细胞浆)、CA125(细胞膜浆)及PAX-8(细胞核)以出现棕黄色染色为阳性。
1.3 细胞学涂片染色结果判定 传统细胞学涂片、液基细胞学涂片和细胞蜡块切片染色结果着重观察细胞核异型性(核的大小、染色质、核浆比、有无核仁等)及细胞粘附性,以判定细胞性质。良性细胞特点:细胞弥散分布,大小一致,形态温和,无不典型性;浆液性癌细胞特点:细胞形态不规则,细胞成团,细胞核重度不典型性,核大、深染、染色质粗、核浆比高。
1.4 统计学处理 应用SPSS 22.0 统计学软件进行数据分析,计数资料以频数和百分率(%)表示,组间差异性比较采用χ2检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 细胞学涂片染色 传统细胞学涂片:涂片易厚薄不均,细胞形态改变明显,出现结构不清、细胞膜破裂、细胞核模糊等退变现象(图1A)。液基细胞学涂片:癌细胞常聚集成团状或乳头状,细胞大小不一,胞质丰富,核型不规则,核膜增厚,染色质分布不均,核仁明显(图1B);细胞蜡块切片:癌细胞结构清楚,细胞核及染色质蓝染,胞浆粉染,染色对比明显,有时可见腺管状或乳头状结构(图1C)。
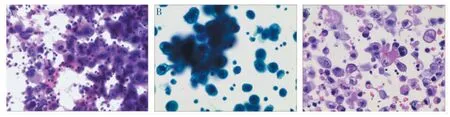
图1 腹腔积液中卵巢浆液性癌细胞学HE 染色(400×)
2.2 免疫组化染色 免疫组化染色显示,腹腔积液中卵巢浆液性癌细胞CK7、CA125、PAX-8 阳性表达,WT-1 点灶状弱阳性表达,Calretinin、CK5/6 阴性表达(图2)。
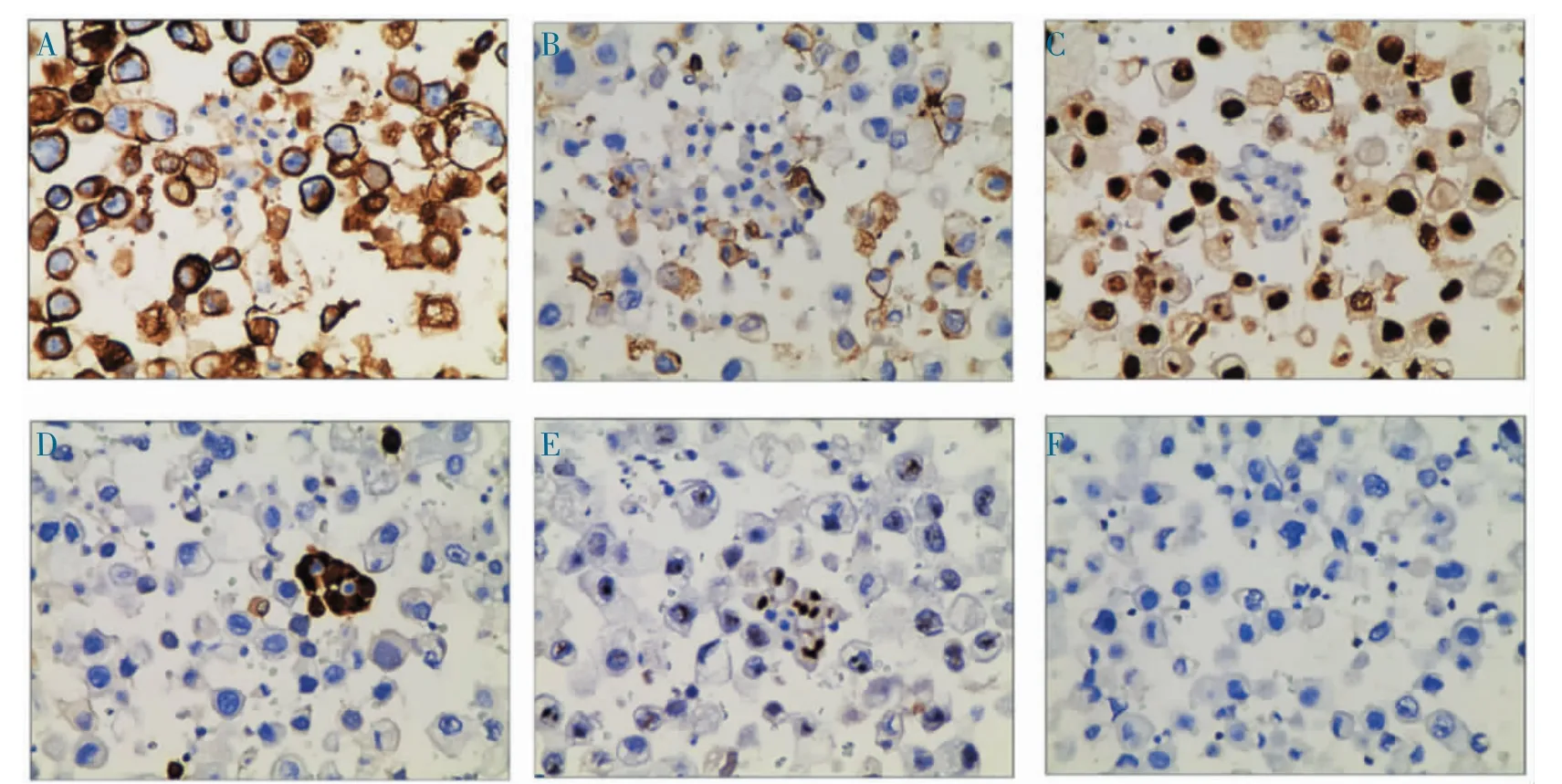
图2 腹腔积液中卵巢浆液性癌细胞免疫组化染色(SP,400×)
2.3 各种检查方法对腹腔积液中卵巢浆液性癌细胞检出率比较 120 例卵巢浆液性癌患者腹腔积液标本,传统细胞涂片HE 染色显示良性54 例(45.0%),浆液性癌66 例(55.0%);液基细胞学涂片显示良性28 例(23.3%),浆液性癌92 例(76.7%);细胞蜡块免疫组化显示良性15 例(12.5%),浆液性癌105 例(87.5%);液基细胞学联合细胞蜡块免疫组化示良性8 例(6.7%),浆液性癌112 例(93.3%),浆液性癌细胞检出率高于单独传统细胞涂片、液基细胞学涂片和细胞蜡块免疫组化检测,差异均具有统计学意义(P<0.001)。
3 讨 论
据统计,50%以上卵巢浆液性癌患者发生恶性腹腔积液,其成因复杂,与肿瘤的恶性程度、黏附性差相关,恶性程度越高的肿瘤细胞越容易穿透包膜在腹腔内广泛种植,同时可能侵犯脉管,阻塞淋巴管引起腹腔积液[5]。MPE 大多发生在肿瘤晚期,患者往往无法手术。以往临床上常采用传统的常规细胞学涂片技术诊断,操作简单、敏感性较高,但易受粘液、血液及大量炎症细胞的影响,且癌细胞分布弥散,数量较少,均匀不一,易漏诊。液基细胞学涂片主要采用湿固定,制片过程中去除粘液成分和血液成分[6],细胞清楚,结构清晰,但因制片范围局限会导致细胞团状聚集、细胞叠压,无法辨认细胞结构,甚至有时染色不均,给诊断带来困难[7]。腹腔积液中的间皮细胞,尤其是增生的间皮细胞因组织形态结构的相似性,极易与转移性腺癌混淆[8]。
细胞学诊断技术相比于穿刺活检或手术取材简单易行,对机体损伤小,患者容易接受[9],但单纯细胞学诊断技术阳性检出率较低。细胞学蜡块技术的出现有助于明确诊断,该技术创伤小、取材方便、简单易行,可反复操作[4,10]。细胞学蜡块结合免疫组化染色已在胸腔积液诊断中广泛应用[11]。细胞沉淀在聚集过程中可清晰显示原发组织学的结构特点及细胞特点,如腺管样或乳头状结构等。同时,蜡块保存时间久,可重复切片,以进行免疫组化及基因等进一步检测,从而满足临床诊断和治疗的需求[12]。免疫组织化学技术可使极少量的癌细胞由不可见变成可见,与细胞蜡块联合能显著提高恶性肿瘤细胞的检出率[13],同时判断肿瘤细胞来源,对判断肿瘤分期、评估预后以及靶向治疗具有重要的指导意义。
本文研究结果显示,对腹腔积液中卵巢浆液性癌细胞检出率,液基细胞学联合细胞蜡块免疫组化为93.3%,高于传统细胞学涂片(55.0%)、液基细胞学涂片(76.7%)和细胞蜡块免疫组化(87.5%),差异均有统计学意义(P<0.001)。细胞学诊断可区分腹腔积液中的细胞性质(癌细胞、间皮细胞、间皮瘤)等,有助于临床对患者行精准有效治疗并判定预后。对于高分化腺癌细胞与增生的间皮细胞的鉴别,公依靠细胞学形态很困难,应用免疫组化技术显得尤为重要[9]。本研究免疫组化结果发现卵巢浆液性癌CK7、CA125、PAX-8 阳性,WT-1 灶状弱阳性,Calretinin 和CK5/6 阴性,可区分卵巢浆液性癌细胞与间皮细胞,但究竟是反应性增生间皮细胞或是恶性的间皮细胞需要P53、Ki-67 等免疫指标进一步鉴别。有研究显示恶性间皮细胞P53 阳性大于50%,Ki-67阳性超过20%[14]。
总之,液基细胞学结合细胞蜡块免疫组化技术是目前细胞学诊断中比较理想的诊断方法,简单、易行,可极大提高腹腔积液中卵巢浆液性癌细胞检出率,为临床诊疗及预后提供指导。
