雷奈酸锶对骨代谢的影响及其机制的研究进展
2023-05-06王绍泰宋东升
王绍泰, 姜 欢, 宋东升, 李 超, 胡 敏
(1.吉林大学口腔医院正畸科,吉林 长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
骨代谢包括骨形成和骨吸收2 个方面,成骨细胞和破骨细胞是维持骨代谢稳态最重要的2 种细胞。通过骨基质和矿物质不断的沉积和吸收,使骨骼的成分维持动态平衡[1]。骨代谢异常多由于成骨细胞和破骨细胞活力的失衡导致,临床上表现为骨缺损、骨折、骨痛和畸形等。许多疾病常并发骨代谢异常,长骨中表现为骨质疏松症和佝偻病等,口腔疾病中包括牙周炎和颌骨恶性肿瘤等。手术治疗如甲状旁腺切除术后,导致甲状旁腺激素失调也会引起患者骨代谢异常[2]。临床上针对骨代谢异常疾病的主要治疗方法包括手术治疗和药物治疗等,其中雷奈酸锶(strontium ranelate,SrR)由于其显著的治疗优势逐渐成为研究热点。SrR 一方面可以通过参与骨钙化过程并在成骨细胞中聚集,增加胶原合成,另一方面可以通过抑制破骨细胞介导的骨吸收来调节骨代谢[3]。在早期和晚期愈合骨中,SrR刺激骨形成,减少骨吸收;而在成熟骨中,SrR 只减少骨吸收,骨形成作用不发生改变[4]。研究[5]显示:SrR 具有明确的促进骨形成和抑制骨吸收作用。然而,对于SrR 影响骨代谢的分子调控机制研究较少,尤其是对于相关信号通路的研究尚不全面。现就SrR 对骨代谢的影响,总结SrR 通过各种信号通路调节骨代谢的机制,探讨SrR 在临床中的应用并展望未来研究的方向,以期为今后临床用药及寻找新的作用靶点提供相应的理论依据。
1 SrR 药理学性质
1.1 SrR 化学结构SrR 不溶于有机溶剂,微溶于水,含有2 个雷奈酸偶联的锶(Sr)原子。人体摄入SrR 后,发挥药物疗效的主要是Sr 元素,雷奈酸根难以被吸收,最后多排出体外。SrR 化学结构见图1。
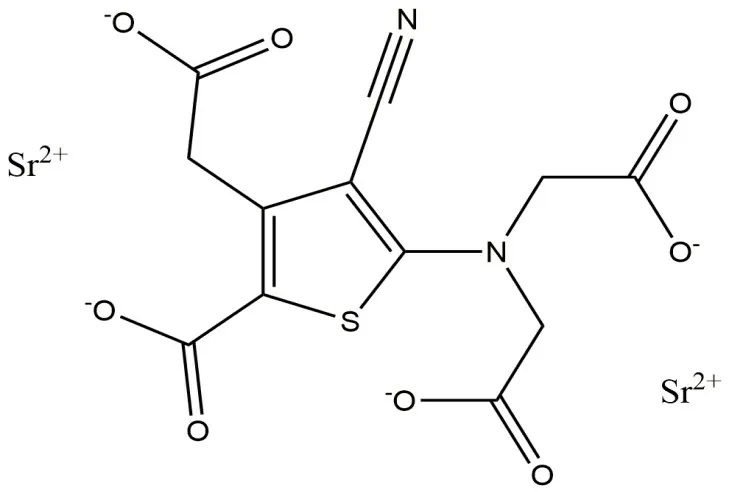
图1 SrR 的化学结构Fig.1 Chemical structure of SrR
1.2 SrR 促进骨形成在骨代谢功能活跃的区域,成骨细胞分泌类骨质,经过一段时间矿化后逐渐形成新骨。SrR 促成骨作用大部分通过钙敏感受体(calcium-sensing receptor,CaSR)介导的信号通路产生,G 蛋白偶联受体CaSR 在成骨细胞和破骨细胞中表达,使其能够感知细胞外钙的变化。利用SrR 激活CaSR,进而诱导成骨分化,促进细胞的增殖、矿化及骨合成代谢作用[6-8]。因此,应用SrR 后可以观察到细胞中的骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)、骨硬化素、骨钙蛋白和骨桥蛋白基因的表达水平升高,同时Ⅰ型胶原表达增强[9-10]。在各种通路机制和作用靶点调控下,促进骨样结节形成、细胞矿化和增殖,进而促进骨折愈合[11-13]。临床上接受SrR 药物治疗的患者,可以观察到骨组织不断改善,骨小梁数量和厚度增加且骨小梁间距缩小,降低了骨折的发生风险[14-16]。
1.3 SrR 抑制骨吸收骨质吸收是指在致病因素作用下,破骨细胞活性增强而成骨细胞活性降低,导致骨量减少,骨微结构破坏。在肿瘤、骨折和炎症患者中常存在骨吸收,应用SrR 可以抑制破骨细胞活性。破骨细胞前体细胞的激活在于核因子κB受体活化因子配体(receptor activator of nuclear factor-kappa B ligand,RANKL)的激活。锶离子(Sr2+)增强骨保护素(osteoprotegerin,OPG)的表达,并且降低RANKL 的表达,由于OPG 与核因 子- κB 受 体 活 化 因 子(receptor activator of nuclear factor-kappa B,RANK)相 互 竞 争RANKL,提高了OPG/RANKL 蛋白比值,进而降低破骨细胞的激活[17-18]。SrR 抗骨吸收作用多是由于Sr2+抑制RANKL 诱导的破骨细胞分化,并通过激活CaSR 来降低破骨能力[19-20]。牙槽骨是高度可塑性组织,是全身骨骼中变化最活跃的部分。在病理状态或应力状态下,牙槽骨会随之进行骨改建。利用结扎的方法建立实验性大鼠牙周炎模型,给予SrR 的实验组大鼠牙槽骨吸收减少,破骨细胞数量减少,成骨细胞数量明显增加[21]。通过对大鼠牙齿施加应力作用破坏邻近牙槽骨,若同时接受SrR 治疗,破骨细胞活性就会明显降低,根吸收面积明显缩小[22]。
2 SrR 调控的相关信号转导通路及作用靶点
2.1 转化生长因子β(transforming growth factor-β,TGF-β)/Smad 信号通路TGF-β/Smad通路是细胞中最常见的信号通路之一,参与多种细胞的生长、分化、增殖和迁移等。成骨细胞和破骨细胞均能合成分泌TGF-β,TGF-β 既能促进骨形成,也能抑制成骨细胞RANKL表达,增加OPG分泌。BMP-2 为TGF-β 超家族中的重要成员,是一种促骨生成因子,通过调节一系列基因的活性,控制成骨细胞和破骨细胞的生物活性[23]。激活的Smad 蛋白可将BMP-2 和TGF-β 信号从细胞膜传递至细胞核。通过检测TGF-β、Smad 和BMP 蛋白含量可以确定是否激活TGF-β/Smad 信号通路,研究[24-25]显示:应用SrR 处理过的大鼠骨折部位BMP-2 蛋白表达水平明显升高,SrR 也能通过激活该信号通路明显改善家兔激素性股骨头坏死的病理损伤。基于SrR 和BMP-2 蛋白联合应用可以更好地促进成骨细胞增殖分化,可以设计一种能联合释放Sr2+和BMP-2 的骨组织支架,促进骨形成作用[26-27]。
2.2 刺猬(hedgehog,Hh)信号通路Hh 信号通路在哺乳动物的发育过程中起重要作用,参与多种生物学过程,包括胚胎发育、干细胞增殖和分化等[28]。Hh 通路被异常激活时,会诱发癌症。Hh 家族包括3 个同源基因:音速刺猬(sonic hedgehog,Shh)因子、印度刺猬(indian hedgehog,Ihh)因子和沙漠刺猬(desert hedgehog,Dhh)因子。其中,Shh 信号分子参与骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)的 成 骨 分 化,而Ihh 并不参与此过程[29]。细胞膜上存在碎片蛋白(patched,Ptc)和润滑蛋白(smoothened,Smo)2 种受体,在正常情况下,Ptc 抑制Smo 蛋白活性,从而抑制下游通路,而当Ptc 和Shh 结合后,解除对Smo 的抑制作用,促使 Gli 蛋白与其他分子形成大分子复合物,进入核内激活下游靶基因转录。SrR 可以通过激活Hh 受体上调Gli1 蛋白表达,而Gli1 可以增加钙结节形成并能使Runx2 高表达,因此可以通过激活Hh/Gli1 通路来促进BMSCs 成骨向分化[29-30]。Hh 通路激活后,也能降低细胞中促脂肪向分化的转录因子氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的表达,脂质积累减少,促进间充质干细胞的成骨向分化。
2.3 Wnt/β-连环蛋白(β-catenin)信号通路Wnt信号通路主要包括经典Wnt/β-catenin 通路、平面细胞极性通路和Wnt/Ca2+通路,其中经典Wnt/β-catenin 通路在成骨分化中发挥重要作用。SrR 可以刺激成骨细胞中Wnt 信号相关分子[Wnt3a、Wnt5a、Wnt7b、糖 原 合 成 酶 激 酶-3β (glycogen synthase kinase-3β,GSK-3β)和β-catenin 等]的表达,抑制成脂基因PPARγ 的表达[31-32]。通过应用SrR 激活Wnt 信号通路,可以对抗年龄相关的骨丢失,促进骨丢失处成骨作用。
应用Wnt 信号通路抑制剂可明显抑制SrR 诱导的成骨细胞基因表达。骨硬化素是一种骨细胞特异性分泌蛋白,可以抑制Wnt 信号通路,对骨形成有负向调控作用,在骨硬化素敲除小鼠模型中可以观察到成骨细胞活力明显升高。添加Sr 元素可抑制骨硬化素的表达,研究[33-35]显示:SrR 可抑制颗粒诱导的小鼠慢性假体周围骨溶解,减缓无菌性松动的发生,其主要依赖于SrR 下调了Wnt 信号通路中骨硬化素的表达。
2.4 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路MAPK 信号通路主要由c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)、细胞外信号调节激酶(extracelluar signal-regulated kinase,ERK)和p38 等 组 成,参与调控细胞生长、凋亡以及炎性反应等。通过激活上游调控因子大鼠肉瘤病毒癌基因同源物或组蛋白甲基化酶Setd2[36],可以在成骨分化过程中形成正反馈,激活MAPK 信号通路进而促进成骨作用[37-38]。Sr2+通过激活MAPK 通路来调控Setd2 表达,经Sr2+刺激的牙周膜干细胞中Setd2 的表达明显升高,这种升高是通过抑制不均一性核糖核蛋白L实现的[39-40]。CaSR 也可以调控下游的ERK,应用Sr2+处理过的成骨细胞或人牙髓细胞均有ERK1/2磷酸化,表明MAPK 信号通路也可以通过CaSR激活[41-42]。
2.5 PI3K/Akt 信号通路PI3K/Akt 信号通路参与细胞增殖、分化、凋亡和葡萄糖转运等多种功能,并且与肿瘤的发生有密切关联。SrR 可以通过Akt 信号通路影响BMSCs 的增殖和分化。SrR 增加了Akt 相关通路的磷酸化,可通过Akt 依赖的方式干扰BMSCs 的脂肪向分化过程,进而促进成骨分化[43]。其中,Sr2+激活的CaSR 可以促进PI3K 的激活,进而水解底物二磷酸肌醇生成三磷酸肌醇,三磷酸肌醇可以通过激活磷酸肌醇依赖性蛋白激酶来激活PI3K/Akt 信号,进而促进细胞增殖和成骨分化,增强抗凋亡能力[40,44]。
2.6 其他信号通路除了上述常见信号通路,激活Ras 同源基因家族成员A (Ras homolog gene family member A,RhoA)-Rho 激酶(Rho kinase,ROCK)信 号 通 路 也 能 促 进BMSCs 成 骨 分 化[45]。研 究[46]显 示:SrR 使 卵 巢 切 除 大 鼠BMSCs 中ROCK1 表达水平升高,可促成骨分化、抑制细胞凋亡,加入ROCK1 抑制剂Y-27632 可抑制该过程。SrR 也能通过刺激Ca2+通道来激活NF-κB 通路,促进血管平滑肌细胞增殖和迁移并增加成骨能力[47]。而在成骨细胞中,SrR 对细胞生长的影响也可通过阳离子感应机制激活成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFRs)来 介导,选择性FGFRs 抑制剂可明显抑制SrR 诱导的成骨细胞生长[48]。SrR 也可以通过钙调磷酸酶(calcineurin,CaN)-活化T 细胞核因子(nuclear factor of activated T cells,NFAT)来增强骨形成作用,利用CaN 抑制剂可降低SrR 诱导BMSCs 中Runt 相 关 转 录 因 子2 (Runt-related transcription factor 2,Runx2)和PPARγ 的调节,表明NFAT信号通路与SrR 诱导BMSCs 中成骨形成和减少脂肪 形 成 有 关[32,49]。上 述SrR 调 控 骨 代 谢 的 相 关 信号通路见表1。

表1 SrR 调控骨代谢的相关信号通路Tab.1 Related signaling pathways of bone metabolism regulated by SrR
2.7 SrR 作用于细胞酶细胞酶也是SrR 的作用靶点,其中环氧化酶2(cyclooxygenase-2,COX-2)和血红素加氧酶1(heme oxygenase-1,HO-1)在信号转导通路中起重要作用。COX-2 在正常细胞内的活性极低,但当细胞受到炎症等刺激时其在细胞中的表达水平迅速升高。应用选择性COX-2 拮抗剂可以降低SrR 对成骨分化的作用[50],细胞增殖和抗凋亡能力均下降[41]。HO-1 激活则会导致细胞迁移和促炎介质释放的减少,SOUZA 等[51]发现SrR (100 mg·kg-1)可 上 调 牙 龈 组 织 中HO-1 mRNA 表达水平,并且SrR 可抑制牙周炎造成的骨丢失,表明牙周炎患者中SrR 可以通过HO-1 调节骨代谢紊乱。
3 SrR 的临床应用
Sr2+在低浓度时能诱导细胞增殖,而在高浓度时则会抑制细胞增殖[52]。应用体内的生物材料支架,若对SrR 释放速率不加控制,局部形成的高浓度Sr2+会抑制骨形成作用。埃洛石纳米管作为SrR的纳米载体掺入明胶涂层中可调节SrR 的释放[53]。聚乳酸制备给药系统也能调节释放速率,利于骨形成作用[54]。因此,在临床治疗中常将SrR 与生物材料[55-58]或甲状旁腺激素联合应用[59],可增强碱性磷酸酶活性和有机基质的合成能力,加速成骨分化。
SrR 可以降低重度骨质疏松症患者的骨折风险[60-61],并且对使用双膦酸盐治疗但骨折仍未愈合的患者有积极的促骨形成作用[62]。在口腔医学领域,利用SrR 促骨形成特性,可将SrR 应用于种植体表面来促进骨整合[63],或应用于上颌横向扩弓后腭中缝的骨形成[64]。
4 SrR 不良反应
作为一种重要的调节骨代谢的药物,SrR 广泛应用于临床,但其不良反应在临床上也不容忽视,主要包括头痛、恶心、腹泻、皮炎、湿疹和静脉血栓等[65]。其最常见的是胃肠道不良反应(腹泻)[66-67]。同时,应用SrR 治疗的禁忌证包括心肌梗死、外周动脉疾病、脑血管疾病及未控制的高血压[65]。只有遵循应用SrR 的适应证和禁忌证,才能在安全范围内实现对患者骨代谢的调控,降低应用药物后的不良反应。
5 总结与展望
SrR 可以通过影响不同的信号通路进而起到调节骨代谢的作用。信号转导通路可能通过靶点基因或蛋白与其他信号通路相互联系,形成错综复杂的网络,研究上述信号通路机制有助于指导SrR 的临床应用。然而,SrR 影响骨代谢过程中的内在机制仍未完全明确,SrR 对体内其他细胞作用的相关报道也十分有限,需要进一步研究。未来,在深入探索SrR 药理学性质后,可以不断寻找治疗骨代谢疾病的新靶点并开发研究适合SrR 作用机制的药物载体,以期在实现应用SrR 调节骨代谢的同时最大程度减少其对机体的不良反应。
