ADAM10 在人动静脉内瘘狭窄处血管组织中的表达及其对血管平滑肌细胞增殖和迁移的影响
2023-05-06孙利军刘小明任广伟
孙利军, 冯 杰, 刘小明, 任广伟, 阮 琳
(河北医科大学第一医院肾内科,河北 石家庄 050031)
2015 年,全世界约有262 万人患有终末期肾病(end stadge renal disease,ESRD),多数患者接受血液透析治疗作为肾脏替代疗法[1],其中血液透析治疗需要功能良好的血管通路。根据肾脏病预后质量指南(kidney disease outcomes quality initiative,KDOQI)和 临 床 实 践 建 议,自 体 动 静 脉 瘘(arteriovenous fistula,AVF)是血液透析的首选血管通路[2],其全因死亡率较低[3]。然而,静脉狭窄一直是AVF 失败的主要原因。内膜增生作为AVF狭窄的始动环节,其主要细胞来源是血管平滑肌细胞(vascular smooth muscle cells,VSMCs),而内膜增生的生物学机制之一为炎症[4]。研究[5]显示:AVF 小鼠动静脉吻合口血管内膜增生,炎症因子水平明显升高。去 整 合 素 金 属 蛋 白 酶 10(a disintegrin and metalloproteinase 10,ADAM10)作为去整合素金属蛋白酶超家族一员,参与调控机体炎症等生理过程。ADAM10 能够水解Notch 蛋白膜外段受体,激活Notch 信号通路[6],阻断Notch 信号通路可抑制细胞增殖,减少内膜增生[7]。Notch信号通路抑制剂DAPT 能有效阻断Notch 介导的神经细胞炎症[8]。由此推测,ADAM10 高表达导致Notch 信号通路激活,刺激VSMCs 增殖,导致内膜增生,进而引起动静脉内瘘狭窄。本研究探讨ADAM10 在人动静脉内瘘狭窄处血管组织中的表达水平,通过脂多糖(lipopolysaccharide,LPS)处理VSMCs 模拟体外AVF 炎症环境,阐明沉默ADAM10 基因表达对VSMCs 细胞表型的影响及其可能的分子机制。
1 资料与方法
1.1 临床资料收集2018 年3 月—2021 年1 月因AVF 狭窄再次来本院接受手术治疗的42 例终末期肾病(end stadge renal disease,ESRD)患者临床资料及临床样本(AVF 组),年龄29~68 岁,其中男性30 例,女性12 例;取上述42 例ESRD 患者第一次手术正常静脉组织样本作为正常对照组。所有患者在诊断为ESRD 后立即接受血液透析。AVF 狭窄诊断标准:①静脉腔直径较上游静脉缩小50%以上;②当狭窄部位位于吻合口2 cm 以内时,该狭窄部位的血流峰值收缩速度(peaksystolicvelocity,PSV)与上游静脉2 cm 处PSV 之比超过3.0,或当狭窄部位位于吻合口2 cm以上时,PSV 之比超过2.0;③流出道狭窄:移植物 中 部PSV<100 cm·s-1,或 远 端 静 脉PSV>300 cm·s-1;④在流入狭窄中,PSV 在狭窄部位增加,远端呈单相和减少的波形,或流出吻合处移植物受压,血流加速[9]。满足以上任何一项即可认为AVF 狭窄。纳入标准:①年龄18~80 岁;②行前臂AVF 手术;③透析时间均≥2 年,且透析频率每周2 或3 次;④抗凝剂均使用肝素。排除标准:①患者出现全身感染及心力衰竭症状;③过去6 个月内有激素或免疫增强治疗史;④收集组织后1 个月内怀孕;⑤未获得书面同意书。术中采集静脉组织,其中AVF 组患者取狭窄上游2 cm 处的狭窄静脉血管组织,正常对照组患者取正常静脉血管组织。患者的临床参数包括年龄、性别、体质量指数(body mass index,BMI)、吸烟状况、酒精史、糖尿病和高血压史比较差异均无统计学意义(P>0.05),具有可比性。本研究获得河北医科大学第一医院伦理委员会批准,所有患者均签署知情同意书。
1.2 细胞、主要试剂和仪器人源VSMCs 购自美国ATCC 公司。si-ADAM10 干扰质粒(5′-CAGUGUGCAUUCAAGUCAA-3′)及其阴性对照si-NC(5′-AATTCTCCGAACGTGTCACGT-3′)由 上海吉玛制药技术有限公司提供,DAPT 购自美国Abcam 公司,转染试剂Lipofectamine 2000 购自美国Thermo Fisher Scientific 公 司,ADAM10 抗 体、β-actin 抗体、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体和基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)抗体均购自美国Abcam 公司,辣根过氧化物酶标记的山羊抗兔IgG 抗体购自武汉博士德生物工程有限公司,Notch 同 源 蛋 白1 (Notch homolog protein 1,Notch1)抗 体、Notch 细 胞 内 结 构 域(Notch intracellular domain,NICD)抗体和发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)抗体均购自美国Cell Signaling Technology 公司,CCK-8 试剂盒购自北京阳光生物科技有限公司,全蛋白提取试剂盒购自北京普利莱基因技术有限公司,BCA 蛋白分析试剂盒购自北京安诺伦生物科技有限公司,ECL 试剂盒购自美国Bio-Rad 公司,RNA 提取试剂盒购自厦门艾德生物公司,Reverse Transcription System 逆转录试剂盒购自北京Promega 公司,SYBR®Green qPCR SuperMix 荧光定量试剂盒购自美国Thermo Fisher Scientific 公司。iMark 酶标仪购自美国Bio-Rad 公司,7500 ABI 实时 荧 光 定 量 PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪购自美国应用生物系统公司,CX33 显微镜购自日本奥林巴斯公司,Tanon 5200 凝胶成像仪购自上海天能科技有限公司。
1.3 免疫组织化学法检测静脉血管组织中ADAM10 蛋白表达情况利用10%甲醛室温固定静脉血管组织24 h,梯度乙醇脱水,进行石蜡包埋,再将5 μm 厚石蜡组织切片置于55 ℃ 烤片6 h。经二甲苯脱蜡和梯度乙醇复水后,将切片置于柠檬酸盐缓冲液中高温修复抗原,滴 加3% H2O2室温 孵 育15 min,5%山羊血清室温封闭1 h,再滴加ADAM10 抗体(1∶500)于4 ℃孵育过夜。PBS缓冲液洗涤3 次,加入辣根过氧化物酶标记的二级抗体(1∶5 000)室温孵育1 h,滴加3,3′-二氨基联 苯 胺(3,3′-diaminobenzidine,DAB)显 色,0.5%苏木精复染,0.1%HCl 溶液分化,自来水冲洗反蓝,二甲苯透明,中性树脂封片。利用光学显微镜观察组织中阳性染色区域(棕色区域)。
1.4 细胞培养和LPS 浓度筛选将VSMCs 冻存管迅速放入37 ℃水浴中解冻,加入含4 mL DMEM培养基的离心管中,混合均匀;1 000 r·min-1离心3 min,弃上清液;加入1 mL DMEM 培养基混匀,移入含10% 胎牛血清的DMEM 培养基,置于37 ℃、5% CO2培养箱培养至传代2~3 次后,进行后续细胞检测;采用0.25%胰酶消化VSMCs,计数后将1×105个细胞转至24 孔细胞培养板,待细胞密度接近80% 时取不同浓度(0、0.1、1.0、10.0 和100.0 mg·L-1)LPS 处理VSMCs 24 h,采用CCK-8 实验检测细胞增殖活性,最终确定10 mg·L-1LPS 为后续实验的最佳干预浓度。
1.5 细胞转染及分组处理取对数期VSMCs,以每孔1×105个细胞的密度接种至6 孔细胞培养板,置于37 ℃、5% CO2中培养至80%~90%汇合率,分为si-NC 组和si-ADAM10 组。提前用50 μL 减血清 培 养 基 (OPTI minimal essential medium,OPTI-MEMI)稀 释3 μL 的Lipofectamine 2000,室温孵育5 min。同时,50 μL OPTI-MEMI 培养基分别稀释1 μg 质粒si-NC 和si-ADAM10,将含转染质粒的混合物加入提前稀释的Lipofectamine 2000 中,室温孵育20 min。将孵育好的复合物加入含VSMCs 的6 孔细胞培养板中,轻轻混匀后,在37 ℃、5% CO2中培养6 h,更换新鲜培养液,继续培养48 h,收集细胞采用RT-qPCR 法验证转染是否成功。将VSMCs 分为6 组:①对照组,VSMCs不经任何处理;②模型组(LPS 组),VSMCs 经10 mg·L-1LPS 处理24 h;③LPS+si-NC 组,转染si-NC 质粒的VSMCs 经10 mg·L-1LPS 处理24 h;④LPS+si-ADAM10 组,转 染si-ADAM10 质 粒的VSMCs 经10 mg·L-1LPS 处 理24 h;⑤LPS+DAPT 组,VSMCs经10 mg·L-1LPS 和10 μmol·L-1DAPT 共处理24 h;⑥LPS+si-ADAM10+DAPT组,转染si-ADAM10 质粒的VSMCs 经10 mg·L-1LPS 和10 μmol·L-1DAPT 共处理24 h。
1.6 CCK-8 法检测各组VSMCs 增殖活性取对数期VSMCs,按照每孔2 000 个细胞的密度接种至96 孔细胞培养板中,每组设置3 个重复孔,分组处理后培养24 h。每孔中加入10 μL CCK-8 反应溶液,于37 ℃孵育4 h,使用酶标仪测定450 nm 波长处吸光度(A)值,细胞增殖活性=(加药组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.7 RT-qPCR 法检测各组VSMCs 中ADAM10mRNA表达水平采用高效组织裂解缓冲系统和RNA 修复系统提取组织或细胞总RNA。利用Reverse Transcription System 逆转录试剂盒将总RNA 反转录为cDNA。以cDNA 为模板,利用SYBR®Green qPCR SuperMix 试 剂 盒 进 行RT-qPCR。PCR扩增条件:95 ℃ 预变性5 min;95 ℃变性 20 s,60 ℃ 退火30 s,72 ℃ 延伸30 s,进行40 个循环;72 ℃ 延伸5 min。ADAM10 上游引物,5′-CTGGCCAACCTATTTGTGGAA-3′,下 游 引物,5′-GACCTTGACTTGGACTGCACTG-3′;β-actin 上游引物,5′-TCCCTGGAGGCGAAGAGCTACGA-3′,下 游 引 物,5′-AGCACTGATATGTTGGCGTACAG-3′。以β-actin 为 内 参,采 用2-ΔΔCt法计算各组VSMCs 中ADAM10 mRNA 表达水平。
1.8 Transwell 法检测各组VSMCs 迁移细胞数
取各组对数期细胞,调整细胞浓度至每毫升1×105个 细 胞,取100 μL 细 胞 悬 液 接 种 于Transwell 小 室 上 室,取600 μL 含 有10% FBS 的DMEM 培养基加到下室中,于37 ℃、5 %CO2培养箱中培养24 h。用棉签刮去室内未迁移的细胞,95%乙醇固定细胞30 min,0.1% 结晶紫溶液染色15 min。于200 倍光镜下选择5 个视野统计细胞数量,取平均值作为迁移细胞数。
1.9 Western blotting 法检测各组VSMCs 中ADAM10、PCNA、MMP-9、Notch1、NICD 和Hes1蛋白表达水平收集各组细胞沉淀,按照全蛋白提取试剂盒说明书操作提取细胞蛋白,利用BCA 蛋白质分析试剂盒测定蛋白质浓度。取30 μg 总蛋白配备上样体系,沸水浴变性后通过SDS-PAGE 电泳分离蛋白,采用湿转法将蛋白转移至PVDF 膜上,室温下5%脱脂奶粉封闭2 h,分别加入一抗ADAM10(1∶1 000)、PCNA(1∶500)、MMP-9(1∶200)、Notch1(1∶1 000)、NICD(1∶1 000)、Hes1(1∶1 000)和β-actin(1∶5 000)于4 ℃下孵育过夜。用PBST 缓冲液洗膜3 次,加入辣根过氧化物酶结合的二级抗体(1∶10 000)于室温下孵育1 h,随后通过ECL 试剂盒获取化学发光图像,利用Image J 分析蛋白相对表达水平,以β-actin 为蛋白内参。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值。
1.10 统计学分析 采用SPSS 20.0 统计软件进行统计学分析。各组静脉血管组织和VSMCs 中相关mRNA 和蛋白表达水平、细胞增殖活性及迁移细胞数均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 ADAM10 在人AVF 狭窄处血管组织中的表达免疫组织化学检测结果显示:ADAM10 蛋白主要表达于血管中膜和内膜,其中AVF 组患者静脉血管组织中ADAM10 蛋白表达量高于正常对照组。与正常对照组比较,AVF 组患者静脉血管组织中ADAM10 mRNA 表达水平明显升高(P<0.05)。见图1 和图2。
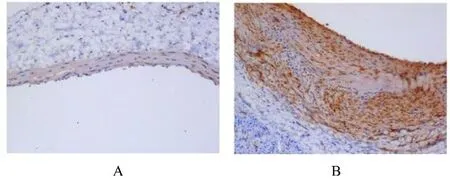
图1 人AVF 狭窄处血管组织中ADAM10 蛋白表达情况(免疫组织化学,×200)Fig.1 Expression of ADAM10 protein in vascular tissue at stenosis of human AVF (Immunohistochemistry,×200)
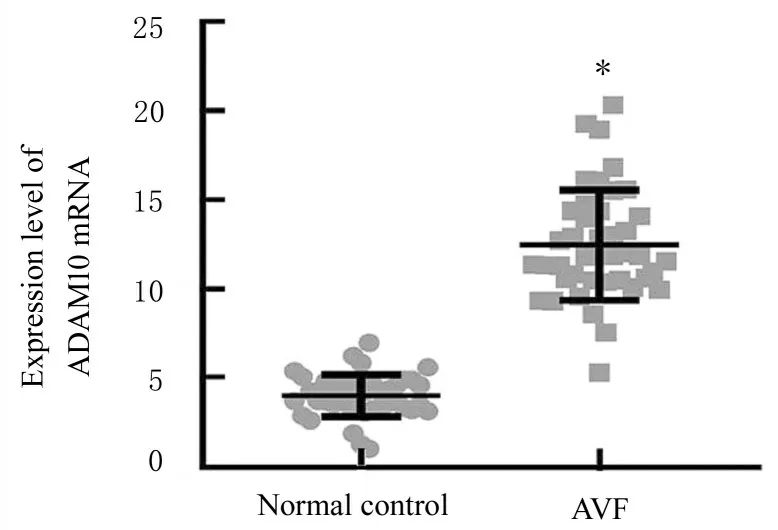
图2 2 组AVF 狭窄处血管组织中ADAM10 mRNA 表达水平Fig.2 Expression levels of ADAM10 mRNA in vascular tissue at stenosis of AVF in two groups
2.2 不同浓度LPS 诱导VSMCs 增殖活性与0 mg·L-1LPS 处理组比较,0.1、1.0 和10.0 mg·L-1LPS 组VSMCs 细胞增殖活性明显升高(P<0.05),其中10 mg·L-1LPS 组细胞增殖活性最高,而100 mg·L-1LPS 组细胞增殖活性明显降低(P<0.05)。因此选择10 mg·L-1LPS 为后续处理浓度。见图3。

图3 不同浓度LPS 诱导VSMCs 增殖活性Fig.3 Proliferative activities of VSMCs induced by different concentrations of LPS
2.3 ADAM10 基因沉默后VSMCs 中ADAM10 mRNA 和蛋白表达水平与对照组和si-NC 组比较,si-ADAM10 组VSMCs 中ADAM10 mRNA 和蛋白表达水平均明显降低(P<0.05)。见图4。
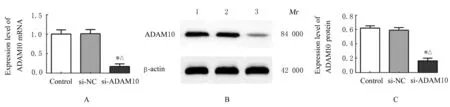
图4 ADAM10 基因沉默后VSMCs 中ADAM10 mRNA 和蛋白表达水平Fig.4 Expression levels of ADAM10 mRNA and protein in VSMCs after ADAM10 gene silencing
2.4 各组VSMCs 增殖活性和迁移能力与对照组比较,LPS 组VSMCs 增殖活性明显升高(P<0.05),迁移细胞数均明显增加(P<0.05);与LPS 组和LPS+si-NC 组比较,LPS+si-ADAM10组VSMCs 增殖活性明显降低(P<0.05),迁移细胞数明显减少(P<0.05)。见图5 和6。
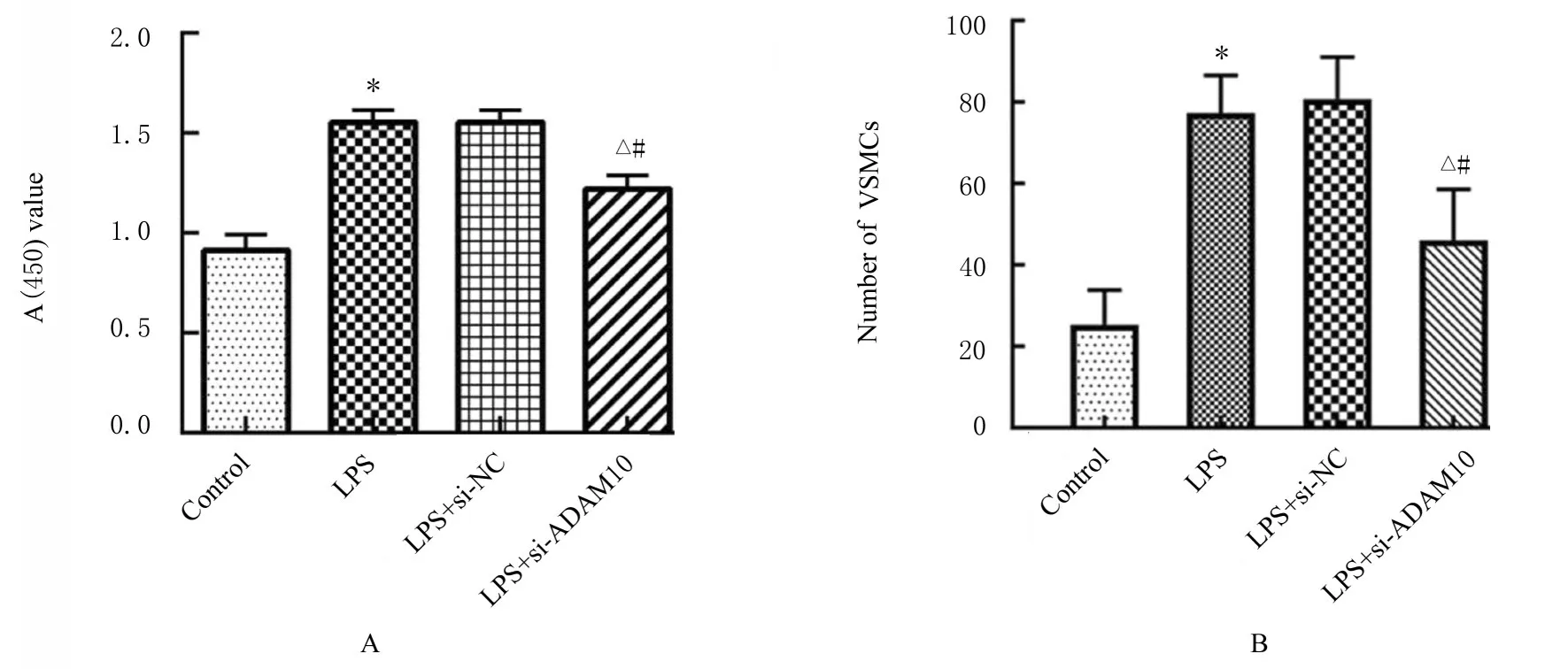
图5 各组VSMCs 增殖活性(A)和迁移细胞数(B)Fig.5 Proliferation activities(A) and migration numbers(B) of VSMCs in various groups
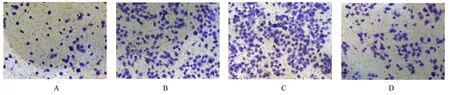
图6 各组VSMCs 迁移形态表现 (结晶紫,×200)Fig.6 Migration morphology of VSMCs in various groups(Crystal violet,×200)
2.5 ADAM10 基因沉默后各组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平与对照组比较,LPS 组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平均明显升高(P<0.05);与LPS 组 和LPS+si-NC 组 比 较,LPS+si-ADAM10 组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平均明显降低(P<0.05)。见图7。
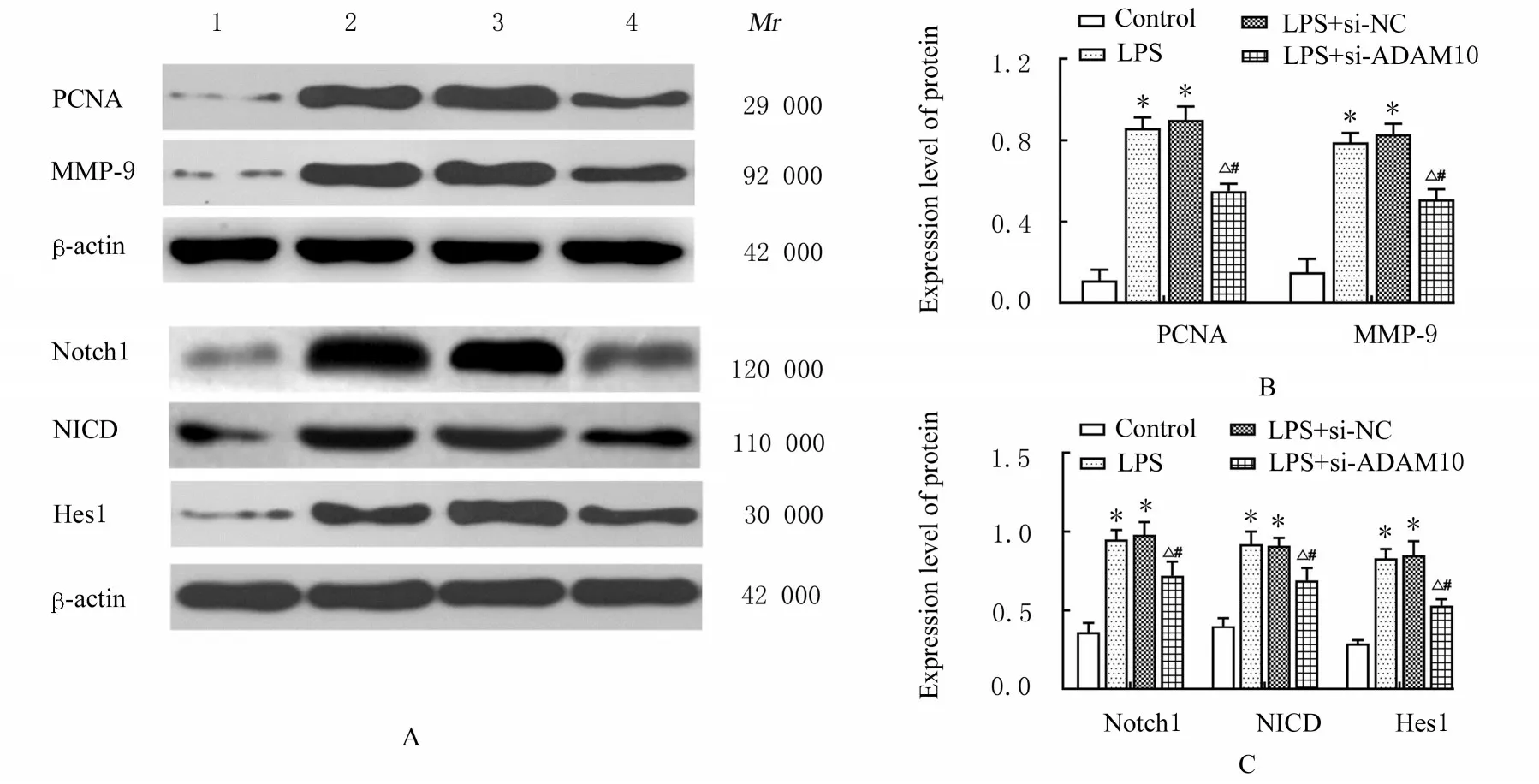
图7 各组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达电泳图和直条图Fig.7 Electrophoregram and histograms of expressions of PCNA, MMP-9, Notch1, NICD, and Hes1 proteins in VSMCs in various groups
2.6 各组VSMCs增殖活性和迁移能力与LPS组比 较,LPS+si-ADAM10 组 和 LPS+DAPI 组VSMCs 增殖活性明显降低(P<0.05),迁移细胞数明显减少(P<0.05);与LPS+si-ADAM10 组比 较,LPS+si-ADAM10 + DAPT 组VSMCs 增殖活性明显降低(P<0.05),迁移细胞数明显减少(P<0.05)。见图8 和9。
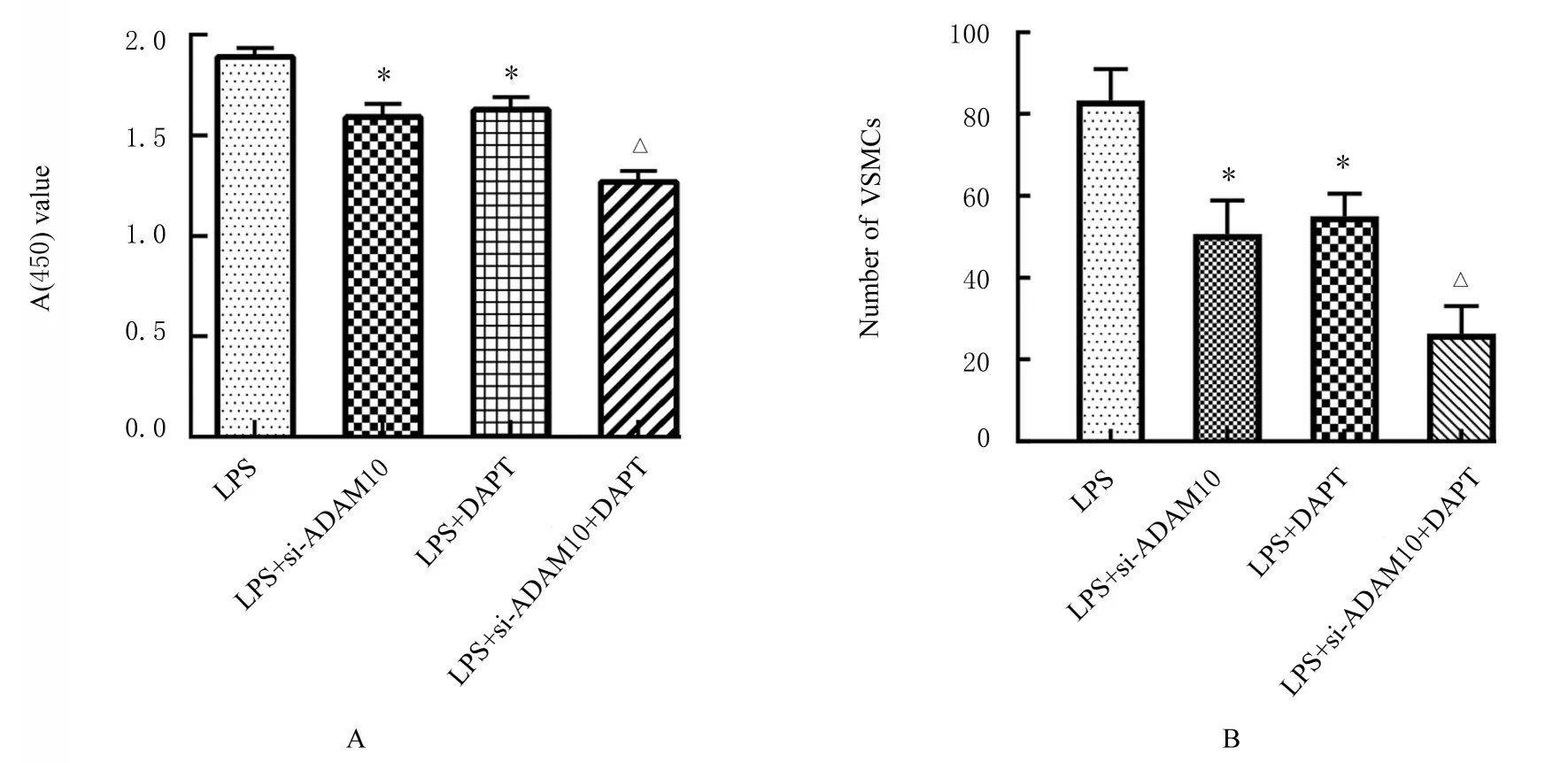
图8 各组VSMCs 增殖活性(A)和迁移细胞数(B)Fig.8 Proliferation activities(A) and migration numbers(B) of VSMCs in various groups

图9 各组VSMCs 迁移形态表现 (结晶紫,×200)Fig.9 Migration morphology of VSMCs in various groups (Crystal violet,×200)
2.7 抑制Notch 信号通路后各组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平与LPS 组 比 较,LPS+si-ADAM10 组 和LPS+DAPI 组 VSMCs 中 PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平均明显降低(P<0.05);与LPS+si-ADAM10 组比较,LPS+si-ADAM10+DAPT组VSMCs中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达水平均明显降低(P<0.05)。见图10。
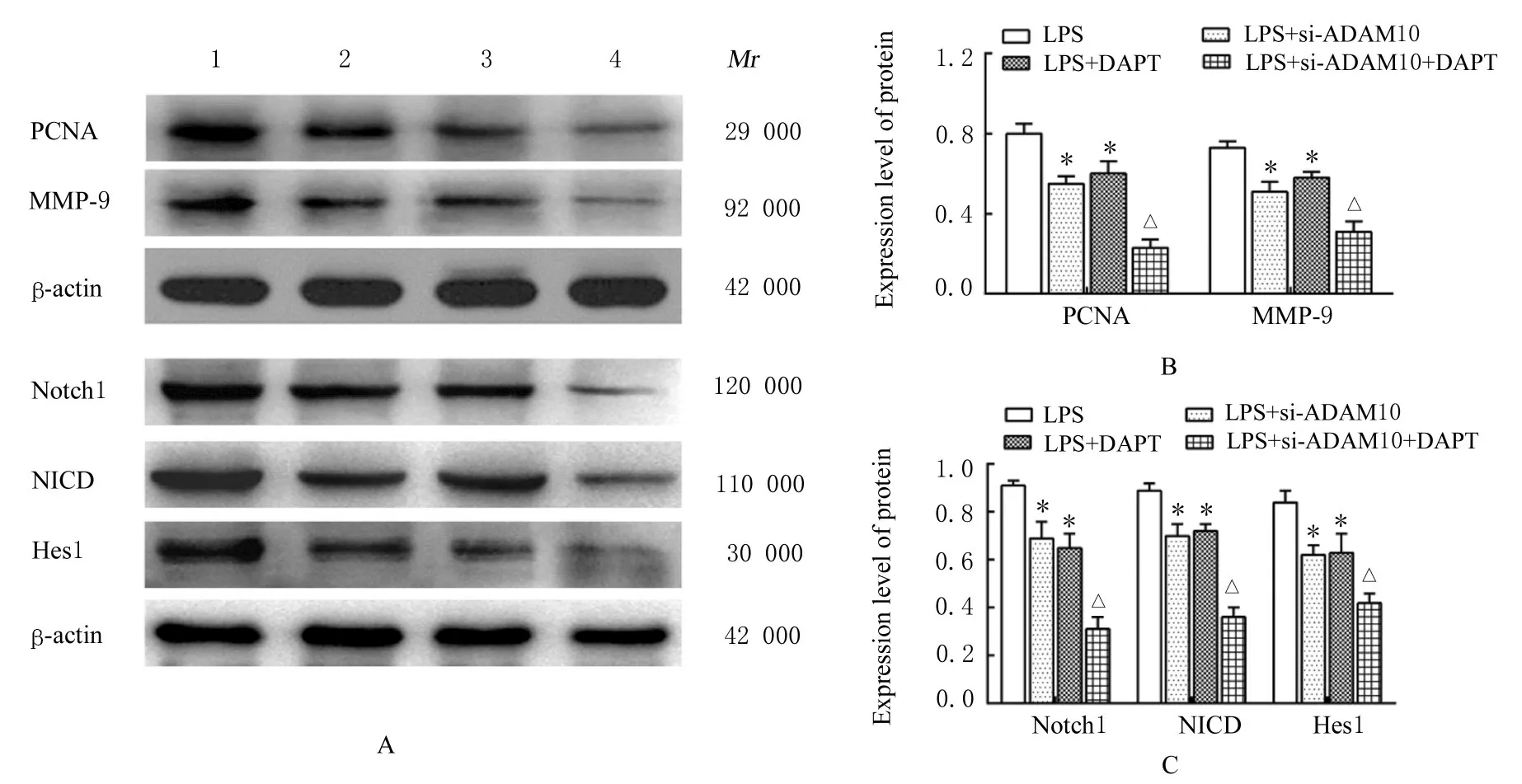
图10 各组VSMCs 中PCNA、MMP-9、Notch1、NICD 和Hes1 蛋白表达电泳图和直条图Fig.10 Electrophoregram and histograms of expressions of PCNA, MMP-9, Notch1, NICD, and Hes1 proteins in VSMCs in various groups
3 讨 论
AVF 是通过将血液透析患者上肢的动脉和浅静脉吻合来建立血液透析治疗的体外循环而产生的,这种人工制造的瘘管改变了浅静脉的血流和血流动力学,但仍有部分患者的长期通畅率较低。研究[10]显示:第1 年AVF 通畅率为62% ,第2 年为40%。多条相关信号通路参与新生内膜病理学过程,如炎症细胞浸润、AVF 手术损伤、尿毒症、缺氧和血流动力学[11-12],均能诱导平滑肌细胞、巨噬细胞和单核细胞迁移至血管内膜。在AVF 新生内膜增生的病理过程中,平滑肌细胞可分化为肌成纤维细胞,从中膜迁移到内膜并增殖,最终导致AVF 组织新生内膜增生、细胞外基质沉积、血管腔缩小和流出道阻塞[13]。因此,解决AVF 狭窄的复杂发病机制是AVF 成功的关键因素。
LPS 是革兰阴性细菌细胞壁外壁的组成成分,主要由脂质和多糖构成,是一种常见的内毒素,可以通过细胞信号转导系统激活单核巨噬细胞、内皮细胞和上皮细胞等,合成和释放多种细胞因子和炎性介质,进而引起机体的一系列反应[14]。因此,常利用LPS 进行炎症疾病相关的体外造模。ADAM10-Notch 信号通路在特殊血管结构发展中发 挥 关 键 作 用[15]。研 究[16]显 示:Notch 受 体 是 血管生成的关键调节因子,在小鼠胚胎和卵黄囊的血管生成和血管生成的早期阶段具有重要作用。冠状动脉支架内再狭窄猪模型中,冠状动脉血管内膜中ADAM10 蛋白较狭窄段表达量增多[17]。在狭窄冠状动脉内皮细胞中,ADAM10 蛋白表达异常升高[18]。上述研究均提示ADAM10 蛋白表达水平与冠状动脉再狭窄密切相关。本研究结果显示:ADAM10 在AVF 狭窄处血管组织中表达量高于AVF 非狭窄处和对照组。细胞实验结果表明:LPS 处 理24 h 后,VSMCs 增 殖 活 性、ADAM10 mRNA 和蛋白表达水平均升高,表明ADAM10 高表达与AVF 狭窄可能有关,与以往的研究结果[17-18]一致。
Notch 受体1-4 是膜锚定转录因子家族的一部分,通过膜锚定Notch 配体的结合被激活[19]。Notch 配体与Notch 受体的结合触发2 个高度协调的连续蛋白水解步骤,从其膜锚定蛋白中完成酶切过程,释放NICD,允许其进入细胞核并激活Notch 依赖的转录。第1 个蛋白水解过程依赖于膜锚定ADAM10[20],第2 个依赖于称为早老素/γ-分泌 酶 的 膜 内 蛋 白 酶[21]。γ-分 泌 酶 在 未 进 行ADAM10 预先处理的情况下无法切割细胞外膜旁结构域中的Notch,因此ADAM10 被认为是生理Notch 信 号 的 重 要 调 节 因 子。研 究[6]显 示:ADAM10 能通过水解Notch 蛋白膜外段受体,激活Notch 信号通路,而下调Notch 信号通路活性可抑制平滑肌细胞增殖,减少内膜增生[22]。结合前期研究[5-7,22]推测:ADAM10 过表达导致Notch 信号通路激活,炎症水平加剧,刺激血管平滑肌细胞增殖,促进内膜增生,这可能是引起动静脉内瘘狭窄的病理机制之一。本研究结果显示:沉默ADAM10 表达能有效抑制LPS 处理后VSMCs 细胞增殖活性、迁移和Notch 信号通路活性。Notch信号通路抑制剂DAPT 能逆转沉默ADAM10 对LPS 处理后VSMCs 细胞增殖活性、迁移和Notch信号通路活性的影响,说明沉默ADAM10 对AVF狭窄的作用可能与阻断Notch 信号通路有关。但本研究仅从VSMCs 增殖活性和细胞迁移2 个方面探讨沉默ADAM10 对LPS 处理后VSMCs 的影响,未涉及细胞凋亡等其他细胞行为或其他除Notch 外可能的信号通路。本课题组后续将从多方面深入探讨ADAM10 对AVF 狭窄的作用及其可能的分子机制,完善分子信号通路。
综上所述,ADAM10 在人AVF 狭窄处血管组织中高表达,沉默其基因表达可抑制LPS 诱导的VSMCs 细胞增殖和迁移,其作用机制可能与阻断Notch 信号通路有关。
