六价铬致肝脏损伤作用机制的生物信息学分析
2023-05-06诸葛瑞剑
王 睿, 章 鼎, 诸葛瑞剑, 薛 倩, 郭 丽
(1.吉林大学公共卫生学院卫生毒理学教研室,吉林 长春 130021;2.吉林大学中日联谊医院脊柱外科,吉林 长春 130033)
六价铬[hexavalent chromium,Cr(Ⅵ)]是环境中常见的重金属污染物,常以铬酸根离子的形式存在,具有较强的氧化活性和化学毒性[1]。在生产生活中,Cr(Ⅵ)可通过呼吸系统、消化系统和皮肤接触进入人体,对肝脏、肾脏、心脏和脾脏等器官造成急慢性损害[1-2]。Cr(Ⅵ)经口暴露后,在机体内发挥主要毒作用及生物代谢作用的靶器官是肝脏[1]。目前关于Cr(Ⅵ)致肝脏损伤的毒作用机制包括:① 经Cr(Ⅵ)暴露的肝组织中出现炎细胞浸润[3];② Cr(Ⅵ)会导致肝细胞内稳态失衡,引发氧化应激反应,还原过程中会产生过渡价态铬和活性氧(active oxygen,ROS)[4],还原产物还会与DNA 结合形成Cr-DNA 加合物[5],导致DNA 损伤或染色体畸变[6];③ Cr(Ⅵ)进入肝细胞会破坏线粒体膜结构,使线粒体功能受损,过量ROS 蓄积影响能量代谢诱导肝细胞凋亡[7];④Cr(Ⅵ)会引起肝细胞外钙离子内流,钙离子超载会影响细胞对损伤的敏感性,进一步导致细胞凋亡和坏死[8];⑤ 低浓度Cr(Ⅵ)暴露会引起肝细胞DNA 合成期阻滞,高浓度则会引起DNA 合成后期和分裂期阻滞[9];⑥ Cr(Ⅵ)也可以通过内质网应激途径诱导肝细胞凋亡[10]。但是Cr(Ⅵ)致肝脏损伤的毒作用机制尚未完全阐明。以往对于Cr(Ⅵ)致肝脏损伤机制的研究缺乏对生物信息学的整合和对关键通路的识别,且目前国内外也缺少生物信息学方面报道,全面系统地研究基因表达谱的变化有助于更好地阐明Cr(Ⅵ)致肝脏损伤的潜在分子机制。本研究利用基因表达综合(Gene Expression Omnibus,GEO)数 据 库[11]的 高 通 量测序数据 GSE65198,筛选差异表达基因(differentially expressed genes,DEGs),进行基因本体(Gene Ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析[12],构建蛋白-蛋白 互 作(protein-protein interaction,PPI)网 络,筛选hub 基因以及预测靶向药物分子,识别Cr(Ⅵ)致肝脏损伤的相关基因,为进一步探讨Cr(Ⅵ)致机体肝脏损伤的作用机制提供基础。
1 材料与方法
1.1 数据收集和标准化使用的分析数据来自GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)数据集GSE65198[13],种属为大鼠。数据集GSE65198 共有59 例样本,该原始数据已通过Partek GS 6.6 中的主成分分析检查了微阵列数据是否存在异常,并采用Robust Multi-Array Averaging 算法进行了背景调整、规范化和总结。选择其中20例样本分为2组,第1 组肝脏20 mg·kg-1Cr(Ⅵ)1 次暴露后1 d 和对照样本各5 例,第2 组肝脏20 mg·kg-1Cr(Ⅵ)1 次暴露后7 d 与对照样本各5 例。
1.2 DEGs 的识别和分析将每组中的对照样本作为阴性对照组,暴露样本为实验组,采用R 语言(version 4.0.2)中 的limma 包(version 3.44.3)进行差异分析,贝叶斯方法建立线性模型,采用t检验和方差分析进行统计学分析,以P<0.05 为差异有统计学意义,Benjamini-Hochberg 矫正错误发现率(false discovery rate,FDR)值与P值,差异倍数(fold change,FC)经log 转换后得到。筛选出每组的DEGs,显著性阈值为|log2FC|>1且P<0.05。再利用R 语言的pheatmap (version 1.0.12)和ggplot2(version 3.3.2)包分析DEGs并可视化,绘制热图和火山图。
1.3 富集分析将获得的暴露后1 d 组和 7 d 组的DEGs 上 传 至 DAVID 2021 (https://david.ncifcrf.gov/ home.jsp)进行GO 富集分析和KEGG信号通路富集分析。Fisher精确概率法检验得出P值,以P<0.05 为差异有统计学意义。
1.4 PPI 网络构建和hub 基因筛选在STRING 11.5(https://cn.string-db.org/)[14]中分别构建暴露后1 d 组、7 d 组和暴露后1 d 组及7 d 组均表达的DEGs 的PPI 网络图,设置置信度为0.400 进行筛选,以P<0.05 为差异有统计学意义。采用Cytoscape(version 3.9.1)软件进行可视化,通过Cytoscape 中的Cytohubba 插件对PPI 网络中DEGs进行评分,其中每组degree 值前5 位DEGs 被认为是参与Cr(Ⅵ)所致肝脏损伤的hub 基因。
1.5 预测与DEGs 相关的靶向药物基于获得的hub 基因和7 d 后依旧表达的DEGs,通过Enrichr网 站[15](https://maayanlab.cloud/ Enrichr/#)采用药物特征数据库DSigDB 预测靶向药物分子。潜在的治疗药物由调整P值和作用于DEGs 的丰度所确定。
2 结 果
2.1 DEGs 识别对数据集GSE65198 分析后,暴露后1 d 组有342 个DEGs,与对照组比较,暴露组包括202 个上调基因和140个下调基因;暴露后7 d组有61 个DEGs,与 对 照 组 比 较,暴 露 组 包 括41 个 上 调 基 因 和20 个 下 调 基 因(|log2FC|>1 且P<0.05)。图1 A 和1B 分别为1 次暴露后1 d 组 和1 次暴露后7 d 组DEGs 的热图,图1C 和1D 分别是1 次暴露后1 d 组和1 次暴露后7 d 组DEGs 的火山图。其中天冬酰胺合成酶(asparagine synthetase,ASNS)、细胞周期蛋白B2(cyclin B2,CCNB2)、细胞分裂周期20(cell division cycle 20,CDC20)、细胞周期蛋白依赖性激酶抑制剂3 (cyclin dependent kinase inhibitor 3,CDKN3)、CXC 基 序趋化因子配体(C-X-Cmotif chemokine ligand 1,CXCL1)、脂肪酸结合蛋白4 (fatty acid binding protein 4,FABP4)、动 粒 定 位Astrin 结 合 蛋 白(kinetochore localized Astrin binding protein,KNSTRN)、LOC100912602、金 属 硫 蛋 白2A(metallothionein 2A,MT2A)、PQ 循环重复包含蛋 白 3 (PQ cycle repeats contain protein 3,PQLC3)、RT1 Ib 类 基因座EC2(RT1-EC2)和生长抑素受体3(somatostatin receptor 3,SSTR3)是2 组中均存在DEGs,共同影响糖皮质激素反应的生物学过程,均参与了卵母细胞减数分裂和细胞周期的信号通路。
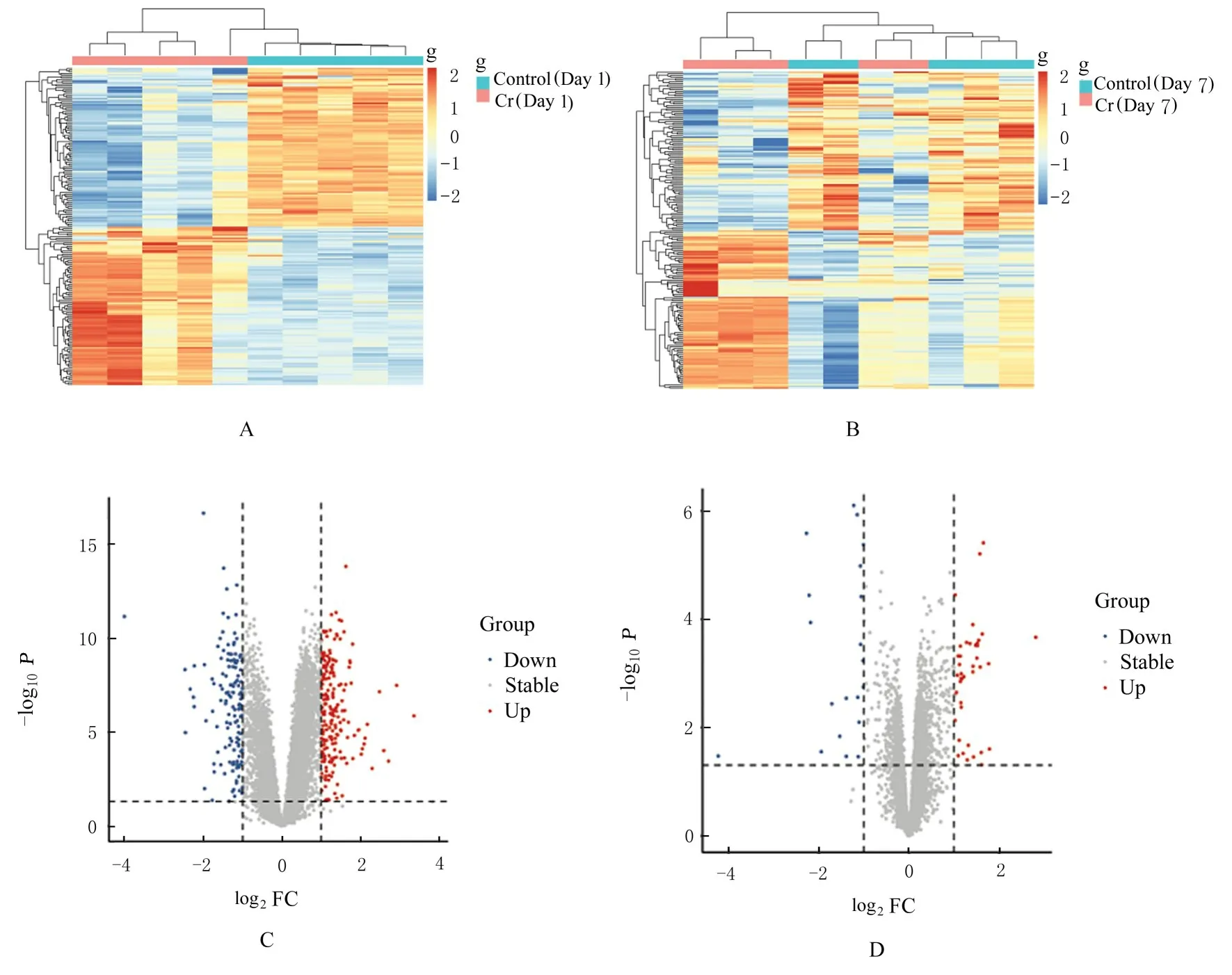
图1 Cr(Ⅵ)1 次暴露后1 d 组和7 d 组DEGs 的热图(A,B)和火山图(C,D)Fig.1 Cluster heatmaps(A,B) and volcanic maps(C,D) of DEGs in 1 d and 7 d after single exposure to Cr (Ⅵ) groups
2.2 GO 富集分析和KEGG 通路分析对DEGs进行GO 富集分析,GO 包括生物过程、分子功能和细胞成分3个注释内容。Cr(Ⅵ)1次暴露后1 d组DEGs 最显著的生物学过程包括药品反应、异种生物刺激反应和衰老等;Cr(Ⅵ)1 次暴露后7 d 组最显著的生物学过程包括有丝细胞分裂、有丝分裂纺锤体中间区组合和细胞分裂的正向调节等。KEGG 通路分析结果显示:Cr(Ⅵ)1次暴露后1 d 组DEGs 参与了代谢、真核生物中的核糖体生物发生、细胞色素P450 对异生素的代谢、甘氨酸、丝氨酸和苏氨酸代谢及过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)信号通路等信号通路;Cr(Ⅵ)1 次暴露后7 d 组DEGs 参与了孕酮介导的卵母细胞成熟、细胞周期调节、细胞衰老、卵母细胞减数分裂和p53 信号通路等信号通路。
2.3 PPI 网络构建和hub 基因筛选基于STRING 数据库分析DEGs 的PPI 关系,得到暴露后1 d 组共包含276 个节点和2 470 条关系,暴露后7 d组共包含43个节点和532条关系,见图2A 和2B。通过Cytoscape 中的Cytohubba 插件进行拓扑学分析筛选hub 基因,按照degree 值排序,暴露后1 d 组degree 值前5 位的 hub 基因分别为EBNA1 结合蛋白2(EBNA1 binding protein 2,EBNA1BP2)、核仁蛋白58 (nucleolar protein 58,NOP58)、鸟嘌呤核苷酸结合蛋白样3 (guanine nucleotide binding protein like 3,GNL3)、核 仁 蛋 白56(nucleolar protein 56,NOP56)和WD 重 复 域12(WD repeat domain 12 ,WDR12),暴露后7 d 组degree 值前5 位的hub 基因分别为CCNB2、细胞周期蛋白A2(cyclin A2,CCNA2)、细胞周期蛋白B1(cyclin B1,CCNB1)、细胞周期蛋白依赖性激酶1(cyclin dependent kinase 1,CDK1)和驱动蛋白家族成员20B (kinesin family member 20B,KIF20B),其PPI 网 络 见 图2 C 和2D。ASNS、CCNB2、CDC20、CDKN3、CXCL1、FABP4、KNSTRN、LOC100912602、MT2A、PQLC3、RT1-EC2 和SSTR3 是暴露后1 d 组和7 d 组中均存在的DEGs。通过String 分析PPI 网络关系,其中CDC20、KNSTRN、CDKN3 和CCNB2 (在PPI网络中标识符:ENSRNOP00000017117)在网络中心有多个连接节点,包含4 个节点和6 条边。导入Cytoscape 软件对PPI 网络图可视化,见图2 E。
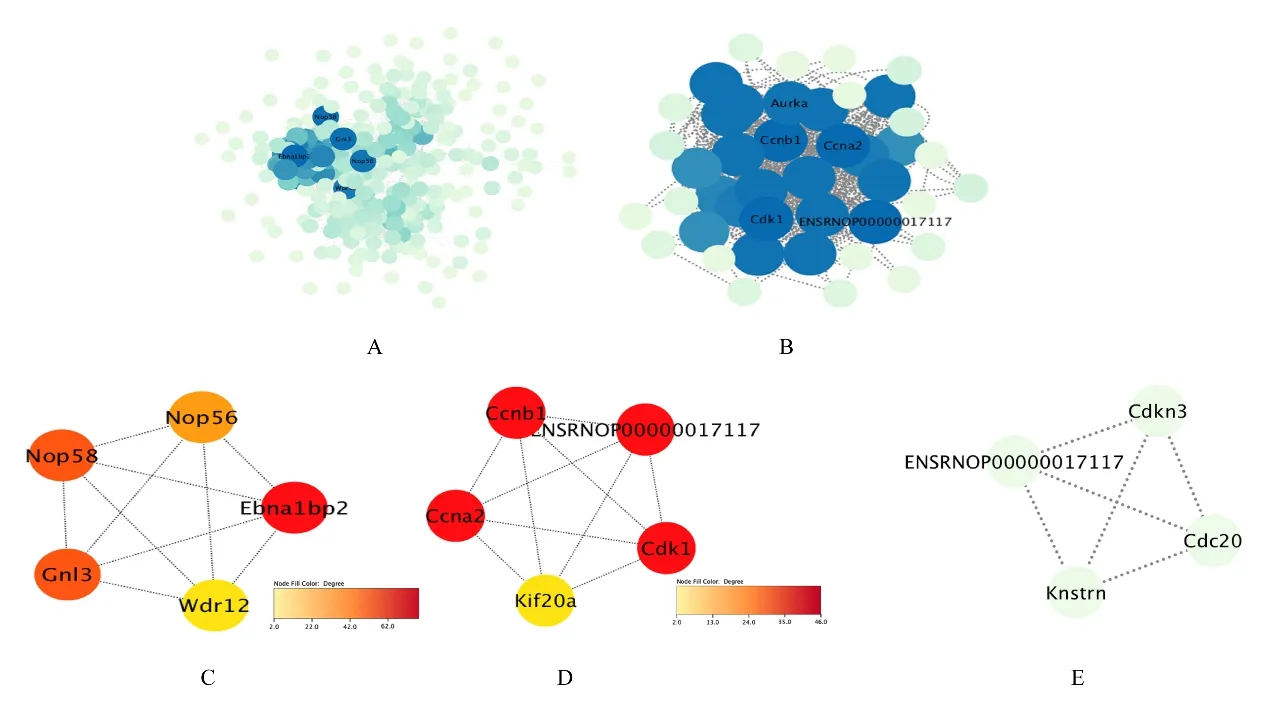
图2 Cr(Ⅵ)1 次暴露后1 d 和7 d 组DEGs 及hub 基因的PPI 网络图Fig.2 PPI network diagram of DEGs and hub genes in 1 d and 7 d after single exposure to Cr(Ⅵ) groups
2.4 预测与DEGs 相关的靶向药物通过Enrichr平台分析,根据调整P值预测,与已被筛选出的hub 基因和1 d 及7 d 均表达的DEGs 相关的前10 种潜在靶向药物见表1。
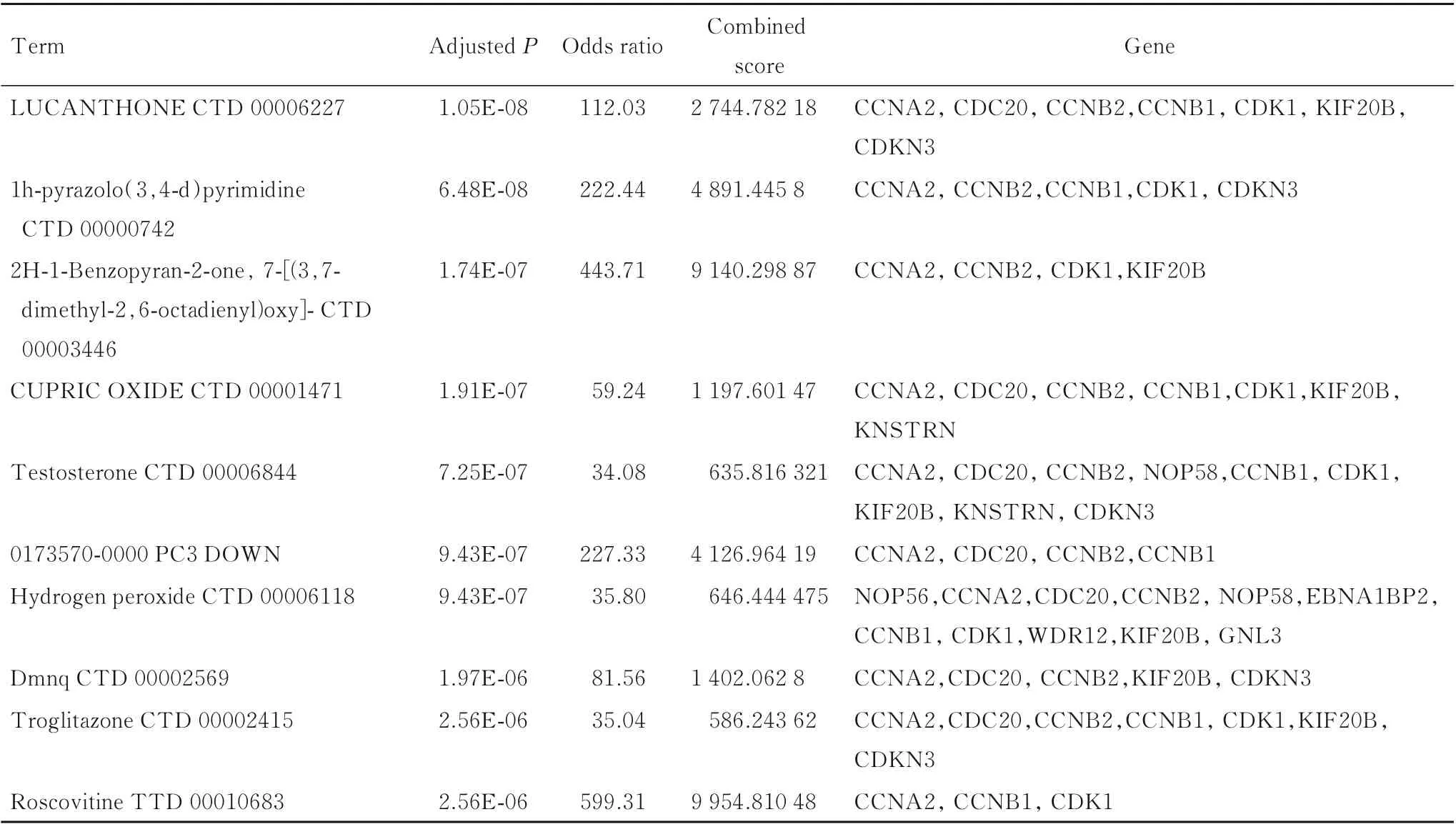
表1 与已被筛选出的13 个Cr(Ⅵ)致肝脏损伤DEGs 相关的前10 种潜在靶向药物Tab.1 Top 10 potential target drugs related to thirteen selected DEGs of liver injury induced by Cr (Ⅵ)
3 讨 论
作为被公认的人类致癌物,Cr(Ⅵ)对机体产生损害毒性效应是一个非常复杂的过程。本研究共筛选出403 个DEGs,其中20 mg·kg-1Cr(Ⅵ)肝脏暴露后1 d 在实验组和对照组之间共识别出342 个DEGs,20 mg·kg-1Cr(Ⅵ)肝脏暴露后7 d共识别出61 个DEGs。对DEGs 构建的PPI 网络分析后,EBNA1BP2、NOP58 和GNL3 等基因被筛选为20 mg·kg-1Cr(Ⅵ)肝脏暴露后1 d 肝脏的hub 基 因,CCNB2、CCNA2 和CCNB1 等 基 因 被 筛选为20 mg·kg-1Cr(Ⅵ)肝脏暴露后7 d 的hub 基因。而20 mg·kg-1Cr(Ⅵ)肝脏暴露7 d 后均表达的DEGs 并且在PPI 网络中有多个连接节点的基因分 别 为CDC20、KNSTRN、CDKN3 和CCNB2。上述基因在Cr(Ⅵ)致肝脏损伤的发生发展过程中可能发挥重要作用,GO 富集分析结果显示:上述基因主要在有丝分裂细胞周期相变、细胞分裂、线粒体ATP 合成的正调控耦合电子传递和参与卵母细胞成熟的减数分裂细胞周期等生物过程中起重要作用;KEGG 通路分析结果显示:上述基因与细胞周期、孕酮介导的卵母细胞成熟和卵母细胞减数分裂和细胞衰老p53 信号通路等有密切联系。Hub基因和DEGs 所涉及的生物学过程均与细胞周期有密切关联,KEGG 通路分析也验证了该结果。研究[9]表明:低剂量Cr(Ⅵ)暴露会导致L-02 细胞S 期停止,而更高剂量的Cr(Ⅵ)暴露会导致细胞G2/M 期停止。在Cr(Ⅵ)暴露后,p53 通过调节S 期检查点蛋白复制检查点介体1 (mediator of replication checkpoint 1,Mrc1)和有丝分裂检查点蛋白苯并咪唑出芽抑制解除同源物相关蛋白1(budding uninhibited by benzimidazoles related 1,BubR1)导致L-02 肝细胞的S 期或G2期停止。
基因表达概况也可以为潜在的早期基因生物标志物和Cr(Ⅵ)暴露致肝脏损伤的毒作用机制提供理论依据。本研究所得出的hub 基因和暴露7 d后均表达的DEGs 显示:Cr (Ⅵ)致肝脏损伤关键可能是细胞周期调节相关基因。EBNA1BP2 是一种蛋白质编码基因,研究[16]显示:在二乙基亚硝胺诱发大鼠肝癌过程中,EBNA1BP2 表达量不断增加,在诱癌后期其表达量会明显升高。NOP56 蛋白是与致癌基因表达密切关联的核仁蛋白[17],NOP58 蛋 白 与NOP56 蛋 白 高 度 同 源[18]。研究[19]表明:肝癌中的致癌基因长链非编码RNA FAM83A-AS1 通过与 NOP58 结合以增强FAM83A mRNA 的稳定性,促进肝癌发展。GNL3 是MMR1/ HSRICTP 结合蛋白家族的成员,GNL3 通过SIRT1 介导肝癌干细胞样特性,促进肝癌细胞的恶性生物学行为[20]。WDR12 是以色氨酸-天冬氨酸重复序列结尾的蛋白家族成员,在细胞分裂增殖、细胞周期调控和核糖体生物发生等生物学过程中发挥重要作用[21]。CCNB1、CCNB2、CCNA2、CDK1、CDC20 和CDKN3 均为细胞周期蛋白家族成员。CCNB1 在许多癌症中均有明显的高表达[22],肝癌组织中CCNB1 的上调提示肝癌患者的总生存期和无病生存期更差[23]。敲除CCNB2 可抑制体内肝癌细胞的增殖,CCNB2 可能通过增加JAG1 的表达来促进肝癌细胞的增殖和转移[24]。CCNA2 是细胞周期的关键调节因子,从S 期到有丝分裂早期高表达,并与肿瘤发生有关,CCNA2-细胞周期蛋白依赖性激酶复合物驱动染色体复制,随后促进有丝分裂[25]。CDK1 是哺乳动物细胞增殖的必需基因,可与CCNB 组成复合物有丝分裂促进因子,使细胞周期从G2期加快进入M 期,CDK1 失活会导致染色体破裂和细胞死亡[26]。CDC20 能促进肿瘤发生,抑制CDC20 表达能加快调节细胞分裂周期和细胞凋亡[27],其在染色体分离和有丝分裂中发挥重要作用[28]。免疫组织化学检测结果[29]表明:在132 个匹配的肝癌组织中,68.18% 肝癌样本中检测到CDC20 蛋白高表达。CDKN3 可促进很多肿瘤的发生[30],抑制CDKN3可以提高肝癌细胞存活[31]。KIF20B 属于驱动蛋白家族,是一种在M 期特异性磷酸化的微管相关蛋白,在胞质分裂中起关键作用[32]。通过将微管相关药剂与KIF20B 抑制相结合,抑制了肝癌细胞的中期和末期双重有丝分裂[33]。KNSTRN 是有丝分裂纺锤体的重要组成部分,通过激活AKT 磷酸化促进肿瘤发生[34]。
通过Enrichr 平台的DSigDB 数据库,确定了与hub 基因和20 mg·kg-1Cr(Ⅵ)暴露7 d 后均表达的DEGs 相关的药物分子,按P值大小进行了相关度排序。硫蒽酮、1H-吡唑[3,4-d]嘧啶、2H-1-苯并吡喃-2-酮,7-[(3,7-二甲基-2,6-辛二烯基)氧基、氧化铜、睾酮、0173570-0000、过氧化氢、2,3-二甲氧基-1,4-萘醌、曲格列酮和罗斯科维汀是与Cr(Ⅵ)致肝脏损伤相关的潜在治疗药物。其中罗斯科维汀是一种周期蛋白依赖性抑制剂,已被证实对急性和慢性肝脏炎症以及纤维化有治疗作用。研究[35]显示:罗斯科维汀给药明显减轻肝损伤,其通过抑制巨噬细胞炎症作用和HSC激活预防肝脏疾病,并能减少肝纤维化。其他预测药物的治疗作用仍需进一步的临床试验验证。
综上所述,本研究通过生物信息学较全面系统地探讨了基因表达谱的变化以及关键通路的识别,探究了Cr(Ⅵ)暴露后肝脏损伤的潜在分子机制和生物标志物,为Cr(Ⅵ)毒性效应的研究提供了信息,但仍需要通过人群或试验进行验证。
