膜穿孔蛋白E 在上皮性卵巢癌组织中的表达水平及其临床意义
2023-05-06陈猛猛陈俊宇房正轩赵淑华郑晶莹刘淑香
陈猛猛, 陈俊宇, 高 燕, 房正轩, 赵淑华, 郑晶莹, 刘淑香
(1.吉林大学护理学院康复治疗学教研室,吉林 长春 130021;2.吉林大学第二医院妇产科,吉林 长春 130021;3.延边大学药学院药剂学教研室,吉林 延吉 133002)
卵巢癌是致死率最高的妇科肿瘤之一,其中上 皮性卵巢癌(epithelial ovarian cancer,EOC)占所有卵巢癌的80%~90%[1-2]。目前,EOC 的标准治疗是肿瘤细胞减灭术联合以铂类为基础的化疗,但患者的5 年生存期仅为46%[3]。肿瘤的耐药及复发是 EOC 病死率高的主要原因,此过程涉及多基因的变化[4]。研究[5-10]显示:消皮素家族基因表达与泛癌的肿瘤免疫及癌症药物敏感性有关,特别是膜穿孔蛋白E(gasdermin E,GSDME)的活化能够抑制多种肿瘤细胞集落形成和增殖。作为细胞焦亡的最终执行蛋白,GSDME 的表达可能与EOC的发生发展有关,但其表达水平对 EOC 临床进展影响的研究尚未见相关报道。本研究利用生物信息学数据分析、免疫组织化学(immunohistochemistry,IHC)染色和Western blotting 法等方法,探讨GSDME 在EOC 组织中的表达,分析GSDME 在EOC 发生发展过程中的作用,以期对EOC 临床治疗提供潜在的分子靶点。
1 材料与方法
1.1 生物信息学数据库EOC 中GSDME 的差异表 达 数 据 是 来 自 UCSC Xena (https://xenabrowser.net/datapages/)经Toil 流程统一处理的肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)和 基 因 型- 组 织 表(Genotype-Tissue Expression,GTEx)的TPM 格 式RNAseq 数 据。共对515 例非配对样本进行了差异表达分析,其中包含88 例来自GTEx 数据库的正常卵巢样本,427 例 来 自TCGA (https://portal.gdc.cancer.gov/)的肿瘤样本。所有的统计分析与可视化均使用R(3.6.3 版本)完成。
1.2 EOC 组织中GSDME 基因表达谱差异分析采用Mann-WhitneyU检验(Wilcoxon rank sum test)对EOC 组织中GSDME 基因的表达谱进行差异分析。采用Shapiro-Wilk normality test 对非配对样本中GSDME 的表达数据进行正态性检验,并使用两独立样本t检验对非配对样本中的数据进行差异分析。分析结果采用ggplot2 [3.3.3 版本]进行可视化,且认为当P<0.05 时差异有统计学意义。
1.3 EOC 组织中GSDME 单基因差异分析及相关性分析使用Stat 包(3.6.3 版本)对TPM 格式的表达谱数据进行单基因相关性分析,目标分子为GSDME。将阈值设置为Log2差异倍数(fold change,FC)的绝对值|log2(FC)|>1 且满足P<0.05,筛选差异表达基因(differentially expressed genes,DEGs),利用ggplot2 包(3.3.3 版本)绘制火山图。将DEGs 输入STRING 数据库,利用Cytoscape 软件进行DEGs 的蛋白- 蛋白互作(protein-protein interaction,PPI)网络分析,并使用MCODE 插件确定HUB 基因。
1.4 EOC 组织中GSDME 基因富集分析利用单基因差异分析结果,使用ClusterProfiler 包(3.14.3 版本)进行基因本体论(Gene Ontology,GO)分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析和基因集富集分析(Gene Set Enrichment Analysis,GSEA)。使 用 org.Hs.eg.db 包(3.10.0 版本)进行基因ID 转换;使用GOplot 包(1.0.2 版本)计算Zscore 并对EOC 与富集通路的相关性进行评分,如果结果满足错误发现率(false discovery rate,FDR)<0.25 且P<0.05 条件就为显著富集。以上结果的可视化使用ggplot2(3.3.3版本)完成。
1.5 EOC 组织中GSDME 免疫浸润分析使用GSVA 包(1.34.0 版本)对免疫细胞的相对浸润水平进行分析,免疫浸润的算法使用ssGSEA,采用Spearman 相关性分析。根据GSDME 的表达水平,将样本分为低表达组和高表达组,计算在不同的分组中各种免疫细胞浸润的富集得分。最后利用相对浸润水平具有显著统计学意义的免疫细胞(P<0.001)绘制棒棒糖图,统计分析与可视化通过circlize 包(0.4.12 版本)完成。
1.6 临床资料本研究经吉林大学第二医院病案室和吉林大学第二医院伦理委员会批准(伦理批号:2018106),查 阅 并 收 集2015 年1 月1 日—2019 年8 月31 日于吉林大学第二医院妇科住院接受手术治疗的所有卵巢癌患者资料,记录EOC 患者的发病年龄、组织学分型、病理分级、肿瘤大小和肿瘤分期等临床特征。纳入标准:①病理学诊断为EOC;②初次诊断且首次治疗方式为早期全面分期手术或肿瘤细胞减灭术;③术后接受以铂类为基础的规范化疗;④有完整的随访资料。排除标准:①既往有其他恶性肿瘤病史;②卵巢转移癌。选取符合纳入标准的 EOC 患者共40 例,收集相对应的病理切片标本。患者年龄为34~77 岁,中位发病年龄53 岁,其中<53 岁者 17 例,≥53 岁者23 例。EOC 组织学分类参照WHO 卵巢癌分类标准,包括浆液性癌25 例、黏液性癌5 例、子宫内膜样癌6 例、透明细胞癌2 例和浆黏液性癌2 例;其中高级别(低分化)组16 例,低级别(中分化及高分化)组24 例。根据FIGO 分期标准进行肿瘤临床分期,其中Ⅰ-Ⅱ期19 例,Ⅲ-Ⅳ期21 例。纳入的患者中对顺铂耐药者(含铂化疗后6 个月内出现疾病复发或进展)有18 例,占总样本量45%。另收集正常卵巢、良性卵巢瘤和交界性卵巢癌病理切片各5 例作为对照。收集EOC 患者新鲜冰冻癌组织和癌旁组织10 对。所有患者均同意参与本研究,并签订知情同意书。
1.7 细胞、主要试剂和仪器卵巢癌Skov3 细胞亲本株及顺铂(cisplatin,DDP)耐药株Skov3/DDP获赠于中国科学院长春应用化学研究所。免疫组织化学染色试剂盒(货号:G1215-200T,武汉塞维尔生物科技有限公司),兔抗人-DFNA5(GSDME)多克隆抗体(货号:bs-14286R,北京博奥森生物技术有限公司),BCA 蛋白定量试剂盒(货号:P0010S,上海碧云天生物技术公司),GAPDH (货号:AF7021)和山羊抗兔二抗(货号:S0001)(江苏亲科生物研究中心有限公司)。5300 一体式化学发光成像系统(型号:610T002-7Q,上海勤翔科学仪器有限公司),微量高速冷冻离心机(型号:HR/T16MM,湖南赫西仪器装备有限公司),酶标分析仪(型号:HBS-1096A,南京德铁生物科技有限公司)。
1.8 细胞培养及样本收集37 ℃、5% CO2孵箱内体外培养Skov3 和Skov3/DDP 细胞,培养基为90% 高 糖DMEM + 10% 胎 牛 血 清 + 1% 双 抗(青霉素+链霉素),当细胞贴壁生长达到 90%时,进行细胞传代培养。细胞传至第3 代时,弃去皿中培养基并用PBS 缓冲液洗涤,然后用胰酶消化使细胞脱离贴壁状态,收集细胞用于后续检测。
1.9 IHC 法检测EOC 组织中GSDME 表达强度
按照IHC 染色试剂盒使用说明,将GSDME 抗体(1∶200)与收集到组织病理切片进行共孵育并染色。在显微镜下观察组织切片的染色情况。每张切片随机挑选5 个视野(×100),根据阳性细胞染色的强度及随机视野中阳性细胞数所占总细胞数的百分比2 项指标进行综合评分,代表GSDME 表达强度。IHC 阳性细胞染色程度:无色记为0 分,淡黄色记为1 分,棕黄色记为2 分,棕褐色记为3 分;阳性细胞数百分比:<5%记为0 分,5%~24%记为1 分,25%~49%记为2 分,50%~74% 记 为3 分,75%~100%记为4 分。最终2 项评分乘积≤4 分为阴性表达,>4 分为阳性表达。以上所有结果由2 位病理科医师计算所得。
1.10 Western blotting 法检测EOC 组织和癌旁组织及细胞中GSDME蛋白表达水平采用含有蛋白酶抑制剂的 RIPA 裂解缓冲液裂解收集的组织和细胞样本,充分裂解并离心后收集蛋白上清液,通过BCA 蛋白试剂盒定量。将与Loading 混合后的蛋白质悬液(约含蛋白质20 μg)加载到SDS-PAGE凝胶上进行电泳,然后转移至PVDF 膜上。室温下,PVDF 膜在5%非脂肪牛乳中封闭2 h,加入GSDME(1∶1 000)和GAPDH (1∶10 000)一抗,在4℃环境下过夜。第2 天用TBST 洗涤,将膜与二抗(1∶20 000)在室温避光环境下孵育2h,然后加底物发光并使用上海勤翔凝胶成像及分析系统进行成像及定量分析。
1.11 统计学分析采用 R 3.6.3 统计软件进行统计学分析,绘图使用 Graphpad prism 5 软件。IHC和Western blotting 的量化结果符合正态分布且方差齐性,2 组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析。临床病例信息分类以百分比(%)表示,采用χ2检验分析GSDME 表达强度与EOC 患者临床参数的关系。以P<0.05 为差异有统计学意义。
2 结 果
2.1 EOC 组织中GSDME 差异表达在EOC 中,GSDME 的差异表达分析结果见图1A。与正常卵巢组织比较,EOC 组织中GSDME mRNA 表达水平明显降低(P<0.05)。临床相关性分析显示:与Ⅰ-Ⅱ期比较,Ⅲ-Ⅳ期EOC 组织中GSDME mRNA 表达水平差异无统计学意义(P>0.05,见图1B);与G1-G2 期比较,G3-G4 期EOC 组织中GSDME mRNA 表达水平明显降低(P<0.05,见图1C)。
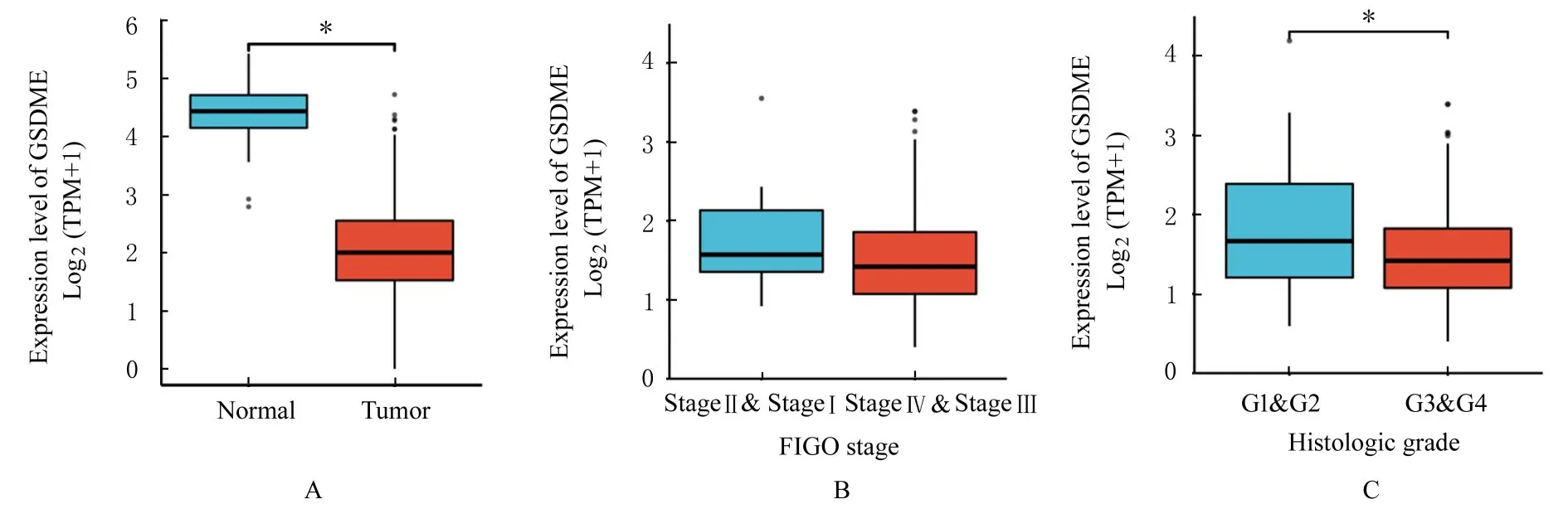
图1 GSDME 相关差异基因表达图Fig.1 Diagrams of GSDME-related differential genes expression
2.2 EOC 组织中GSDME 单基因差异及相关基因对EOC 组织中GSDME 进行单基因差异分析,结果见图2,满足|log2FC)>1 且满足P<0.05 阈值的基因789 个。在该阈值下,高表达(log2FC 为正值)基因460 个,低表达(log2FC 为负值)基因329 个。利用789 个DEGs 构建PPI 网络图(图3),互作频率最高的基因有纤连蛋白1(fibronectin 1,FN1)、催乳素诱导蛋白(prolactin induced protein,PIP)、分泌珠蛋白家族2A 成员1 (secretoglobin family 2A member 1,SCGB2A1)、成纤维细胞生长因子10(fibroblast growth factor 10,FGF10)和神经生长因子受体(nerve growth factor receptor,NGFR)等。基 于PPI 网 络 分 析 结 果,使 用MCODE 插件确定了8 个HUB 基因,分别是钾电压门控通道亚家族A 成员1 (potassium voltagegated channel subfamily a member 1,KCNA1)、钙电压门控通道亚单位α1c (calcium voltage-gated channel subunit alpha1 C,CACNA1C)、钙电压门控通道辅助亚单位γ2 (calcium voltage-gated channel auxiliary subunit gamma 2,CACNG2)、阳离子通道精子相关辅助亚单位δ (cation channel sperm associated auxiliary subunit delta,CATSPERD)、钙 电 压 门 控 通 道 亚 单 位α1g(calcium voltage-gated channel subunit alpha1 G,CACNA1G)、钠电压门控通道α 亚单位1(sodium voltage-gated channel alpha subunit 1,SCN1A)、钠通 道 上 皮1 亚 单 位β (sodium channel epithelial 1 subunit beta,SCNN1B)和钙电压门控通道亚单位α1I (calcium voltage-gated channel subunit alpha1 I,CACNA1I)(图2)。
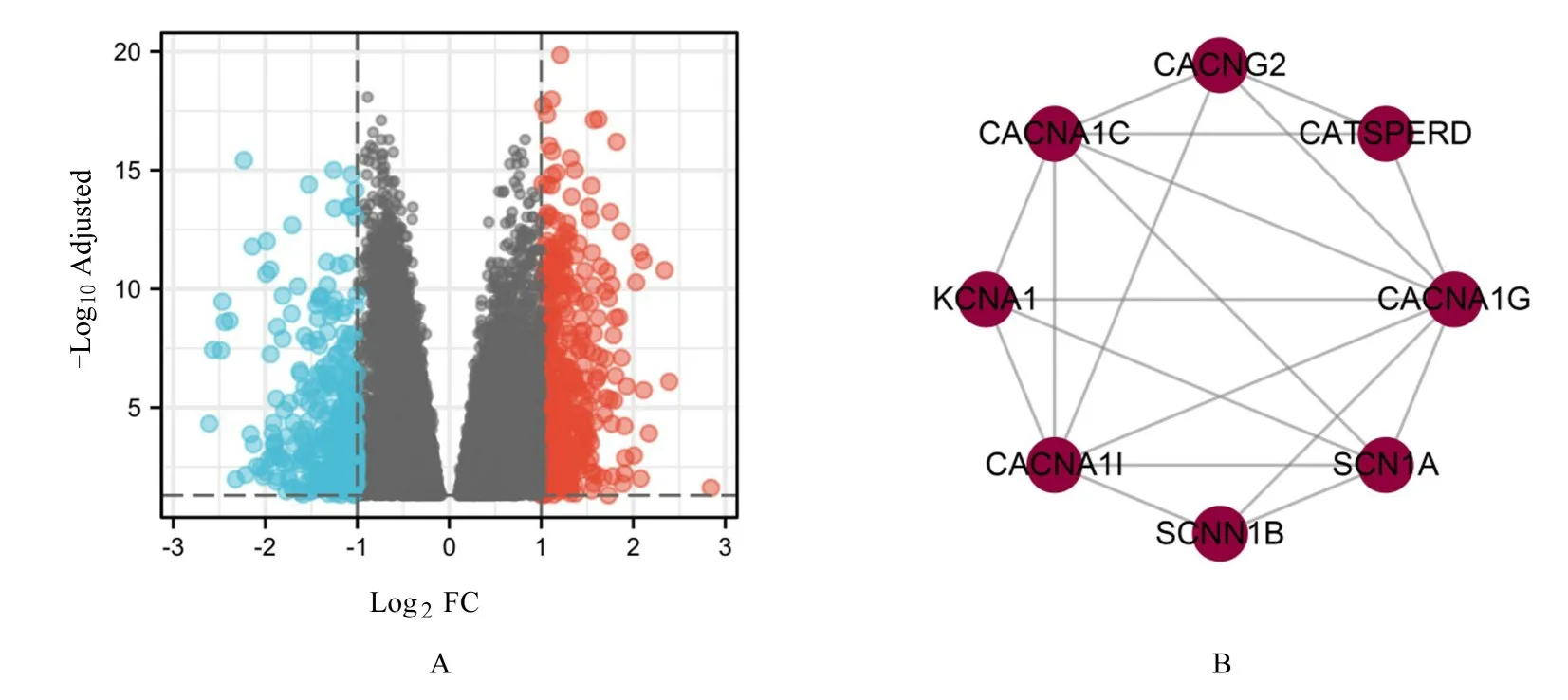
图2 GSDME 单差异基因分析所得火山图(A)和HUB 基因互作网络图(B)Fig.2 Volcano plot diagram(A) and HUB gene interaction network diagram(B) obtained by GSDME single differential gene analysis

图3 GSDME 相关差异基因构成的PPI 网络图Fig.3 PPI interaction network diagram of GSDME-related differential genes
2.3 EOC 组织中GSDME 功能富集和免疫浸润情况对GSDME 进行功能富集分析,结果见图4。图4 为GSEA 可视化结果,统计分析结果表明:GSDME 与细胞因子及其受体互作、免疫调节及反应和G 蛋白偶联受体(G protein-coupled receptors,GPCR)细胞质核糖体蛋白合成等通路及功能呈正相关关系,而与线粒体中电子传递系统、反应体mRNA 合成和robo 受体反应组信号传导相关通路呈负相关关系(表1 和2)。GO 和KEGG 富集分析结果显示:GSDME 与免疫相关通路的活化(循环免疫球蛋白介导的体液免疫反应通路、补体激活通路和白细胞迁移通路)及mRNA 剪接位点的选择和识别等有关(表3 和图5A)。
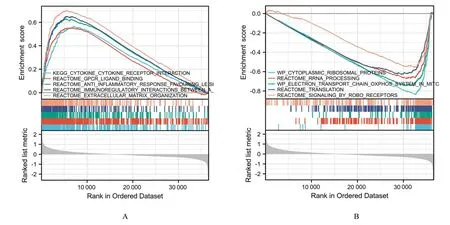
图4 EOC 组织中GSDME 的GSEA 通路富集图Fig.4 GSEA pathway enrichment diagram of GSDME in EOC tissue

表1 与GSDME 表达呈正相关关系的GSEA 基因集Tab.1 GSEA gene sets positively correlated with GSDME expression

表2 与GSDME 表达呈负相关关系的GSEA 基因集Tab.2 GSEA gene sets negatively correlated with GSDME expression

表3 GO/KEGG 富集分析结果Tab.3 Results of GO/KEGG enrichment analysis
免疫浸润分析显示:EOC 组织中GSDME 的表达与18 种免疫细胞的肿瘤浸润呈正相关关系,包括巨噬细胞、效应记忆型T 细胞、嗜酸性粒细胞、自然杀伤(natural killer,NK)细胞、中性粒细胞和记忆型T 细胞等;与4 种免疫细胞浸润呈负相关关系(图5B)。
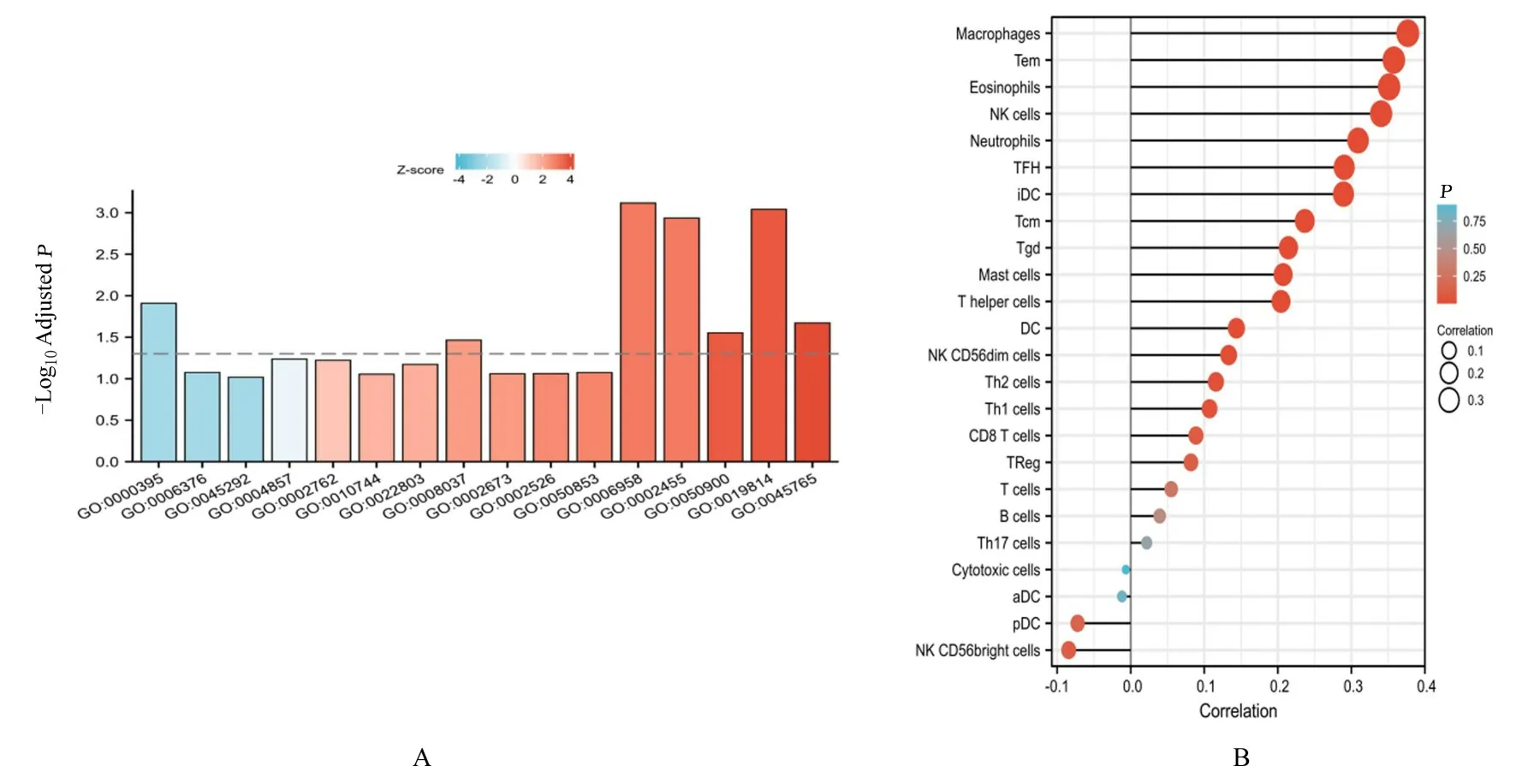
图5 EOC 组织中GSDME 的GO/KEGG 富集分析图(A)和免疫浸润分析图(B)Fig.5 GO/KEGG enrichment analysis diagram(A) and immune infiltration analysis diagram(B) of GSDME in EOC tissue
2.4 GSDME 与相关通路标志物的关系GSDME的表达水平与淋巴细胞活化相关蛋白5(kelch like family member 5,KLHL5)、CD4、CD80 和CD86等免疫标志物分子的表达水平呈明显正相关关系(图6A~6E;r≥0.3,P<0.01);与细胞色素C 氧化酶亚单位5B(cytochrome C oxidase subunit 5B,COX5B)、ATP 合酶膜亚基F(ATP synthase membrane subunit F,ATP5MF)、泛素-细胞色素C 还原酶复合体装配因子3(ubiquinol-cytochrome C reductase complex assembly factor 3,UQCC3)和线粒体编码NADH-泛醌氧化还原酶核心亚单位3(mitochondrially encoded NADH-ubiquinone oxidoreductase core subunit 3,MT-ND3)等线粒体呼吸链辅酶标志物分子的表达水平呈明显负相关关系(图6F~6J;r≤-0.3,P<0.01)。
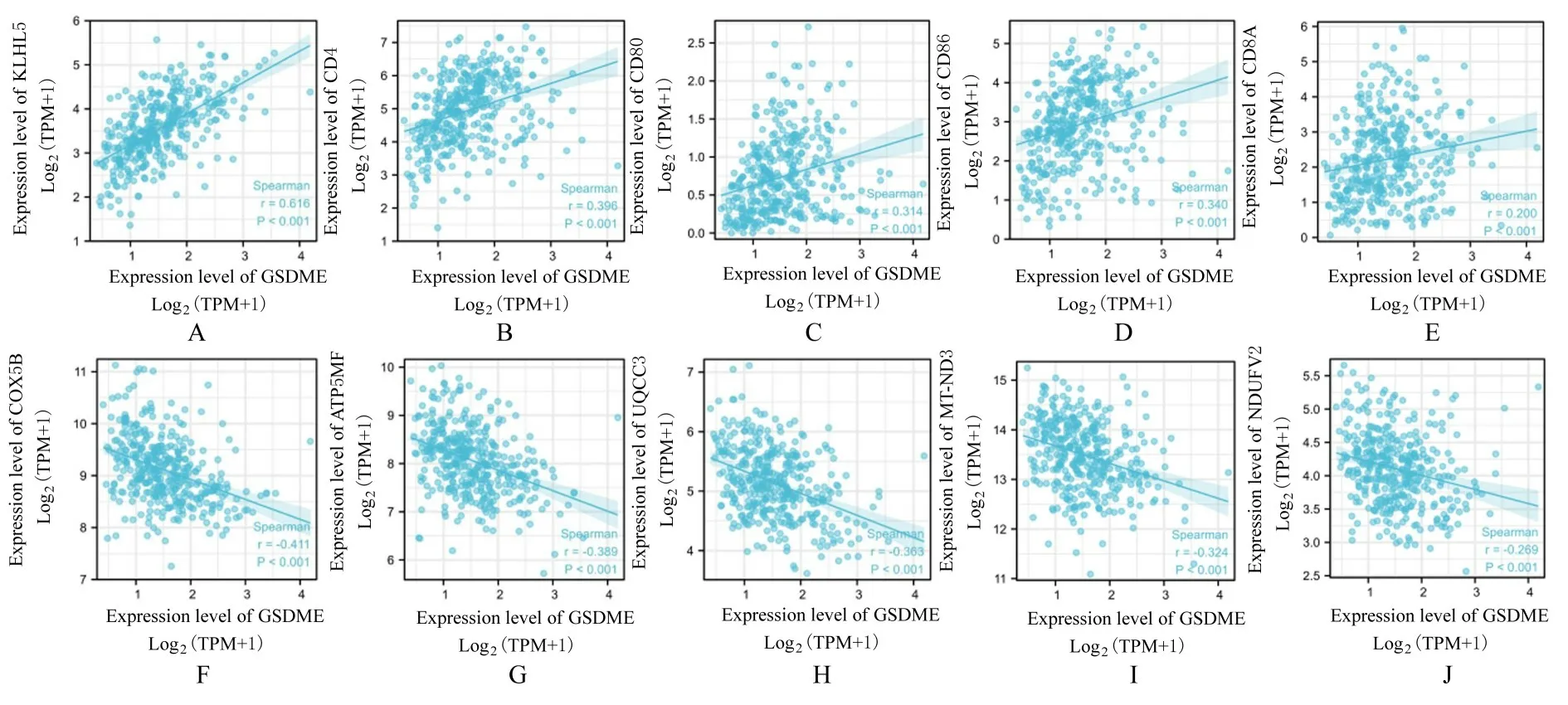
图6 GSDME 的分子间相关性分析Fig.6 Analysis on intermolecular correlations of GSDME
2.5 GSDME 蛋白在不同类型EOC 组织中的表达水平利用IHC 染色法检测正常卵巢、良性卵巢瘤、交界性卵巢瘤、低级别和高级别卵巢浆液性癌组织中GSDME 蛋白的表达。结果显示:与正常卵巢比较,EOC 组织中GSDME 蛋白表达水平明显下调,且肿瘤恶性程度越高GSDME 蛋白表达水平越低。见图7 和8。
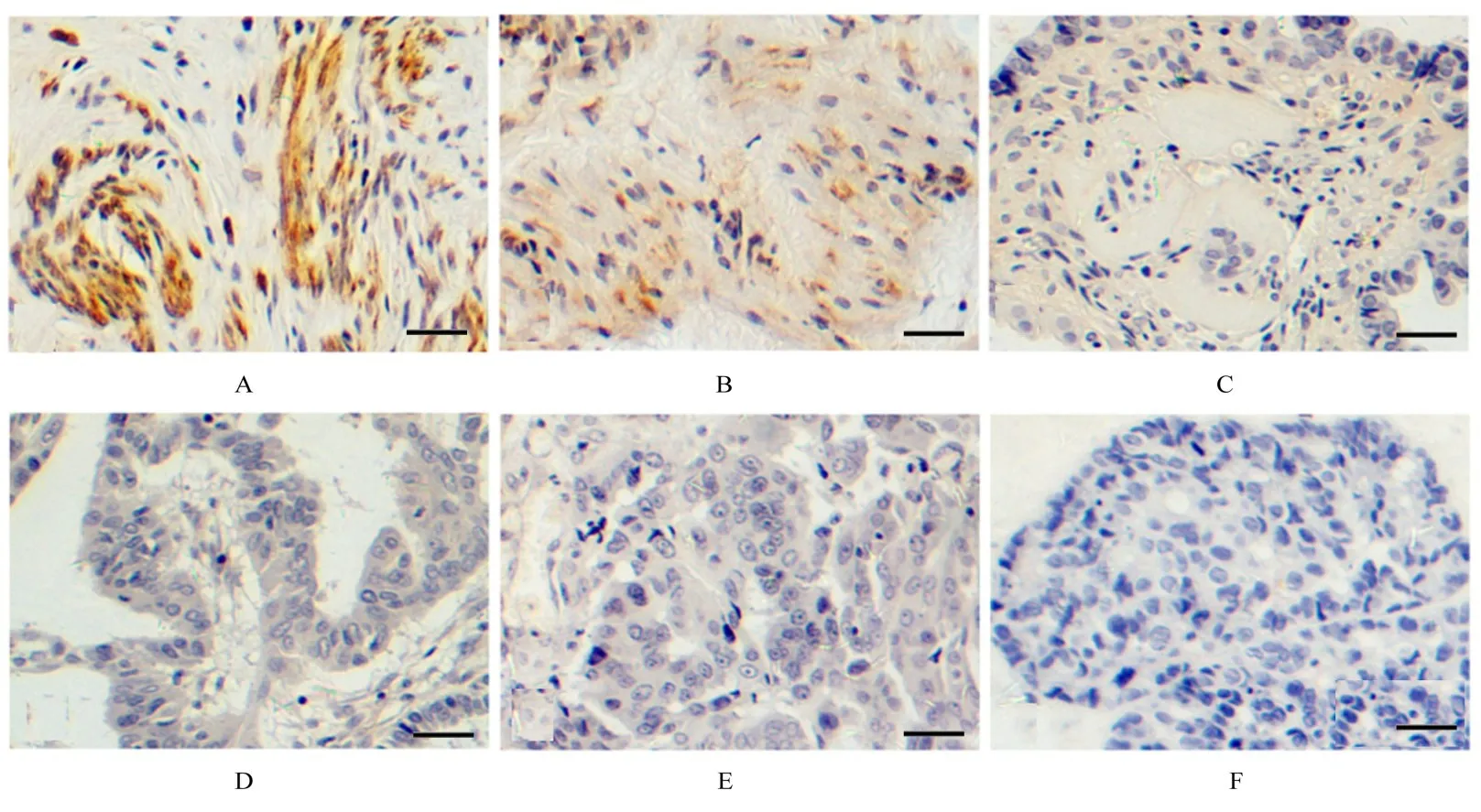
图7 IHC 染色检测不同级别和类型EOC 组织中GSDME 的表达情况(Bar=50 μm)Fig.7 Expressions of GSDME in different grades and types of EOC tissues detected by IHC staining(Bar=50 μm)
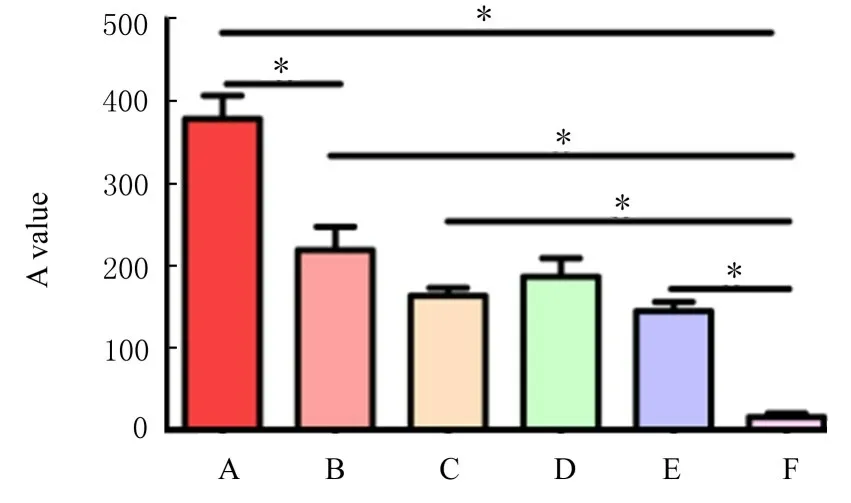
图8 各种组织中GSDME 蛋白表达水平Fig.8 Expression levels of GSDME proteins in various kinds of tissues
2.6 GSDME 蛋白在DDP 耐药组和DDP 敏感组EOC 组织中的表达水平DDP 敏感组中GSDME蛋白呈高水平表达,且明显高于DDP 耐药组(P<0.05)。见图9 和10。
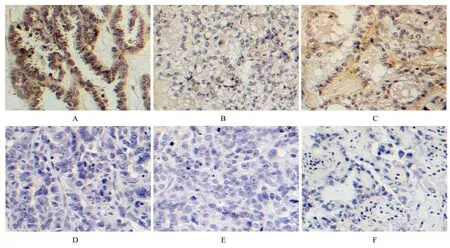
图9 IHC 法检测DDP 敏感及耐药EOC 组织中GSDME 的表达(×200)Fig.9 Expressions of GSDME in cisplatin-sensitive and cisplatin-resistant EOC tissues detected by IHC method(×200)
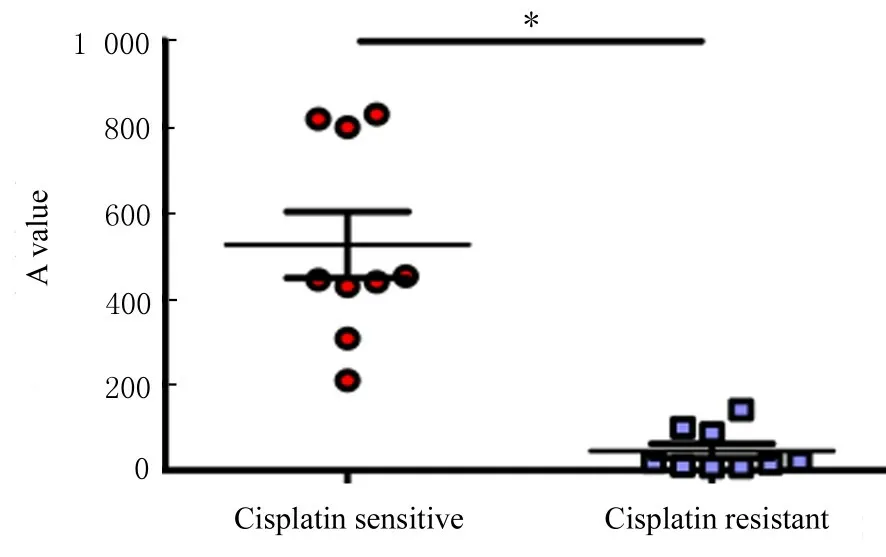
图10 DDP 敏感组和DDP 耐药组EOC 组织中GSDME 表达水平Fig.10 Expression levels of GSDME in EOC tissue in DDP sensitive group and DDP resistant group
2.7 癌旁组织、EOC 组织和Skov3 细胞中GSDME蛋白表达水平Western blotting 法检测结果显示:与癌旁组织比较,EOC 组织中GSDME 蛋白表达水平明显降低(P<0.05)。与亲本株Skov3 细胞比较,耐药株Skov3/DDP 细胞中GSDME 蛋白表达水平明显降低(P<0.05)。见图11 和12。
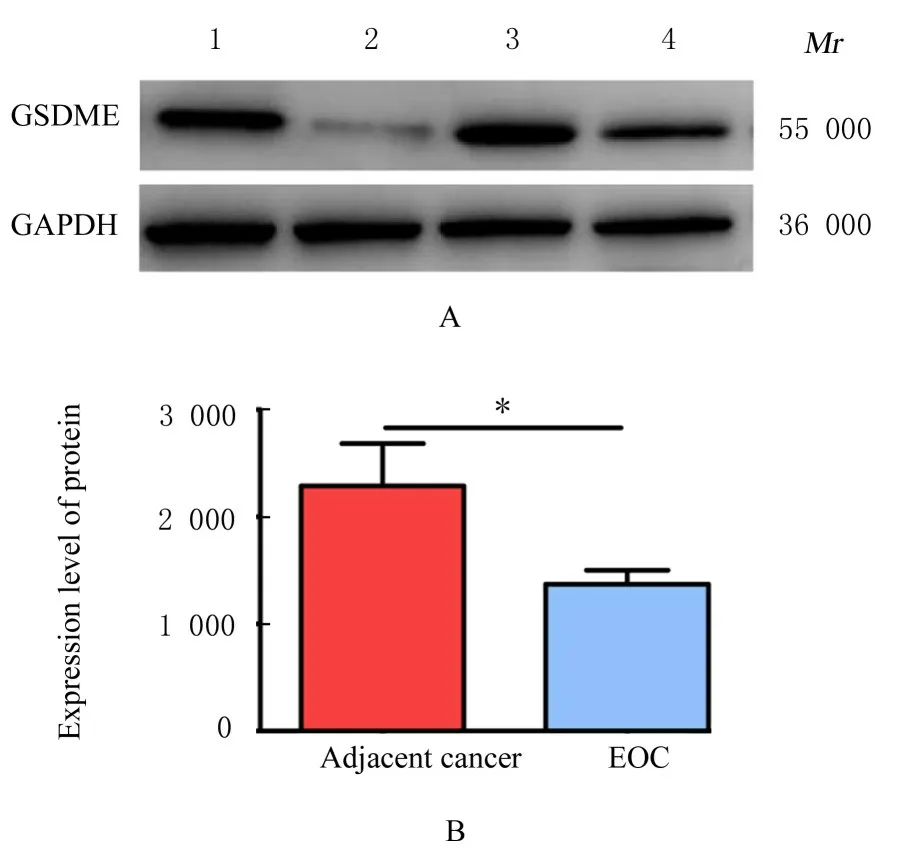
图11 Western blotting 法检测不同组织中GSDME 蛋白表达电泳图(A)和直条图(B)Fig.11 Electrophoregram(A) and histogram(B) of expressions of GSDME proteins in different kinds of tissues detected by Western blotting method
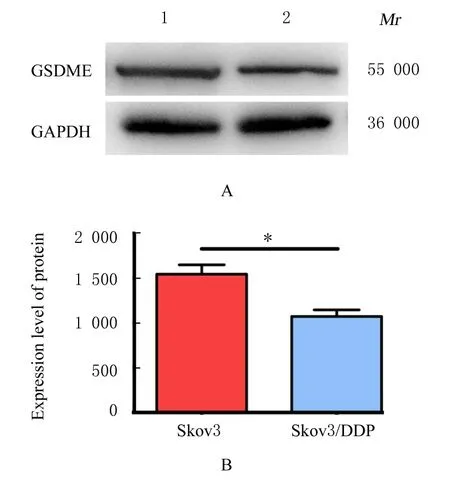
图12 Western blotting 法检测不同细胞中GSDME 蛋白表达电泳图(A)和直条图(B)Fig.12 Electrophoregram(A) and histogram(B) of expressions of GSDME proteins in different cells detected by Western blotting method
2.8 不同临床病理特征EOC 患者癌组织中GSDME 表达水平本研究纳入的40 例行盆腔淋巴结清扫术和(或)腹主动脉旁淋巴结清扫术的EOC 患者,其临床特征与GSDME 的关系见表4。病理分级高级别者占比60% (24/40),低级别者占 比40% (16/40),在 病 理 分 级 高 级 别 者 中GSDME 低表达者占比明显高于病理分级低级别者中的GSDME 低表达者(χ²=6.077,P<0.05)。
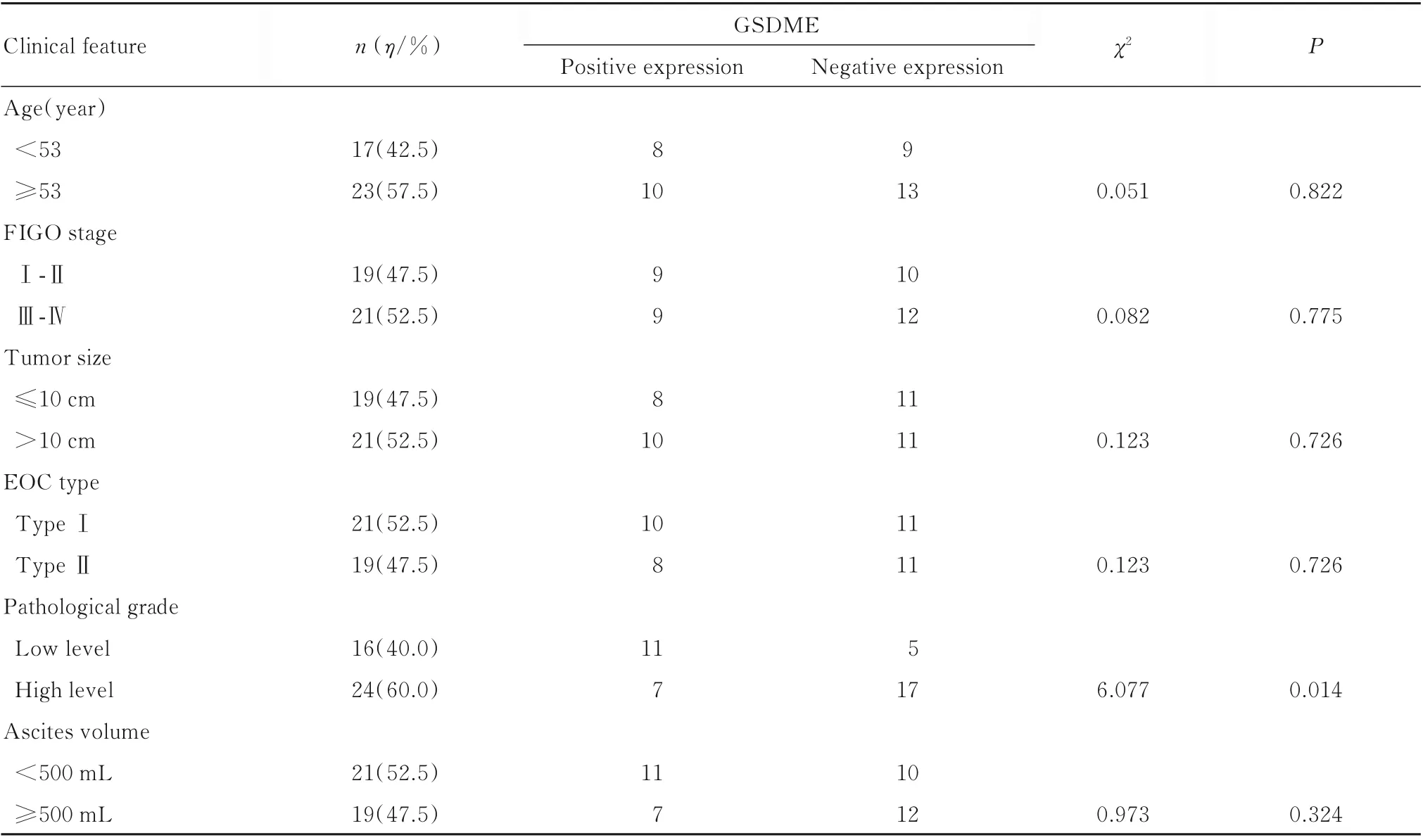
表4 GSDME 蛋白表达与EOC 患者临床特征的关系Tab.4 Relationship between GSDME protein expression and clinical characteristics of EOC
3 讨 论
作为卵巢恶性肿瘤的主要病理类型,EOC 具有易复发和易耐药的特性,也是患者死亡的重要原因。研究[11-13]显示:GSDME 在肿瘤患者化疗过程中介导了细胞焦亡,并能通过调控Caspase3 及抑癌基因p53 的表达来增强肿瘤细胞对紫杉醇的敏感性。
为了探讨GSDME 对EOC 发生发展的影响,本研究首先检索TCGA 和GTEx 数据库中EOC 的表达谱数据,结果显示:在EOC 组织中GSDME mRNA 表达水平低于正常卵巢组织,且病理组织分级越高表达越低,提示GSDME 可能参与了EOC 的发生发展。应用单基因差异分析和PPI 分析,检索到8个与肿瘤发生发展有密切关系的HUB基因。研 究[14-17]显 示:CACNA1C、CATSPERD、CACNA1G 和SCN1A 等基因是泛癌发生发展的相关基因。在卵巢癌的发展与转移中会出现KCNA1基因的过表达[18-19]。GSDME 的低表达可能与EOC患者的基因突变、肿瘤的增殖和转移等有关。本研究中功能富集分析结果显示:GSDME 的表达和免疫相关通路呈正相关关系,与调控线粒体呼吸链功能的通路呈负相关关系。因线粒体呼吸链的正常运转是维持线粒体功能的基础[20-22],故研究者猜测当GSDME 处于高水平表达时,可能会增强肿瘤的免疫杀伤作用,控制肿瘤的增长,使能量需求降低。为了验证上述猜测,本研究进行了免疫浸润及分子相关性分析,结果显示:GSDME 高表达会促使免疫功能的增强,增加肿瘤微环境中免疫细胞的浸润。肿瘤细胞本身可以通过某些基因或者通路的表达异常,从而抑制免疫细胞浸润到肿瘤微环境,促使免疫治疗原发性和适应性耐药[23-25],因此本文作者推测GSDME 的表达可能与EOC 耐药存在关联。
本研究中IHC 法检测结果显示:GSDME 表达强度会随着EOC 恶化程度的增高而降低,且GSDME 表达强度在顺铂敏感组和耐药组中有显著差异。本研究应用Western blotting 法检测EOC 组织及细胞中GSDME 蛋白的表达水平,结果显示:GSDME 蛋白在EOC 组织中的表达水平明显低于癌旁组织,在耐药株Skov3/DDP 细胞中表达水平明显低于亲本株。以上结果表明:GSDME 参与了EOC 的发生发展,且其低水平表达与EOC 的耐药有关。本研究对GSDME 在40 例EOC 样本中的表达情况与患者各项临床病理特征的关系进行分析,结果显示:GSDME 的表达与EOC 患者的发病年龄、分期、病灶大小、病理类型和腹水量无关,与病理分级有关。
综上所述,GSDME 与EOC 的发生发展有密切关联。GSDME 的低表达可能是EOC 进展及产生耐药的重要原因之一。GSDME 可以作为EOC的分子标志物及新的治疗靶点。
