罗格列酮对脂多糖诱导小鼠急性肾损伤肾小管上皮细胞铁死亡的抑制作用及其机制
2023-05-06杨巧玲叶严珏卢日峰
杨巧玲, 符 璐, 石 雨, 叶严珏, 卢日峰, 刘 永, 尹 俐
(1.重庆理工大学药学与生物工程学院生物制药系,重庆 400054;2.陆军军医大学新桥医院肾内科,重庆 400037;3.吉林大学公共卫生学院卫生毒理学教研室,吉林 长春 130021)
急性肾损伤(acute kidney injury,AKI)是一种以肾功能迅速下降甚至丧失为特征的肾脏疾病,也是导致急慢性肾衰竭最常见的原因[1-2]。AKI 发病率在全球范围内呈不断上升趋势,2012—2020 年每年的死亡人数超过200 万[3-4]。脓毒症以全身炎症、长期宿主免疫抑制和多器官功能障碍为特征,导致近一半脓毒症住院患者发生AKI[5],但脓毒症引发AKI 的分子机制尚未完全阐明。铁死亡是细胞程序性死亡的一种模式,被认为在脓毒症引发的AKI 中发挥重要作用[6-8]。长链脂酰CoA 合成 酶 4 (acyl CoA synthetase long-chain family member 4,ACSL4)是一种将脂肪酸转化为脂肪酰辅酶A 酯的酶,调节脂质生物合成,参与铁死亡的发生发展过程[9]。上述研究提示ACSL4 可能在AKI 发生发展过程中发挥重要作用,但ACSL4 在脓毒症引发的AKI 铁死亡方面的研究尚未见相关报道。本研究以C57BL/6 小鼠为研究对象,探讨ACSL4 抑制剂罗格列酮抑制肾小管上皮细胞铁死亡的潜在机制,为ACSL4 抑制剂Rosi 应用于AKI的防治提供新思路和新方法。
1 材料与方法
1.1 实验动物、主要试剂和仪器18 只8 周龄雄性C57BL/6 小鼠购自北京华阜康生物科技股份有限公司,动物使用许可证号:SYXK (渝)-2017-0010,体质量20~25 g,在22 ℃恒温动物室中饲养,光照/黑暗周期为12 h,食物和水可以自由获得。SYBR Green qPCR Master Mix (No ROX)(生产批号:HY-K0523)和RT Master Mix for qPCR(生产批号:HY-K0510)试剂盒均购自美国MCE 生物科技公司,ACSL4 抗体(生产批号:ab155282)购自美国Abcam 公司,谷胱甘肽过氧化物酶4 (glutathione peroxidase 4,GPX4)抗体(生产批号:381958)和溶质载体家族7 成员11(solute carrier family 7 member 11,SLC7A11)抗体(生产批号:382036)均购自成都正能生物技术有 限 责 任 公 司,β-actin 抗 体(生 产 批 号:AF0003)、辣根过氧化物酶标记山羊抗兔(生产批号:A0208)和山羊抗小鼠二抗(生产批号:A0216)均购自上海碧云天生物技术有限公司,ACSL4、GPX4、SLC7A11 和β-actin 引 物 序 列 由生工生物工程(上海)股份有限公司提供,罗格列酮(生产批号:302543-62-0)购自美国阿拉丁工业公司,脂多糖(lipopolysaccharide,LPS)购自美国Sigma Aldrich 公司,肌酐(creatinine,CRE)(生产批号:C011-2-1)和血尿素氮(blood urea nitrogen,BUN)(生产批号:C013-2-1)试剂盒购自南京建成生物工程研究所,SYBR Green qPCR Master Mix(No ROX)(美国Promega 公司)。全自动数字病理切片扫描仪购自宁波江丰生物信息技术有限公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,qRT-PCR)仪购自瑞士Roche 公司,Fluor Chem HD2 化学发光凝胶成像系统购自美国 Protein Simple 公司,全波长多功能酶标仪购自美国Thermo Fisher Scientific 公司,JEM-1400PLUS 透射电镜购自日本电子株式会社。
1.2 实验动物分组和给药18 只实验小鼠随机分为对照组、LPS 组和LPS+ 罗格列酮组,每组6 只。LPS 组和LPS+罗格列酮组小鼠均腹腔注射10 mg·kg-1LPS,LPS+ 罗 格 列 酮 组 小 鼠 提 前30 min 尾静脉注射0.5 mg·kg-1罗格列酮,对照组小鼠注射与LPS 组小鼠同体积的生理盐水。24 h 后处死小鼠,收集肾组织和血液进一步分析。
1.3 RT-qPCR 法检测各组小鼠肾组织中 GPX4、SLC7A11、ACSL4、白细胞介素(interleukin,IL)-6、IL-1β 和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)mRNA 表达水平从小鼠肾组织皮质部分提取总RNA,RNA 逆转录反应体系和反应条件按照RT Master Mix for qPCR 试剂盒说明书所示。逆转录完成后得到cDNA 采用RT-qPCR 仪进行扩增,RT-qPCR 反应体系和反应条件见SYBR Green qPCR Master Mix (No ROX)试剂盒说明书,引物序列见表1。

表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.4 Western blotting 法检测各组小鼠肾组织中GPX4、SLC7A11 和ACSL4 蛋白表达水平取各组小鼠肾组织皮质部分加入RIPA 裂解液用低温匀浆机进行匀浆,4 ℃裂解30~60 min 后BCA 法测定蛋白浓度。然后行SDS-PAGE 凝胶电泳,之后转移至PVDF 膜上。将膜封闭在5%脱脂奶粉中,并在4 ℃下分别与ACSL4、GPX4、SLC7A11 和β-actin抗体孵育过夜。TBST 洗膜3 次,每次5 min,在二抗中孵育1 h,TBST 漂洗后加入ECL 发光液,用增强化学发光系统显现印迹。Image J 软件进行灰度扫描,计算目标蛋白表达水平。目标蛋白表达水平=目标蛋白条带灰度值/β-actin 条带灰度值。
1.5 HE 染色观察各组小鼠肾组织病理形态表现石蜡切片(4 μm)放置60 ℃烘箱中烤1 h,脱蜡至水。苏木素中染色2~3 min,自 来 水 冲 洗1 min,0.6% 盐酸酒精分化液分化30 s,自来水15 min,氨水1 min 返蓝。再用1%醇溶性伊红溶液染色1 min,依次放至梯度浓度乙醇(80%乙醇、95%乙醇、100%乙醇和100%乙醇)中各2 min,二甲苯Ⅰ 10 min,二甲苯Ⅱ 10 min,中性树脂封片。全自动数字病理切片扫描仪观察各组小鼠肾组织病理形态表现。在光镜下对每张切片取10 个皮髓交接区肾小管视野进行损伤评分,对每个组小鼠损伤评分取平均值。急性损伤评分标准:依据肾小管上皮细胞坏死、管型形成和肾小管扩张占肾小管总数的百分率进行评价。0 分,无损伤;1 分,损伤≤10%;2 分,损伤介于11%~25%;3 分,损伤介于26%~45%;4 分,损伤介于46%~75%;5 分,损伤>76%。
1.6 分光光度法检测各组小鼠血清中CRE 和BUN水平小鼠安乐死后,用灭菌尖镊眼球取血,血 样 室 温 静 置30 min,3 000 r·min-1离 心15 min,取上清后按照南京建成生物工程研究所CRE 和BUN 测定试剂盒说明书进行检测,紫外分光光度计在波长546 和640 nm 处检测吸光度(A)值,然后通过公式计算各组小鼠血清中CRE 和BUN 水平。CRE 水平(μmol·L-1)=(测定组ΔA 值-空白组ΔA 值)/(标准组ΔA 值-空白组ΔA 值)×标准组C 值。BUN 水平(mmol·L-1)=(测定组ΔA 值-空白组ΔA 值)/(标准组ΔA 值-空白组ΔA 值)×标准组C 值×样本稀释倍数。
1.7 透射电镜观察各组小鼠肾组织超微结构形态表现小鼠安乐死后取肾组织皮质部分放至EP 管中,轻柔地加入1 mL 电镜液(2.5%戊二醛固定液),4 ℃过夜,然后用磷酸缓冲液漂洗3 次,每次10 min,再用1%锇酸固定液固定2 h,磷酸缓冲液继续漂洗3 次,梯度丙酮脱水,丙酮/包埋剂渗透,纯包埋剂包埋后进行超薄切片,染色干燥后透射电镜观察。电镜样品检测由陆军军医大学电子显微中心实验室完成。
1.8 统计学分析采用GraphPad Prism 8 统计软件进行统计学分析。各组小鼠肾组织中肾小管损伤评分,血清中CRE 和BUN 水平,肾组织中GPX4、SLC7A11 和ACSL4 mRNA 及蛋白表达水平,IL-6、IL-1β 和TNF-α mRNA 水 平 均 符 合 正 态 分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠肾脏病理形态表现及血清中CRE 和BUN 水平肾脏组织HE 染色结果显示:对照组小鼠肾组织结构完整,排列整齐;LPS 组小鼠肾组织结构破坏,肾小管管腔内出现明显空泡结构;与LPS 组比较,LPS+罗格列酮组小鼠肾组织中管腔内基本无空泡结构,见图1。与对照组比较,LPS 组小鼠肾小管损伤评分明显升高(P<0.01);与LPS 组比较,LPS+罗格列酮组小鼠肾小管损伤评分明显降低(P<0.01),见图2。与对照组比较,LPS 组小鼠血清中CRE 和BUN 水平明显升高(P<0.01);与LPS 组比较,LPS+罗格列酮组小鼠血清中CRE 和BUN 水平明显降低(P<0.01),见表2。
表2 各组小鼠血清中CRE 和BUN 水平Tab.2 Levels of serum CRE and BUN of mice in various groups (n=6,±s)
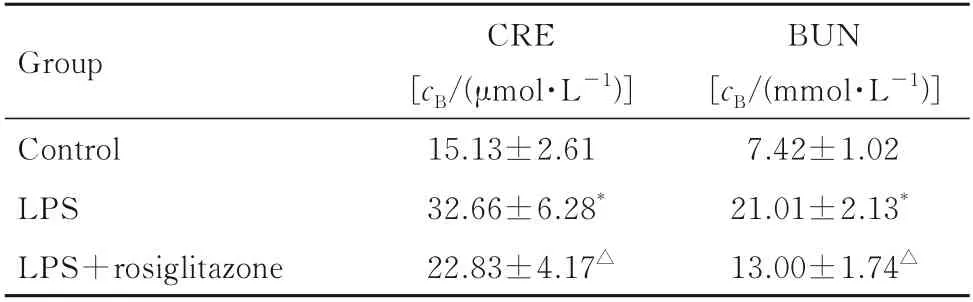
表2 各组小鼠血清中CRE 和BUN 水平Tab.2 Levels of serum CRE and BUN of mice in various groups (n=6,±s)
*P<0.01vscontrol group;△P<0.01vsLPS group.
Group Control LPS LPS+rosiglitazone BUN[cB/(mmol·L-1)]7.42±1.02 21.01±2.13*13.00±1.74△CRE[cB/(μmol·L-1)]15.13±2.61 32.66±6.28*22.83±4.17△
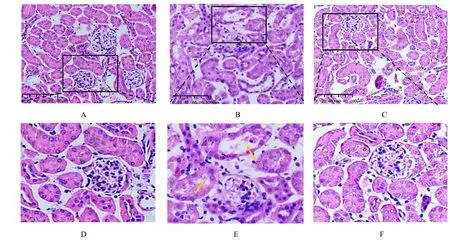
图1 HE 染色观察各组小鼠肾组织病理形态表现Fig.1 Pathomorphology of kidney tissue of mice in various groups observed by HE staining
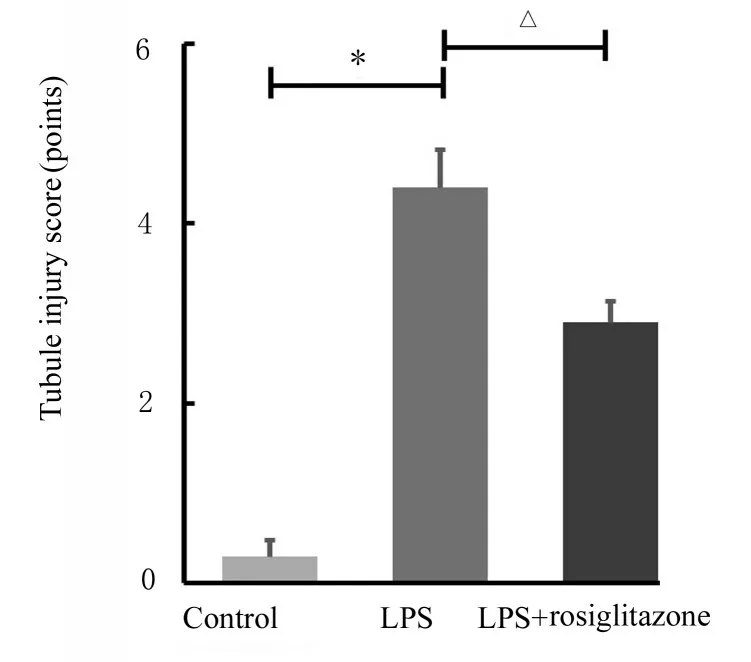
图2 各组小鼠肾小管损伤评分Fig.2 Injury scores of renal tubular of mice in various groups
2.2 各组小鼠肾组织中线粒体形态及铁死亡标志分子GPX4 和SLC7A11 mRNA 及蛋白表达水平透射电镜观察结果显示:对照组小鼠肾小管上皮细胞线粒体双层膜结构完整,线粒体嵴清晰;LPS 组小鼠肾小管上皮细胞出现线粒体体积缩小、膜密度增加和线粒体嵴减少等铁死亡典型特征;与LPS 组比较,LPS+罗格列酮组小鼠肾小管上皮细胞线粒体体积和嵴消失等形态改变明显改善,见图3。与对照组比较,LPS 组小鼠肾组织中GPX4 和SLC7A11 mRNA 及蛋白表达水平明显降低(P<0.01);与LPS 组比较,LPS+罗格列酮组小鼠肾组织中GPX4 和SLC7A11 mRNA 及蛋白表达水平明显升高(P<0.01)。见图4 和5。

图3 各组小鼠肾组织中线粒体形态表现Fig.3 Morphology of mitochondrion in kidney tissue of mice in various groups

图4 各组小鼠肾组织中SLC7A11 和 GPX4 mRNA 表达水平Fig.4 Expression levels of SLC7A11 and GPX4 mRNA in kidney tissue of mice in various groups
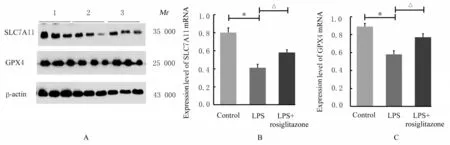
图5 各组小鼠肾组织中SLC7A11 和GPX4 蛋白表达电泳图(A)和直条图(B,C)Fig.5 Electrophoregram(A) and histograms(B,C) of expressions of SLC7A11 and GPX4 proteins in kidney tissue of mice in various groups
2.3 各组小鼠肾组织中ACSL4 mRNA 和蛋白表达水平与对照组比较,LPS 组小鼠肾组织中ACSL4 mRNA 和蛋白表达水平明显升高(P<0.01);与LPS 组比较,LPS+罗格列酮组小鼠肾组织中ACSL4 mRNA 和蛋白表达水平明显降低(P<0.01)。见图6。
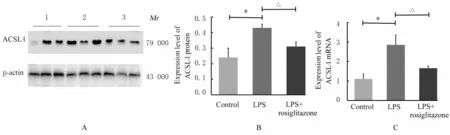
图6 各组小鼠肾组织中ACSL4 蛋白表达电泳图(A)和ACSL4 蛋白(B)及mRNA(C)表达直条图Fig.6 Electrophoregram(A) expression of ACSL4 protein(B) and histograms of expressions of ACSL4 protein(B)and mRNA(C) in kidney tissue of mice in various groups
2.4 各组小鼠肾组织中IL-6、IL-1β 和TNF-αmRNA 表达水平与对照组比较,LPS 组小鼠肾组织中 IL-6、IL-1β 和TNF-α mRNA 表达水平明显升高(P<0.01);与LPS 组比较,LPS+罗格列酮组小鼠肾组织中IL-6、IL-1β 和TNF-α mRNA 表达水平明显降低(P<0.01)。见图7。
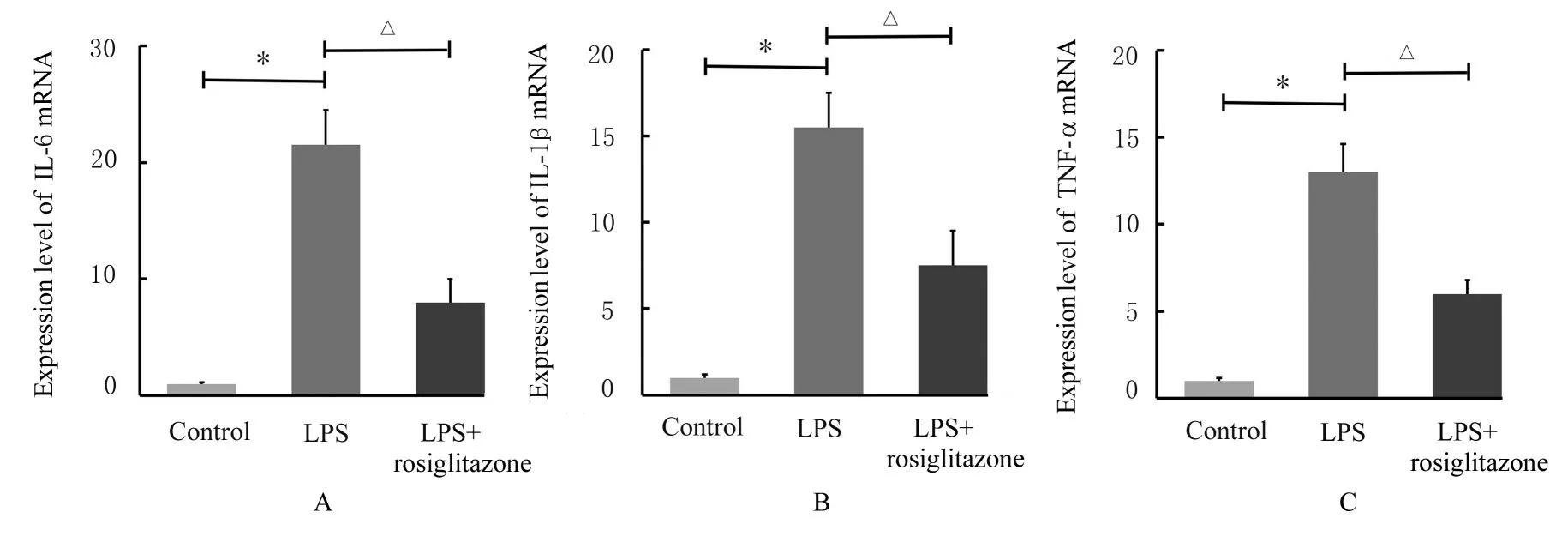
图7 各组小鼠肾组织中IL-1β、IL-6 和 TNF-α mRNA 表达水平Fig.7 Expression levels of IL-1β, IL-6, and TNF-α mRNA in kidney tissue of mice in various groups
3 讨 论
AKI 主要表现为肾功能在数天至数周内急剧下降,在住院患者中AKI 发生率及病死率较高,已成为世界范围内的公共卫生问题[10-11]。由LPS 引起的脓毒症是AKI 的常见病因,目前尚无理想的防治手段[12-13]。氧化应激、细胞凋亡、自噬及炎症等均参与AKI 的发生发展过程[14-15]。铁死亡是由细胞膜中含多不饱和脂肪酸磷脂(poly-unsaturated fatty acids-containing phospholipids,PUFA-PLs)的铁依赖性的过氧化引发的一种调节性细胞死亡。近年来,研究[16-17]表明:铁死亡在AKI 的发生发展过程中发挥重要作用。但是目前关于铁死亡在脓毒症引发的AKI 作用机制的研究较少,因此本研究采用LPS 构建脓毒症引发的AKI 小鼠模型,并从铁死亡特征和标志分子GPX4 及SLC7A11 角度探讨铁死亡在AKI 中的作用机制,对于AKI 的防治具有重要意义。
ACSL4 是调控机体内脂肪代谢关键酶ACSLs家族中的一员。ACSLs 家族包括ACSL1、ACSL3、ACSL4、ACSL5 和 ACSL6,主要负责将12~20 个碳链长度的脂肪酸、三磷酸腺苷和辅酶A 催化形成长链酰基辅酶 A[18-19]。ACSL4 能将花生四烯酸和肾上腺酸催化合成花生四烯酰CoA和肾上腺酰CoA,以使其参与膜磷脂的合成[20]。细胞膜上的长链多不饱和脂肪酸(二十碳五烯酸、二十二碳六烯酸和花生四烯酸等)常被氧化,从而引 发 细 胞 的 铁 死 亡[21-22]。徐 硕 等[23]研 究 表 明:ACSL4 敲除/过表达可以减少/增加细胞脂质氧化物生成从而调控铁死亡。敲除ACSL4 可以抑制铁死亡而减轻肾脏缺血再灌注诱导的肾脏损伤[24]。本研究中,小鼠腹腔注射LPS 诱导AKI 后,铁死亡标志分子GPX4 和SLC7A11 mRNA 及蛋白表达水平明显降低,而ACSL4 mRNA 和蛋白表达水平明显升高,表明在LPS 模拟的脓毒症诱导的AKI铁死亡中,ACSL4 也具有调控铁死亡从而保护肾脏免受LPS 损伤的潜在作用。
鉴于铁死亡在AKI 中重要的调控作用,大量研究采用铁死亡抑制剂来减轻AKI[25-27]。铁死亡抑制剂种类较多,包括:① 以脂质过氧化为靶点的ferrostatin-1、帕立骨化醇和维生素 E 等;② 以GPX4 为靶点的硒和多巴胺;③ 以铁离子为靶点的去铁胺等;④ 以Xc-系统(胱氨酸/谷氨酸反向转运体)为靶点的环己酰亚胺和肝再生增强因子;⑤ 以ACSL4 为靶点的噻唑烷二酮类[25]。在缺血再灌注损伤诱导的AKI 小鼠模型中,ferrostatin-1 可保护小鼠免受功能性急性肾衰竭[26]。帕立骨化醇能够通过降低膜脂质过氧化抑制铁死亡而在功能和组织学上减轻顺铂诱导的AKI[27]。罗格列酮属于噻唑烷二酮类,能减轻各种因素诱导的肾损伤[28-30]。谷名晓等[31]研究显示:在庆大霉素诱导的大鼠急性肾损害模型中,给予罗格列酮灌胃的大鼠肾小管坏死程度、上皮细胞空泡变性程度和间质炎性细胞浸润程度较庆大霉素组轻。魏啸等[32]研究显示:罗格列酮预处理可以拮抗 LPS 激活过氧化物酶体增殖物激活受体 γ (peroxisome proliferator-activated receptor γ,PPAR-γ)介 导 的肾脏炎症反应从而减轻小鼠急性肾损伤。本研究从铁死亡角度出发,发现铁死亡分子ACSL4 在LPS诱导的AKI 中具有潜在的调控作用,进一步选用以ACSL4 作为靶点的铁死亡抑制剂噻唑烷二酮类药物罗格列酮,结果显示:罗格列酮能够明显改善LPS 诱导的AKI 小鼠中肾脏组织损伤、肾功能、铁死亡和炎症水平。本研究结果进一步证实了罗格列酮能减轻LPS 诱导的肾损伤,但机制较前期研究[32]发现的罗格列酮以PPAR-γ 作为靶点有所不同,结果显示:罗格列酮改善LPS 诱导的急性肾损伤时以铁死亡调控分子ACSL4 作为靶点发挥作用。
综上所述,罗格列酮可以ACSL4 为靶点减轻LPS 所致小鼠急性肾损伤,其保护机制可能是通过抑制 ACSL4 介导的肾小管上皮细胞铁死亡而发挥作用。ACSL4 抑制剂罗格列酮可作为潜在药物用于防治细菌LPS 所致脓毒症诱发的AKI。
