阿托伐他汀对人舌鳞癌CAL-27 细胞增殖、凋亡和迁移的影响及其机制
2023-05-06王开,黄汉
王 开, 黄 汉
(锦州医科大学附属第一医院口腔颌面外科,辽宁 锦州 121000)
舌鳞癌的发生率在口腔癌中一直位于首位并呈持 续 升 高 趋 势[1],且 近 年 来 发 展 趋 向 年 轻 化[2],高恶性、高复发率、高淋巴结转移率和低存活率是舌鳞癌的主要特征[3]。目前,手术联合术后放化疗是舌鳞癌的首要治疗方法,但由于其部位特殊、手术难度大、放化疗不良反应大且易复发,患者预后并不十分理想。因此,探讨关于舌鳞癌的有效靶向治疗药物具有重要意义。他汀类药物是一种主要针对甲羟戊酸途径(mevalonate pathway,MVP)的限速酶——3-羟甲基戊二醇辅酶A 还原酶(3-hydroxymethylpentanediol coenzyme A reductase,HMGCR)的抑制剂,阿托伐他汀(atorvastatin,ATO)是其最常见的一种,临床上常用于治疗高脂血症和动脉粥样硬化等心血管循环系统疾病[4]。近年来多项研究[5-10]表明:ATO 在肿瘤的发生发展过程中具有抑制作用,且与肿瘤患者的生存率有密切关联,可调控前列腺癌、卵巢癌、乳腺癌、胰腺癌和非小细胞肺癌等多种癌症细胞的表达。但目前,关于ATO 在舌鳞癌中所发挥的作用及其机制的报道较少,本研究通过探讨ATO 对舌鳞癌CAL-27 细胞增殖、细胞凋亡和细胞迁移的影响及其可能的作用机制,为临床舌鳞癌的治疗及提高舌鳞癌患者的生存率提供必要的理论支持和实验基础。
1 材料与方法
1.1 细胞、主要试剂和仪器人舌鳞癌细胞株CAL-27 购于中科院上海细胞库。ATO (药物浓度 ≥ 98%)购于北京索莱宝生物科技有限公司,DMEM-高糖培养基和双抗购于美国Hyclone 公司,胎牛血清购于美国Gemini 公司,CCK-8 检测试剂盒、4% 甲醛固定液、结晶紫染色液、Hoechst33342 染色液、BCA 蛋白定量试剂盒和超敏ECL 化学试剂盒购于上海碧云天生物技术有限公司,Annexin Ⅴ-FITC/7-AAD 凋亡检测试剂盒购于北京四正柏生物科技有限公司,蛋白Marker购于美国Thermo 科技有限公司,β-actin 抗体和P53 抗体购于南京巴傲德生物科技有限公司,P21抗体和周期蛋白依赖性激酶6 (cyclin-dependent kinase 6,CDK6)抗体购于北京博奥森生物技术有限 公 司,B 细 胞 淋 巴 瘤2 (B-cell lymphoma-2,Bcl-2)抗 体、Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein,Bax)抗体、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)-3 抗体和Caspase-9 抗体购于沈阳万类生物科技有限公司。恒温细胞培养箱和酶标仪购于美国Thermo 公司,倒置显微镜购于德国LEICA 公司,荧光显微镜购于日本Olympus 公司,流式细胞仪购于美国BD 公司,蛋白电泳仪购于美国BIORAD 公司,ECL 发光成像系统购于上海天能科技有限公司。
1.2 细胞培养使用含有10% 胎牛血清和1% 双抗(青霉素/链霉素)的高糖DMEM 培养基,将CAL-27 细胞置于37 ℃、5% CO2的恒温孵育箱中培养。当细胞长至皿底80%~90% 时,使用胰蛋白酶消化,离心重悬后传代,之后根据预实验将细胞分为对照组(不含 ATO)和1、5、10、20 及40 μmol∙L-1ATO 组并进行实验。
1.3 CCK-8 法检测各组细胞存活率取对数生长期CAL-27 细胞,消化离心后,将细胞(每孔5×103个细胞)均匀接种于96 孔细胞培养板中,边缘以无菌PBS 缓冲液封闭,孵箱孵育直至贴壁。分为对照组和不同浓度ATO 组,分别采用含0、1、5、10、20 和40 μmol∙L-1ATO 的培养基继续孵育24 和48 h。孵育结束每孔加入10 μL CCK-8 试剂,2 h 后采用酶标仪于波长450 nm 处测定每孔吸光度(A)值,计算细胞存活率。细胞存活率=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.4 克隆形成实验检测各组细胞克隆形成率将对数生长期的CAL-27 细胞消化离心重悬,均匀接种于6 cm 的培养皿中,每皿1 000 个细胞。细胞贴壁及生长状态良好时,分为对照组和不同浓度ATO 组,分别采用含0、1、5、10、20和40 μmol∙L-1ATO 的培养基进行常规培养,每2 d 更换1 次培养基,连续培养14 d。4%多聚甲醛固定后结晶紫染色液进行染色,拍照记录并计算细胞克隆形成率。细胞克隆形成率=克隆数/接种细胞数×100%。
1.5 Hoechst33342 荧光染色观察各组细胞凋亡情况以每皿2×105个细胞的密度,将生长状态良好的CAL-27 细胞消化离心重悬,均匀接种于6 cm 的培养皿中。细胞贴壁后,分为对照组和不同浓度ATO 组,分别采用含0、1、5、10、20和40 μmol∙L-1ATO 的培养基继续孵育48 h,加入Hoechst33342染色液染色30 min,荧光显微镜下拍照记录。细胞凋亡时可观察到细胞核呈致密浓染或碎块状。
1.6 流式细胞术AnnexinⅤ-FITC/7-AAD 双标记检测各组细胞凋亡率将对数生长期的CAL-27 细胞消化离心重悬后,将5×105个细胞接种于6 cm的培养皿中。细胞贴壁且生长状态良好时,分为对照组和不同浓度ATO 组,分别采用含0、1、5、10、20 和40 μmol∙L-1ATO 的培养基继续孵育48 h。用不含EDTA 的胰酶消化细胞,Binding buffer 重悬,每组取100 μ L 细胞悬液加入流式管中,加入8 μL Annexin Ⅴ-FITC 室温避光孵育30 min,再加10 μL 7-AAD 和400 μL 的PBS 缓冲液,流式细胞仪检测细胞凋亡率。细胞凋亡率=早期凋亡率(Q3 象限)+ 晚期凋亡率(Q2 象限)。
1.7 细胞划痕实验检测各组细胞迁移率以每皿1.5×105个细胞的密度,将生长状态良好的CAL-27 细胞消化离心重悬后,均匀接种于6 cm 的培养皿中。细胞铺满整个皿底时,使用200 μL 移液器枪头均匀划痕,PBS 缓冲液清洗悬浮细胞,分为对照组和不同浓度ATO 组,分别采用含0、1、5、10、20 和40 μmol∙L-1ATO 的培养基继续孵育48 h。分别于0 和48 h 进行拍照记录,计算细胞迁移率。细胞迁移率=(0 h 划痕宽度-24 h 划痕宽度)/ 0 h 划痕宽度×100%。
1.8 Western blotting 法检测各组细胞中P53、P21、CDK6、Bcl-2、Bax、Caspase-3 和Caspase-9 蛋白表达水平将CAL-27 细胞分为对照组和不同浓度ATO 组,分 别 采 用 含0、1、5、10、20 和40 μmol∙L-1ATO 的培养基常规培养48 h。使用细胞刮刀刮下经不同浓度ATO 处理的CAL-27 细胞,加入蛋白裂解液于冰上充分裂解,离心后取上清,BCA 蛋白定量法进行定量,调整蛋白浓度并制样。电泳,转膜,5%脱脂奶粉封闭2 h,随后依次加入β-actin、P53、P21、CDK6、Bcl-2、Bax、Caspase-3 和Caspase-9 兔抗人一抗,4 ℃ 摇床过夜。TBST 洗膜6 次后加入HRP 标记的二抗,室温孵育2 h 后洗膜3 次,ECL 显影,Image J 软件分析蛋白条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值×100%。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组细胞存活率,克隆形成率,细胞凋亡率,细胞迁移率及细胞中P53、P21、CDK6、Bcl-2、Bax、Caspase-3 和Caspase-9 蛋 白 表 达 水 平均符合正态分布且方差齐,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组CAL-27 细胞的细胞存活率CCK-8 法检测结果显示:对照组和不同浓度ATO (1、5、10、20 和40 μmol∙L-1ATO)组CAL-27 细 胞 的24 h 细 胞 存 活 率 分 别 为(100.00±0.00)%、(95.33±0.50)%、(90.47±0.81)%、(84.47±0.90)%、(75.47±1.59)% 和 (64.17±0.59)%,48 h 细胞存活率分别为(100.00±0.00)%、(94.70±0.95)%、(86.47±1.34)%、(81.03±1.04)%、(61.27±0.64)%和(37.06±1.62)%。与对照组比较,不同浓度ATO 组CAL-27 细胞存活率明显降低(P<0.05),且呈浓度依赖性和时间依赖性。见图1。
2.2 各组CAL-27 细胞克隆形成率与对照组(69.28%±2.26%)比 较,1、5、10、20 和40 μmol∙L-1ATO 组细胞克隆形成率(58.16%±1.16%、44.72%±1.32%、20.86%±0.87%、7.47%±0.83% 和0.15%±0.18%)呈浓度依赖性降低(P<0.01)。见图2。
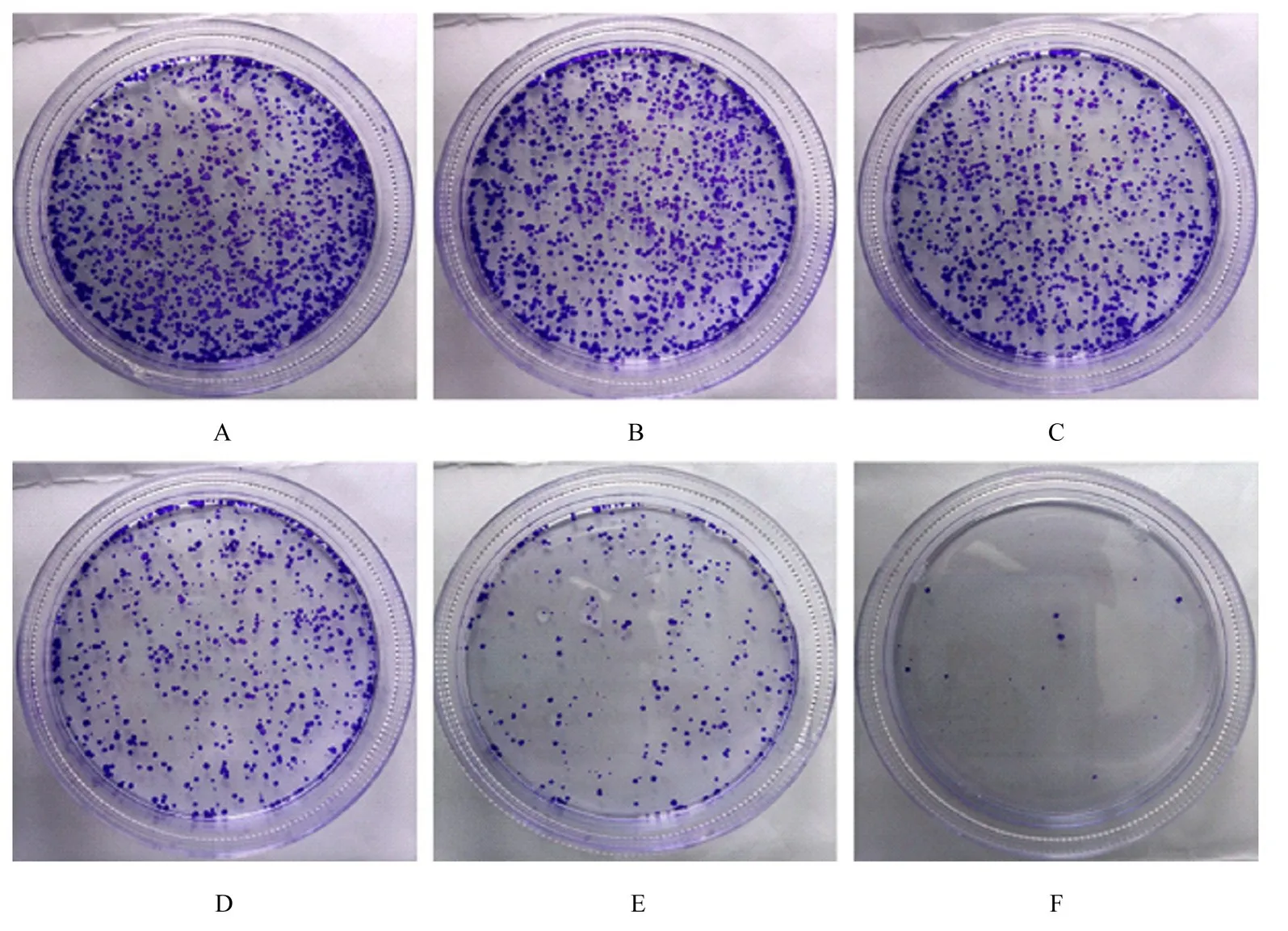
图2 克隆形成实验检测各组细胞克隆形成情况(结晶紫)Fig.2 Colony formations of CAL-27 cells in various groups detected by clone formation assay(Crystal violet)
2.3 各组CAL-27 细胞凋亡率Hoechst33342 染色检测结果显示:对照组细胞为均匀的淡蓝染色,核膜完整,细胞形态正常;1 和5 μmol∙L-1ATO 组细胞呈现大小形态不均,细胞核呈高亮状态;10 μmol∙L-1ATO 组细胞核固缩明显,细胞核荧光强度更高;20 和40 μmol∙L-1ATO 组细胞几乎全部凋亡。见图3。

图3 倒置荧光显微镜观察各组CAL-27 细胞凋亡情况(Hoechst33342 染色,×20)Fig.3 Apoptosis of CAL-27 cells in various groups observed by inverted fluorescence microscope(Hoechst33342 staining,×20)
流式细胞术检测结果显示:经Annexin Ⅴ-FITC /7-AAD双标记后,与对照组(9.23%±0.38%)比较,1、5、10、20 和40 μmol∙L-1ATO 组细胞凋亡 率 (10.25%±0.09%、12.45%±0.38%、16.71%±0.11%、31.00%±0.29% 和48.43%±0.42%)均明显升高(P<0.05),且呈浓度依赖性。见图4。
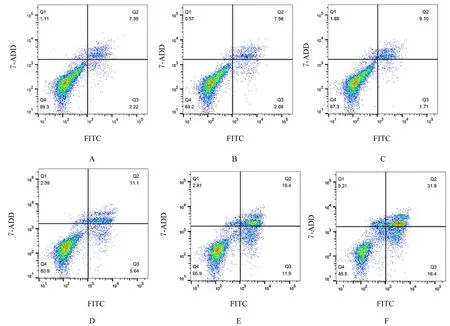
图4 Annexin Ⅴ-FITC/7-AAD 法检测各组 CAL-27 细胞凋亡情况Fig.4 Apoptosis of CAL-27 cell in various groups detected by Annexin Ⅴ-FITC/7-AAD method
2.4 各组CAL-27 细胞迁移率与对照组(89.83%±4.15%)比 较,1、5、10、20 和40 μmol∙L-1ATO 组细胞迁移率(80.59%±6.28%、68.90%±4.03%、51.13%±4.07%、30.82%±3.70% 和 16.77%±1.46%)明 显 降 低 (P<0.05),且呈浓度依赖性。见图5。

图5 细胞划痕实验检测CAL-27 细胞迁移情况(×20)Fig.5 Migration of CAL-27 cells in various groups detected by cell scratch test(×20)
2.5 各组CAL-27 细胞中P53、P21、CDK6、Bax、Bcl-2、Caspase-3 和Caspase-9 蛋白表达水平不同浓 度ATO (1、5、10、20 和40 μmol∙L-1)作 用CAL-27 细胞48 h 后,Western blotting 法检测结果显示:与对照组比较,不同浓度ATO 组CAL-27细胞中P53、P21、Bax、Caspase-3 和Caspase-9 蛋白表达水平升高(P<0.05),CDK6 和Bcl-2 蛋白表达水平降低(P<0.05)。见图6 和7。
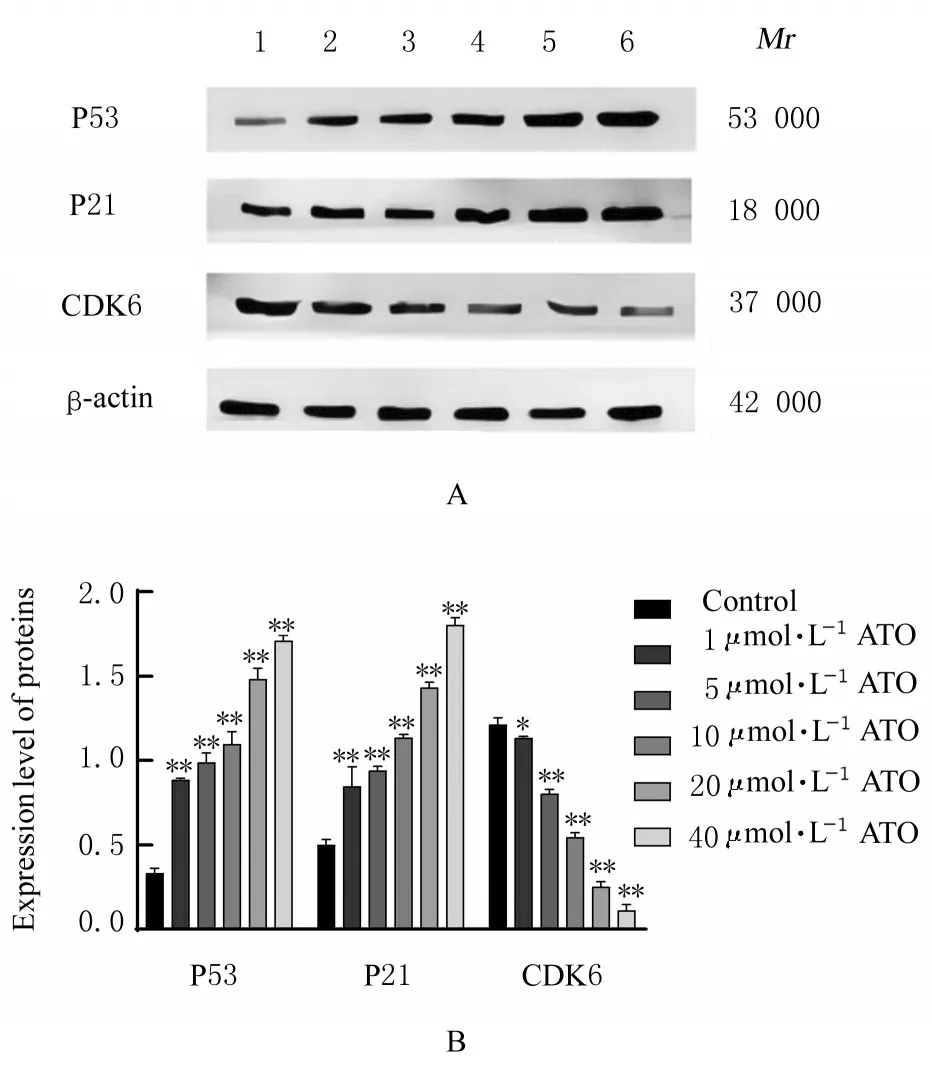
图6 各组CAL-27 细胞中P53、P21 和CDK6 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram(A) and histogram(B) of expressions of P53, P21, and CDK6 proteins in CAL-27 cells in various groups detected by Western blotting method
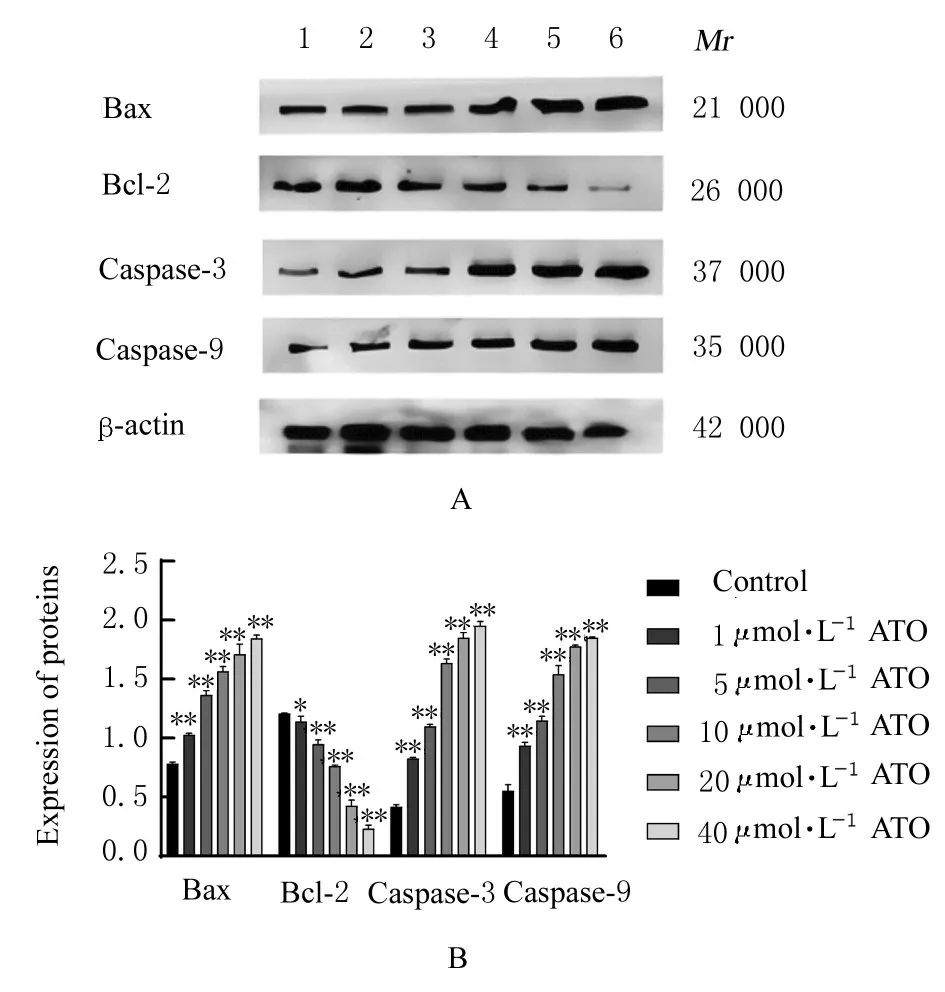
图7 各 组CAL-27 细 胞 中Bax、Bcl-2、Caspase-3 和Caspase-9 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram(A) and histogram(B) of expressions of Bax, Bcl-2, Caspase-3, and Caspase-9 proteins in CAL-27 cells in various groups detected by Western blotting method
3 讨 论
舌鳞癌由于其丰富的淋巴循环以及缺少筋膜组织,易发生淋巴结转移和扩散[11],与其他类型口腔癌症比较预后较差。为寻找更好的治疗方法,研究者对于舌鳞癌分子靶向治疗药物的研究开始逐渐深入。他汀类药物通过多种信号通路阻断癌症的发展[12],ATO 是他汀类药物中最具代表性的药物,能够通过抑制肿瘤细胞增殖及诱导肿瘤细胞凋亡[13]、自 噬[14]和周期阻滞[15]等相关通路发挥抗癌作用。但其对舌鳞癌的影响及机制尚不清楚。
本研究中CCK-8 实验和克隆形成实验检测结果表明:ATO 对CAL-27 细胞的细胞增殖有抑制作用。研究[16]显示:P53-P21 转录轴对癌细胞具有负调控作用,可以调节下游多种转录因子,从而实现对癌症的调控作用。CDK6 是细胞转录因子作用靶点,CDK6 活化异常时,细胞周期调节紊乱,导致细胞异常增殖[17],而激活P53-P21 转录轴的表达可以显著抑制CDK6 的异常活化,达到抑制癌细 胞 增 殖 的 作 用[18]。本 研 究 中Western blotting 法检测结果显示:ATO 处理后的CAL-27 细胞中 P53和P21 蛋白表达上调,CDK6 蛋白表达下调,表明ATO 激活了P53-P21 转录轴的表达,进而抑制CDK6 的活化,与相关研究[18]结果一致。因此,ATO 通过调控P53/P21/CDK6 信号通路发挥对CAL-27 细胞增殖的抑制作用。
凋亡是一种细胞的程序性死亡,在该过程中,细胞内特定机制以一种有序、受控的方式终止细胞的存在[19]。本研究中的Hoechst33342 染色和流式细胞术检测结果显示:ATO 处理后的CAL-27 细胞发生明显凋亡,且呈浓度依赖性。线粒体凋亡是凋亡途径中最常见的一种,主要通过Caspase 级联反应诱导肿瘤细胞凋亡[20]。Bcl-2 是一种主要分布于细胞核和线粒体膜的抗凋亡蛋白,Bax 是主要分布于细胞质的促凋亡蛋白,2 种蛋白比例失衡将导致Caspase-3 和Caspase-9 的异常表达,阻碍肿瘤细胞 的 凋 亡[21-22]。Bax 是P53 的 重 要 转 录 靶 点,P53表达上调可引起Bax 表达上调和Bcl-2 表达下调,从而促使Caspase-3 和Caspase-9 的表达,进而诱导肿 瘤 细 胞 凋 亡[23]。本 研 究 中Western blotting 法 检测结果显示:经ATO 处理后的CAL-27 细胞中,Bax 表 达 上 调,Bcl-2 表 达 下 调,Caspase-3 和Caspase-9 蛋白表达上调,表明ATO 通过调节Bax/Bcl-2 比值促进CAL-27 细胞凋亡。
综上所述,ATO 作为一种常见降血脂药,可以抑制舌鳞癌CAL-27 细胞增殖和迁移并且诱导凋亡,其机制可能与P53/P21/CDK6 通路和上调Bax/Bcl-2 比值有关,表明ATO 可能在舌鳞癌治疗方面具有一定的应用前景。
