白三烯C4及2型固有淋巴细胞在支气管肺发育不良中的变化及意义
2023-05-04尧惠慈卢红艳
季 玮,朱 玥,尧惠慈,卢红艳
江苏大学附属医院 儿科,江苏 镇江 212001
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的呼吸系统疾病,病理特征主要是肺发育受阻及肺微血管发育不良,具体作用机制尚不清楚[1]。研究发现,大量促炎因子存在于BPD患儿的气道分泌物[2],表明炎性反应仍为BPD发生发展的重要环节。
2型固有淋巴细胞(type 2 innate lymphoid cell,ILC2)是2型炎性反应的重要效应细胞[3]。本课题组前期研究发现,ILC2参与了BPD气道炎性反应的过程[4],但具体作用机制不明确。近年发现,白三烯C4(leukotriene C4,LTC4)可与半胱氨酸白三烯受体1(cysteinyl leukotriene receptor 1,CysLT1R)结合作用于ILC2发挥生物学作用,但研究主要集中在哮喘、过敏性鼻炎等疾病[5],在BPD中尚无报道。因此,本研究通过建立 BPD模型小鼠,对此进行研究,为深入研究BPD的发病机制和防治策略提供思路。
1 材料和方法
1.1 材料
1.1.1 动物:SPF级C57BL/6小鼠(江苏大学实验动物中心),研究经江苏大学动物伦理委员会批准[许可证号为SYXK(苏)2018-0053]。
1.1.2 主要试剂:兔多克隆白三烯C4合酶(leukotriene C4-synthase,LTC4S)抗体(NOVUS生物公司);小鼠单克隆β-actin抗体(CST公司);兔多克隆SPD抗体(Bioss公司);小鼠单克隆膜黏蛋白[podoplamin(PDPN)/T1α]抗体(Santa Cruz公司);HRP标记山羊抗兔IgG抗体、HRP标记山羊抗小鼠IgG抗体、蛋白酶抑制剂、红细胞裂解液(Beyotime公司);Lineage-AF700单克隆抗体、CD90.2-PE单克隆抗体、CD45-BV510单克隆抗体(Biolegend公司);CysLT1R-FITC多克隆抗体(Cayman公司);引物(生工生物工程股份有限公司);SDS-PAGE、预染蛋白marker、荧光定量PCR试剂(诺唯赞生物科技股份有限公司);LTC4 ELISA试剂盒(酶免生物科技有限公司);IL-5、IL-13 ELISA试剂盒(Elabscience公司);IL-4(联科生物技术股份有限公司);Trizol裂解液(Ambion公司)。
1.2 方法
1.2.1 小鼠的分组及处理:按参考文献[6]复制BPD模型,将小鼠随机分为空气组和高氧组,每组9只,高氧组置于85%密闭氧气盒1、7及14 d,空气组置于同一室内空气下,每个时间点随机取3只小鼠。
1.2.2 HE染色:石蜡切片用二甲苯溶液脱蜡并在乙醇溶液中放置2 min,利用苏木精和伊红(HE)经肺组织进行染色,正常脱水后,对切片进行透明处理并密封,在光学显微镜下观察染色结果。
1.2.3 流式细胞检测术检测单细胞悬液中ILC2及CysLT1R+ILC2含量:将肺组织制成单细胞悬液,用流式表面抗体Lin-CD90.2+CD45+标记ILC2,Lin-CD90.2+CD45+CysLT1R+标记CysLT1R+ILC2, 4 ℃避光30 min,洗涤,离心,弃上清,加入200 μL PBS,24 h内用流式细胞仪进行检测,应用FlowJo V10进行结果处理与分析。
1.2.4 ELISA检测肺组织中LTC4、IL-4、IL-5及IL-13含量:用PBS冲洗肺组织以除去残留血液,将肺组织置于离心管中,剪碎,利用高通量组织研磨器制为组织匀浆,4 ℃ 3 000 r/min 离心20 min,收集上清液,严格按照ELISA试剂盒说明检测LTC4、IL-4、IL-5及IL-13含量。
1.2.5 Western blot检测肺组织LTC4S蛋白表达:取肺组织30 mg,加入RIPA裂解液中制备组织匀浆,4 ℃离心取上清,加load buffer后封煮10 min分装至-20 ℃保存。每孔加入10 μL蛋白质样品行电泳、转膜及封闭,加入一抗兔多克隆LTC4S抗体(1∶500)、小鼠单克隆β-actin抗体(1∶1 000)4 ℃孵育过夜,加入山羊抗兔IgG抗体(1∶5 000)、山羊抗小鼠IgG抗体(1∶5 000)37 ℃恒温摇床分别孵育1 h,凝胶成像仪曝光显影。
1.2.6 RT-qPCR检测肺组织LTC4S、CysLT1R mRNA表达:取肺组织30 mg,用Trizol法提取总RNA,用紫外分光光度法测定RNA浓度和纯度,可至-80 ℃冰箱保存,引物序列见(图表)。按照反转录试剂盒说明将RNA反转录为cDNA。使用SYBR Green进行实时荧光定量,检测目标基因mRNA水平的表达情况。
1.3 统计学分析
2 结果
2.1 肺组织病理形态学改变
与空气组相比,随着高氧暴露时间延长,高氧组肺泡数量减少、体积增大,肺泡间隔中断,间质水肿,部分融合,肺泡结构简单化,肺泡壁增厚(图1)。
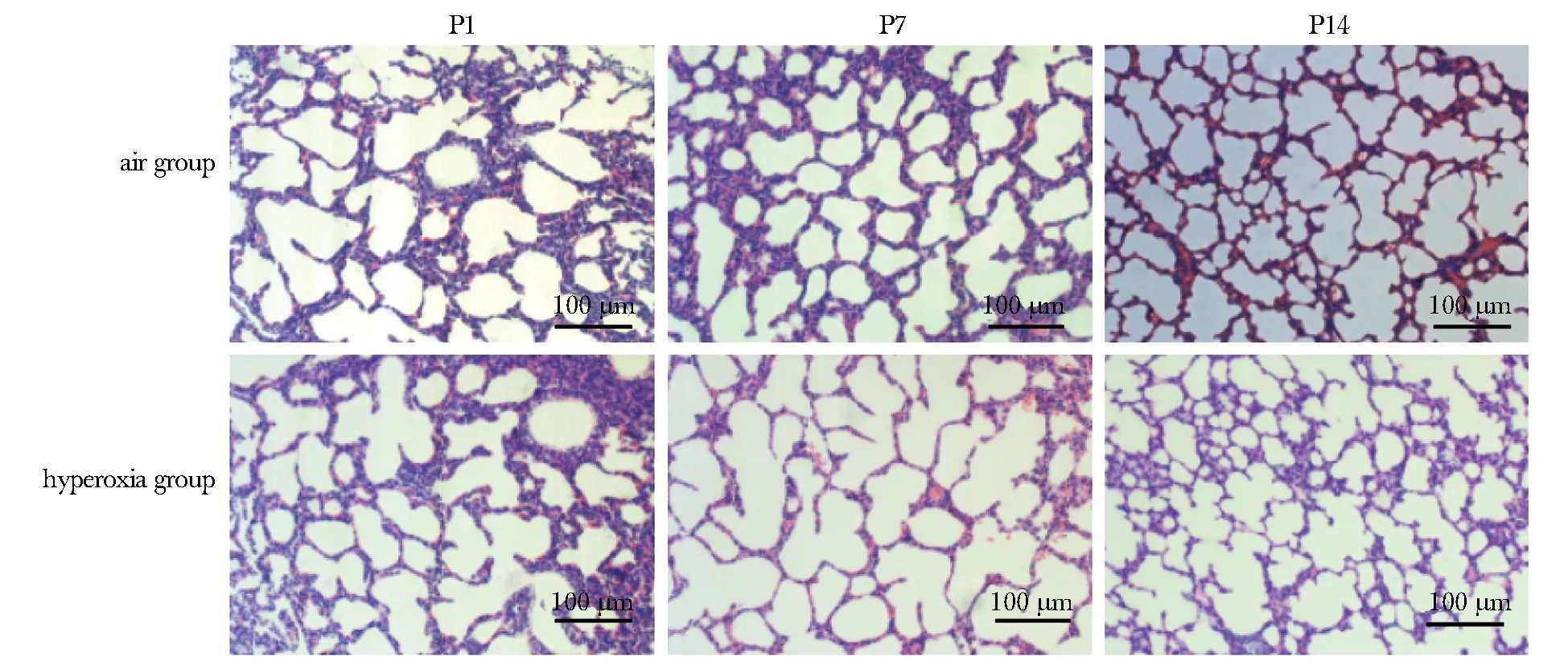
P1.day 1 after birth; P7.day 7 after birth; P14.day 14 after birth
2.2 BPD小鼠肺组织ILC2及CysLT1R+ILC2动态变化情况
随着高氧暴露时间延长,高氧组ILC2及CysLT1R+ILC2呈现增高趋势,各时间点均高于同时间点空气组(P<0.05)(图2)。
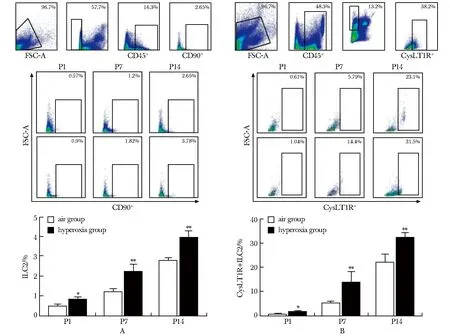
P1.day 1 after birth; P7.day 7 after birth; P14.day 14 after birth; A.percentages of ILC2 in mice lung tissue by flow cytometry; B.percentages of CysLT1R+ILC2 in mice lung tissue by flow cytometry;*P<0.05,**P<0.01 compared with air group
2.3 BPD小鼠肺组织LTC4、IL-4、IL-5、IL-13含量变化
随着高氧暴露时间延长,高氧组LTC4、IL-4、IL-5、IL-13含量均呈时间依赖性逐渐增高(P<0.05)(图3)。
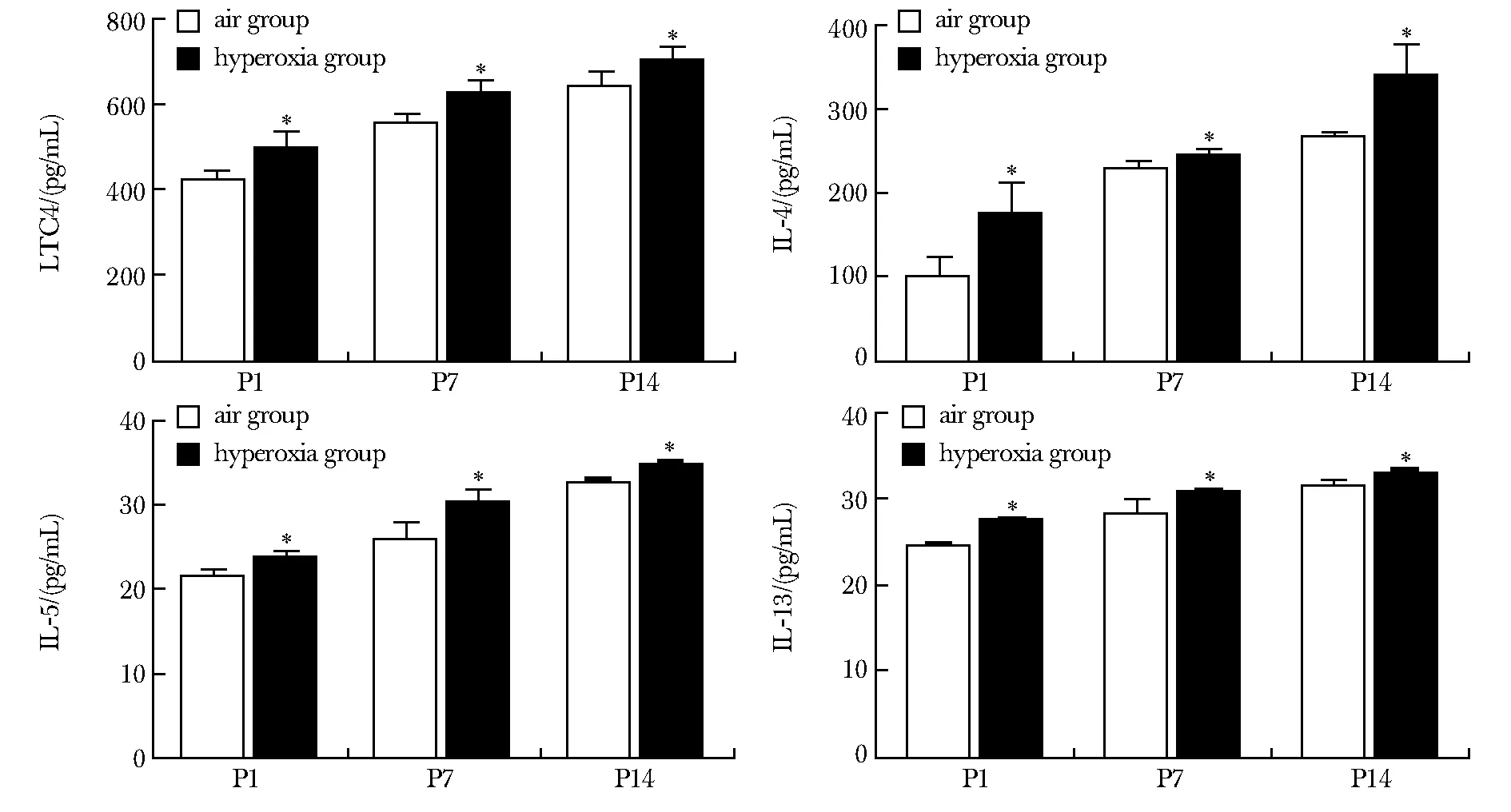
P1.day 1 after birth; P7.day 7 after birth; P14.day 14 after birth;*P<0.05 compared with air group
2.4 BPD小鼠肺组织LTC4S蛋白表达变化
随着高氧暴露时间延长,高氧组LTC4S蛋白表达呈时间依赖性逐渐上升(P<0.05)(图4)。

P1.day 1 after birth; P7.day 7 after birth;P14.day 14 after birth; A.expression of LTC4S protein; B.comparison of LTC4S protein expression level;*P<0.05 compared with air group
2.5 BPD小鼠肺组织LTC4S、CysLT1R mRNA表达情况
随着高氧暴露时间延长,高氧组LTC4S、CysLT1R mRNA表达均逐渐增加,高于同时间点空气组(P<0.05)(图5)。
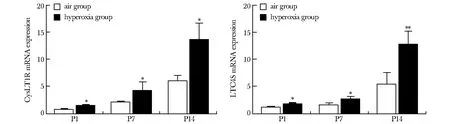
P1.day 1 after birth; P7.day 7 after birth; P14.day 14 after birth;*P<0.05,**P<0.01 compared with air group
3 讨论
BPD是早产儿严重的肺部并发症,发病机制尚不明确,其幸存者往往伴有认知与行为障碍等后遗症,因此,研究BPD发病机制对于预防和治疗BPD至关重要[1]。本研究利用高氧暴露建立小鼠BPD模型,发现高氧组小鼠肺组织肺泡减少、增大及简化,肺泡壁增厚,符合BPD的病理表现,提示造模成功。
炎性反应在BPD发生发展中起重要作用[1]。1型炎性反应在BPD的作用已有大量研究,但2型炎性反应却知之甚少[7]。ILC2作为2型免疫的关键细胞,释放多种细胞因子介导炎性反应过程[3]。本研究发现,高氧组ILC2逐渐增加,进一步检测相关细胞因子发现,高氧组IL-4、IL-5及IL-13表达水平也增加,与ILC2变化趋势相同,这与报道[8]的在高氧小鼠肺组织中研究结果一致,提示ILC2参与BPD炎性反应,并释放IL-4、IL-5及IL-13进一步促进肺部炎性反应。
在多种疾病中发现,ILC2不仅接受IL-33、IL-25和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)直接刺激,也对前列腺素D2(prostaglandin D2,PGD2)及半胱氨酸白三烯(cysteinyl leukotrienes,CysLTs)有反应[5]。早期研究表明BPD患儿呼吸道中CysLTs升高[9]。近年发现,LTE4在BPD患儿尿液中显著上升[10],LTB4在博来霉素所致BPD样损伤中促进肺部炎性反应[11],但LTC4在BPD中的具体作用尚不明确。本研究发现,与空气组相比,高氧组LTC4含量、LTC4S蛋白及mRNA表达均增加,且随高氧暴露时间延长,增加越明显,提示LTC4参与BPD炎性反应过程,具体作用机制尚不明确。
据研究,在哮喘、慢性鼻窦炎、过敏性鼻炎等多种呼吸道疾病中CysLTs增加并促进ILC2及IL-4、IL-5等细胞因子的释放[12-13],但CysLTs是否激活ILC2促进BPD肺部2型炎性反应尚不清楚。肺ILC2可表达CysLT1R,其可与CysLTs结合促进炎性细胞聚集和炎性介质释放诱发气道高反应性引起气道重塑,在气道炎性反应中发挥重要作用[14]。本研究发现,与空气组相比, 高氧组CysLT1R+ILC2表达增加,与CysLT1R mRNA表达趋势相同,提示LTC4可能通过CysLT1R激活ILC2。
综上所述,在高氧诱导的小鼠BPD模型中,LTC4及ILC2在气道炎性反应中发挥重要作用,LTC4可能通过CysLT1R激活ILC2释放2型细胞因子介导肺部炎性反应,但仍需进一步研究。靶向LTC4及ILC2介导的2型细胞因子通路抑制剂可能在BPD患儿中具有应用价值。
