BM-MSCs来源外泌体介导铁死亡减轻大鼠心肌细胞系H9c2缺氧/复氧损伤
2023-05-04陆珏秀刘先霞
闫 霖,陆珏秀,罗 颖,刘先霞
海南医学院第二附属医院 心血管内科,海南 海口 570100
急性心肌梗死(acute myocardial infarction,AMI)是心血管系统的急症和重症,发病率和病死率居高不下,及时开通罪犯血管是治疗心梗的首选策略[1]。然而在心梗血运重建后的再灌注过程可能会导致心脏损伤进一步加重,出现心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI)[2]。近年来,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)移植治疗作为一项前沿的临床新技术,逐渐应用于心肌缺血/再灌注治疗领域[3]。越来越多的研究证据表明,BM-MSCs可通过旁分泌大量细胞因子、外泌体(exosomes, exos),发挥抗炎、促进细胞增殖、减少凋亡、诱导血管新生和心肌再生等作用[4-5]。
外泌体是由细胞分泌的直径30~150 nm的盘状囊泡,可携带多种蛋白、mRNA、lncRNA、miRNA等,并参与到细胞之间的通讯[6]。外泌体能够通过配体/受体直接识别,或经胞饮、胞吞及与受体细胞膜融合等多种方式调控复杂的细胞生物学功能[7]。初步研究表明外泌体在MSCs旁分泌途径治疗心肌缺血及再灌注损伤过程中发挥重要的作用[8]。因此,本文将从细胞层面探讨BM-MSCs来源外泌体(BM-MSCs-derived exosome,BM-MSCs-exo)对缺气/复氧(anoxia-reoxygenation,A/R)心肌细胞损伤的保护作用及其可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞: 大鼠心肌细胞系(rat cardiomyoblast cell line,H9c2)、大鼠骨髓间充质干细胞(BM-MSCs)(中国科学院细胞库)。
1.1.2 主要试剂: 一抗TSG101、CD81、CD9、GPX4、SLC7A11、TFR1和GAPDH(CST公司);铁死亡诱导剂Erastin(MCE生物科技公司);铁死亡生化试剂盒包括丙二醛(malondialdehyde,MDA)检测试剂盒、Fe2+离子检测试剂盒和谷胱甘肽(glutathione,GSH)检测试剂盒(北京普莱利基因技术有限公司);胎牛血清、DMEM培养基(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 BM-MSCs外泌体(BM-MSCs-exo)的获取与鉴定:采用梯度离心法提取BM-MSCs来源外泌体。待BM-MSCs增殖至80~90%汇合度,更换不含FBS的DMEM培养基,在37 ℃、5% CO2条件下培养24 h后收集上清。在4 ℃下分别经300×g、2 000×g、12 000×g各离心30 min后,弃沉淀获得上清。浓缩的上清经超高速离心机110 000×g离心1h,获得外泌体沉淀。取少量PBS重悬外泌体沉淀,染色后在透射电镜下观察外泌体形态并拍照;Western blot检测外泌体标志蛋白TSG101、CD9、CD81的表达,连续上样3 次排除误差。
取对数增殖期H9c2细胞接种于6孔板中,大鼠BM-MSCs细胞接种于孔径为0.4 μm的Transwell小室中,并将完全培养基更换成PBS,然后将小室置入接种有H9c2细胞的培养板中,置于37 ℃、5% CO2恒温培养箱中进行共培养。使用PHK26红色荧光标记外泌体,荧光显微镜下观察H9c2 细胞对BM-MSCs-exos的内吞情况。
1.2.2 细胞的培养及分组处理:将H9c2细胞接种于细胞培养板中,置于5% CO2培养箱中(37 ℃恒温)培养,待细胞增殖至80~90%汇合度,将原高糖DMEM培养基替换成无血清的低糖DMEM,并在95% N2、5% CO2的缺氧环境中培养4 h,最后在10% FBS的高糖DMEM中复氧培养6 h,构建细胞A/R模型。
将H9c2 细胞分为对照组,A/R组(模型组),A/R+BM-MSCs-exo组(BM-MSCs-exo干预组,50 μg/mL),A/R+BM-MSCs-exo+ Erastin组(Erastin干预组,30 μmol/L)。每组设3个复孔,48 h后进行相关指标检测。
1.2.3 CCK-8检测细胞活力:取对数期细胞接种于96孔板中(5×103/孔),按实验方案处理后加入CCK-8溶液培养2~4 h,去上清后加入DMSO,采用酶标仪检测450 nm处的A值。数据分析,H9c2细胞活力(%)=(A450实验组-空白组)/(A450对照组-空白组)×100%。
1.2.4 EdU细胞增殖的检测:取对数期细胞接种于96孔板中(5×103/孔)。采用EdU试剂A标记细胞,2 h后用 4%多聚甲醛固定30 min, 并以0.1% Triton-X-100通透30 min, 最后使用Apollo染色反应液37 ℃避光孵育30~60 min,在荧光倒置显微镜下观察细胞增殖情况。
1.2.5 铁死亡相关指标的检测:根据实验方案处理细胞并获取细胞上清,根据铁死亡相关试剂盒说明书步骤,采用生化法检测Fe2+、MDA、GSH含量。
1.2.6 Western blot检测蛋白质:使用RIPA裂解液裂解H9c2细胞,收集细胞总蛋白质进行BCA蛋白质定量。经SDS-PAGE 凝胶电泳分离后转移至PDVF膜上,用5 % BSA封闭1 h,然后与一抗(GPX4, 1∶1 000,SLC7A11, 1∶1 000,TFR1,1∶1 000,GAPDH, 1∶1 000,)在4 ℃摇床孵育过夜,最后山羊抗兔二抗IgG(1∶5 000)反应1 h,通过ECL超敏化学发光显影液曝光蛋白质条带。
1.2.7 DCFH-DA法检测活性氧(reactive oxygen species, ROS):用荧光探针2’,7’-二氢二氯荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)标记H9c2细胞,DCFH被ROS氧化生成荧光物质2’-7’二氯荧光素(2’,7’-dichlorofluorescein,DCF),应用流式细胞仪检测DCF荧光强度。
1.3 统计学分析
2 结果
2.1 外泌体的表征
BM-MSCs-exos呈圆形形态,直径约120 nm(图1A),并表达外泌体标志蛋白TSG101,CD81、CD9 (图1B);H9c2细胞可内吞BM-MSCs-exos(图1C)。

A.electron microscopic graphs of the exosomes; B.expression of the exosome marker proteins; C.immunofluorescence image of the exosomes
2.2 外泌体减轻A/R诱导的心肌细胞损伤
与对照组相比,A/R组细胞活力和增殖活性显著降低(P<0.05);与A/R组比较,A/R+ BM-MSCs-exo组细胞在BM-MSC-exos干预后,细胞活力和增殖活性得到显著增强(P<0.05)(图2)。
2.3 外泌体抑制A/R诱导的心肌细胞铁死亡
与对照组相比,A/R组心肌细胞铁死亡标志蛋白GPX4、SLC7A11表达及GSH含量降低,TFR1蛋白表达及Fe2+、MDA、ROS水平升高(P<0.05);与A/R组相比,A/R+ BM-MSCs-exo组细胞在BM-MSC-exos干预后,GPX4, SLC7A11蛋白表达及GSH含量升高,TFR1蛋白表达及Fe2+、MDA、ROS水平升高降低(P<0.05)(图3)。
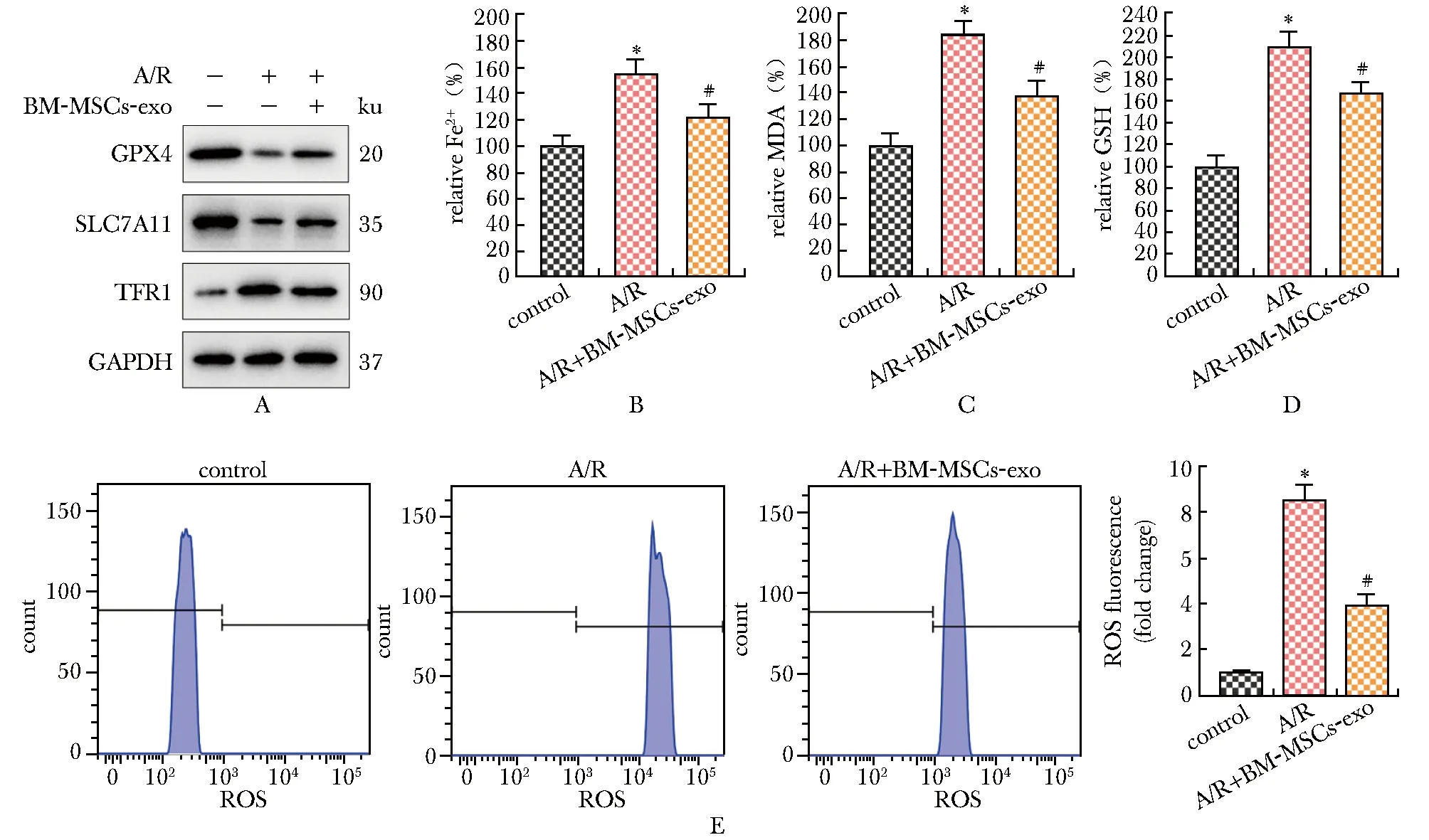
A.expression of ferroptosis related proteins; B-D.the levels of Fe2+ ions, MDA and GSH; E.fluorescence intensity of ROS; *P<0.05 compared with control group;#P<0.05 compared with A/R group
2.4 外泌体通过细胞铁死亡改善心肌细胞损伤
与A/R+ BM-MSCs-exo组相比,A/R+ BM-MSCs-exo+Erastin组细胞活力与增殖活性显著降低(P<0.05)(图4)。
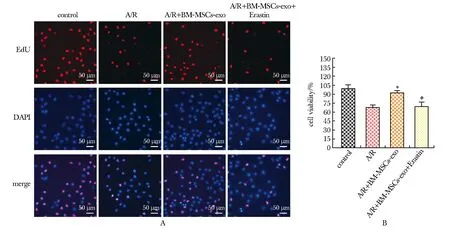
A.cell proliferation capacity test; B.CCK-8 assay; *P<0.05 compared with A/R group;#P<0.05 compared with A/R+BM-MSCs-exo group
3 讨论
外泌体(exosomes)主要来源于细胞内溶酶体内陷形成的多囊泡体,囊泡外膜经与细胞膜融合后释放到胞外基质中介导细胞通讯。外泌体可通过其携带的多种蛋白、核酸、脂类等来调节受体细胞的生物学功能[9-10]。目前越来越多的研究报道证实间充质干细胞来源的外泌体能够促进细胞增殖,诱导血管新生和抗凋亡,从而促进心肌梗死后的心脏修复进程[11-12]。本研究通过观察H9c2细胞内吞BM-MSCs-exos后的功能变化,发现A/R损伤的H9c2细胞在内吞外泌体后细胞活力和增殖能力得到显著改善。本研究的实验结果与国内外报道的相关文献一致,外泌体能改善A/R损伤的心肌细胞功能,但其具体机制有待于进一步研究探讨。
心肌缺血/再灌注损伤的病理生理机制与氧化应激、细胞内钙超载、能量代谢障碍、内质网应激、凋亡、铁死亡(ferroptosis)等密切相关[13]。其中,铁死亡是近年来提出的一种新型细胞死亡方式,被定义为细胞内异常铁代谢导致的活性氧堆积和脂质过氧化引起的调节性细胞死亡[14]。研究发现缺血/再灌注(ischemia-reperfusion,I/R)损伤可引起大鼠心肌细胞出现脂质过氧化损伤并死亡,且这种细胞死亡方式受铁死亡抑制剂ferrostatin-1影响[15]。由此可知,心肌细胞铁死亡在MI/RI进程中扮演重要角色。本研究结果显示,BM-MSCs来源外泌体在改善H9c2心肌细胞A/R损伤的同时,发现铁死亡标志物在细胞A/R过程中升高,而在外泌体干预后铁死亡现象被抑制,佐证了外泌体对H9c2细胞A/R损伤的保护作用与铁死亡密切关联。为了进一步验证BM-MSCs来源外泌体对A/R诱导的心肌细胞损伤的保护作用是通过抑制铁死亡介导,本实验在BM-MSCs来源外泌体干预的同时使用Erastin诱导铁死亡,发现A/R心肌细胞的保护作用被显著逆转,推测得到进一步证实。
综上,BM-MSCs来源外泌体可通过抑制细胞铁死亡发挥对H9c2细胞A/R损伤的保护作用。虽然本实验研究仅局限于细胞层面,但相信随着体内实验的开展以及对分子机制的深入探索,将为临床上急性心梗及再灌注损伤的间充质干细胞移植治疗提供新的见解。
