神经节苷脂GD2可作为肺癌干细胞一个潜在的候选标志物
2023-05-04段昭君罗云萍
李 珍,段昭君,罗云萍
中国医学科学院基础医学研究所 北京协和医学院基础学院 免疫学系,北京 100005
在所有恶性肿瘤中,肺癌已经成为发病第二位,死亡第一位的恶性肿瘤,严重威胁人们生命健康[1]。随着肺癌筛查的扩大、放射技术的改进以及治疗的进步,肺癌治疗方法发生了显著的变化,除了传统的外科治疗、放疗和化疗之外,还发展出了分子靶向治疗以及免疫治疗[2]。然而,肺癌的预后却依然不容乐观,中晚期患者的5年生存期仅为5%[3-4],其中一个关键因素是肿瘤内的肿瘤干细胞驱动了癌细胞的远处转移[4]。
肿瘤干细胞(cancer stem cells, CSCs)是一小群拥有高致瘤性、增殖分化潜能和自我更新能力的肿瘤细胞亚群,同时也是肿瘤起始、转移和复发的根本原因[5]。因此,为了改善肺癌患者的长期预后效果,靶向CSC开发新的治疗策略成为了肿瘤基础与临床研究的热点。据文献报道,已知的肺癌干细胞(lung cancer stem cells, LCSCs)的细胞表面标记有CD44、EpCAM和CD133等,但这些标记分子在正常细胞上也同样表达[6-7],这种特点使得它们在临床上的应用受限。
神经节苷脂GD2是一种含有两个唾液酸的糖鞘脂,在内质网和高尔基体中合成后被转移到细胞膜表面,并由限速酶GD3合成酶(GD3 synthase, GD3S)调控其表达[8]。GD2仅低密度表达于中枢神经系统,周围神经系统和皮肤黑素细胞等正常组织,却在许多种肿瘤中高度表达,因此被认为是肿瘤相关抗原(tumor-associated antigen, TAA)[9]。在肿瘤中,GD2能够促进肿瘤细胞的增殖、运动、迁移、黏附和侵袭[10],并且,GD2已被证实表达于乳腺癌干细胞(breast cancer stem cells, BCSCs)[8, 11]。综上,GD2有望为CSC免疫治疗提供有效的靶抗原。所以,本研究检测了多种肺癌干细胞上GD2的表达,选取GD2表达丰度最高的人肺腺癌细胞系A549为细胞模型,探索GD2作为肿瘤干细胞标志物的可能性,以期为肺癌干细胞的免疫治疗提供靶点。
1 材料和方法
1.1 材料
1.1.1 细胞系:人肺癌细胞系H2170、H446、H1975、H1299和人肺腺癌细胞系A549(ATCC)。
1.1.2 实验动物: SPF级6~8周龄雄性裸鼠(中国医学科学院基础医学研究所实验动物中心)。
1.1.3 试剂:胎牛血清、100×青霉素链霉素(Gibco公司);RPMI1640培养基(Biological Industries公司);低吸附6孔板(Corning公司);成球培养基(Stem Cell公司);GD2抗体(LifeSpan生物科技公司);流式抗体:CD44-APC、EpCAM-FITC、Mouse-FITC和Mouse-APC(Biolegend公司);RNA快速提取试剂盒(奕杉生物科技有限公司);RT-qPCR试剂盒和qPCR试剂盒(全式金生物技术有限公司);一抗Nanog、Oct4和β-actin(Cell Signaling Technology公司);抗体GD3S(Proteintech公司);CCK8检测试剂盒(碧云天生物技术有限公司);结晶紫染液(索莱宝生物科技有限公司)。
1.2 方法
1.2.1 细胞系培养:细胞系H2170、H446、H1975、H1299和A549均使用含有10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的RPMI1640培养基培养。细胞增殖至合适密度后以1∶3的比例进行细胞传代培养。
1.2.2 细胞系的成球培养:将贴壁培养的肿瘤细胞消化成单个细胞,用PBS重悬后进行细胞计数。向低吸附6孔板的每个孔中加入2 000个肿瘤细胞,并用无血清的成球培养基培养。在37 ℃,5% CO2的孵箱中培养7~10 d后收集所有肿瘤细胞球。
1.2.3 流式细胞测量术检测肿瘤细胞表面分子的表达:将待检测的肿瘤细胞制备成细胞浓度为1×109个/L的单细胞悬液,加入检测抗体(抗体∶细胞悬液=1∶100),4 ℃避光孵育30 min后使用PBS洗涤2次。用PBS重悬细胞,在2 h之内进行流式细胞测量术检测。所得数据均通过BD公司的FlowJo软件分析。
1.2.4 RT-qPCR检测干性相关基因及GD3S基因的mRNA表达:使用RNA提取试剂盒分别提取贴壁细胞和肿瘤细胞球的RNA。根据反转录试剂盒说明书将1 μg RNA反转录获得cDNA。以β-actin为内参,利用SYRB Green法进行real-time PCR检测,并且分析相关基因在RNA水平的相对表达量。
1.2.5 蛋白质免疫印迹法检测干性相关蛋白及GD3S的表达:收取贴壁细胞和肿瘤细胞球的总蛋白质,测定蛋白质浓度后进行SDS-PAGE,每孔蛋白质上样量为40 μg。电泳结束后采用湿转法转膜至PVDF膜,封闭后分别孵育一抗Nanog、Oct4、GD3S和β-actin过夜。次日洗膜后孵育二抗1 h,再次洗膜后滴加显影液并拍摄蛋白条带。
1.2.6 流式细胞测量术分选A549细胞中GD2-和GD2+细胞亚群:将待分选的单细胞悬液的浓度调整为1×1010个/L,加入抗体(抗体∶细胞悬液=1∶100),4 ℃避光孵育45 min,PBS洗涤2遍后重悬细胞,尽快使用MA900流式分选仪分选目标细胞。
1.2.7 CCK8法检测细胞体外增殖:将GD2-和GD2+A549细胞亚群的细胞浓度调整为1×109个/L,保证接种至96孔板中每个孔的细胞数量相同,接种完成后,十字形摇晃96孔板保证细胞分布均匀。待细胞全部贴壁后按照说明书测定0、24、48和72 h时的A值并进行数据分析。
1.2.8 Transwell小室法检测体外侵袭:用PBS重悬细胞并进行细胞计数,分别将2×105个GD2-A549和GD2+A549细胞铺入24孔小室。将小室悬挂于24孔板中,孔板中加入500 mL含有10%胎牛血清的完全培养基。培养10~12 h后,取出小室轻轻清洗,用多聚甲醛固定,再次清洗后采用结晶紫染料染色。染色结束后用蒸馏水清洗并用棉签擦干,在显微镜下观察并拍下迁移至小室膜外侧的细胞数。
1.2.9 细胞划痕愈合实验检测体外迁移:分别将3×105个GD2-A549和GD2+A549细胞铺入24孔板,待细胞汇合至90%时,使用黄枪头在孔板底部沿小孔直径垂直划线,划线后更换新鲜的完全培养基去除脱落的细胞。0、24和48 h内显微镜下观察孔内划痕宽度的变化,分别选取3个独立视野进行拍照并统计分析划痕愈合比例。
1.2.10 A549肺癌移植瘤模型的建立:将裸鼠随机分为2组,每组3只。将分选得到的GD2-和GD2+A549细胞制备成1×1010个/L的单细胞悬液。向每只裸鼠的右背侧部皮下接种200 μL细胞悬液。待肿瘤长出后,每隔2 d测量1次肿瘤大小。
1.3 统计学分析
2 结果
2.1 不同肺癌细胞系的肿瘤干细胞中GD2的表达情况
肿瘤干细胞的体外培养流程(图1A),原本贴壁培养的肿瘤细胞在经过成球培养后,具有干性的肿瘤细胞会存活并增殖形成漂浮的肿瘤球(图1B)。相较于贴壁状态的肺癌细胞,H2170和H446细胞的肿瘤球几乎不表达GD2,而H1975,H1299和A549细胞的肿瘤球展示了不同的GD2表达水平,其中A549细胞的肿瘤球中GD2的表达丰度最高(图1B)。
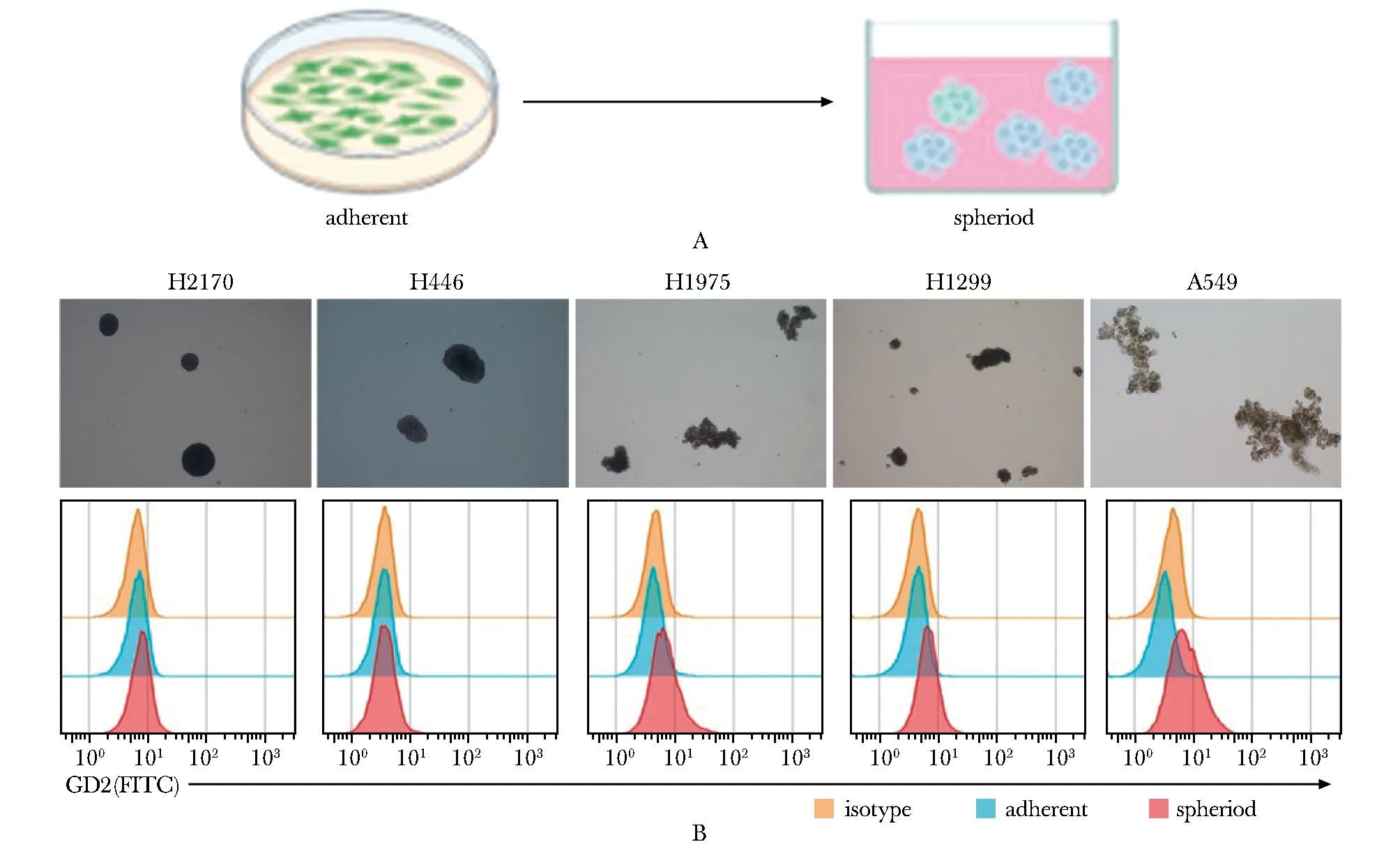
A.spheroid culturing; B.morphology of tumor spheres and the expression of GD2 in tumor sphere cells
2.2 A549肿瘤球细胞中GD2阳性细胞比例增高
相较于贴壁培养的A549肿瘤细胞,A549肿瘤球细胞的干性基因NANOG,SOX2和OCT4在基因水平的表达分别增加了9.03(P<0.01),1.67(P<0.05)和19.04倍(P<0.001),参与GD2合成过程的关键限速酶GD3S在基因水平的表达上升了4.58倍(P<0.01)(图2A)。在蛋白水平上,相比于贴壁状态下的A549细胞,A549肿瘤球中NANOG,OCT4和GD3S蛋白的表达显著升高(图2B)。与Isotype对照相比,贴壁培养的A549细胞几乎不表达GD2,而经过肿瘤球培养富集的A549肿瘤干细胞中GD2的表达水平从0.57%上升至20.4%(图2C)。
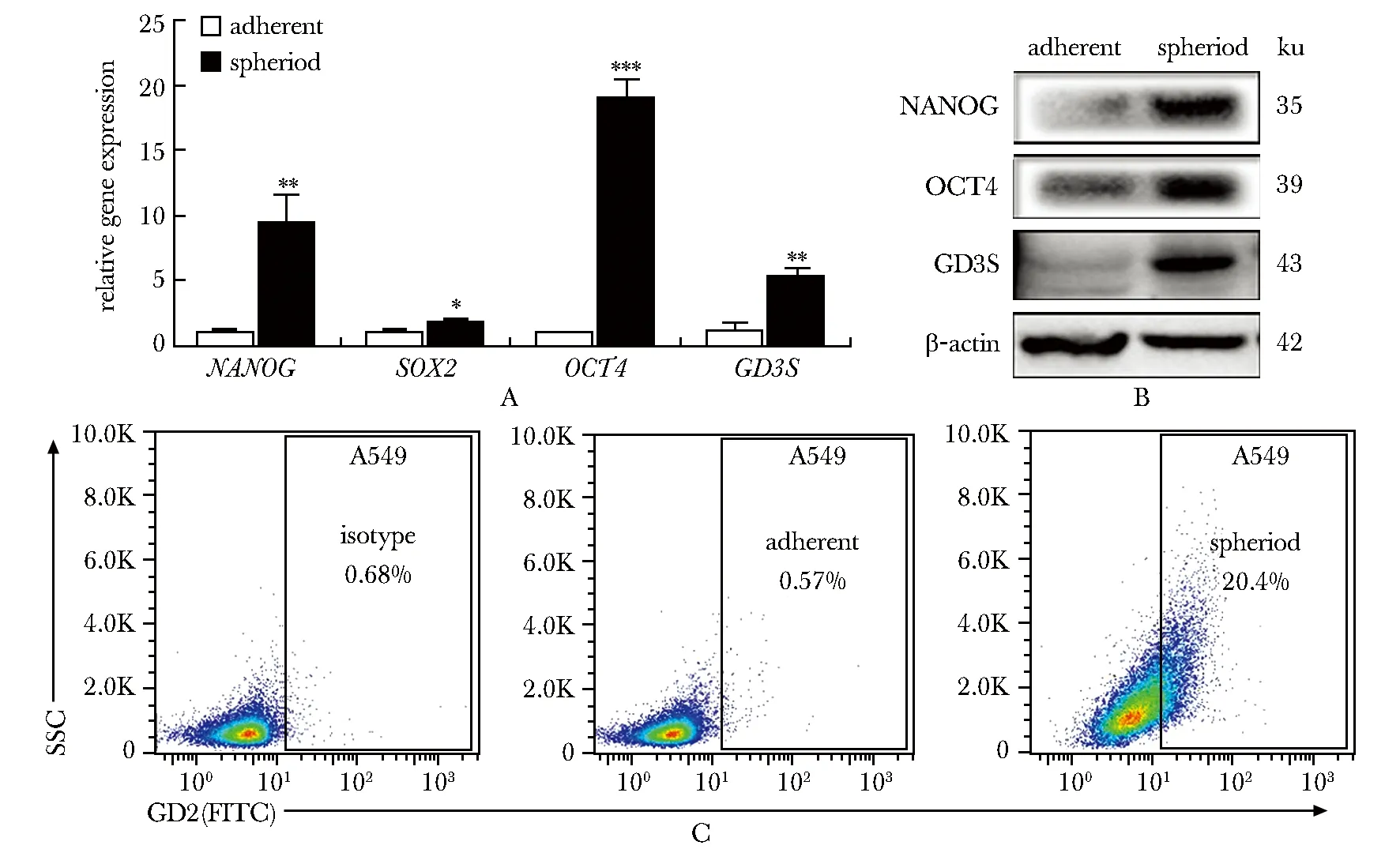
A.relative gene expression in A549 cells; B.relative protein expression in A549 cells; C.expression of GD2 in A549 cells; *P<0.05, **P<0.01, ***P<0.001 compared with adherent group
2.3 GD2+ A549细胞亚群的增殖、侵袭和迁移能力增强
相较于GD2-A549细胞, GD2+A549细胞表达的限速酶GD3S的mRNA是GD2-A549细胞的9.48倍(P<0.01)(图3A)。与GD2-A549细胞相比,GD2+A549细胞在24 h(P<0.05),48 h(P<0.01)和72 h(P<0.05)时的细胞增殖均快于GD2-A549细胞(图3B)。GD2+A549细胞侵袭至小室外侧的细胞显著增多(图3C),其结晶紫染色的覆盖率是GD2-A549细胞的1.81倍(P<0.05)。此外, GD2+A549细胞的划痕愈合比例要高于GD2-A549细胞(图3D),48 h时GD2+A549细胞的迁移能力是GD2-A549细胞的1.27倍(P<0.01)。
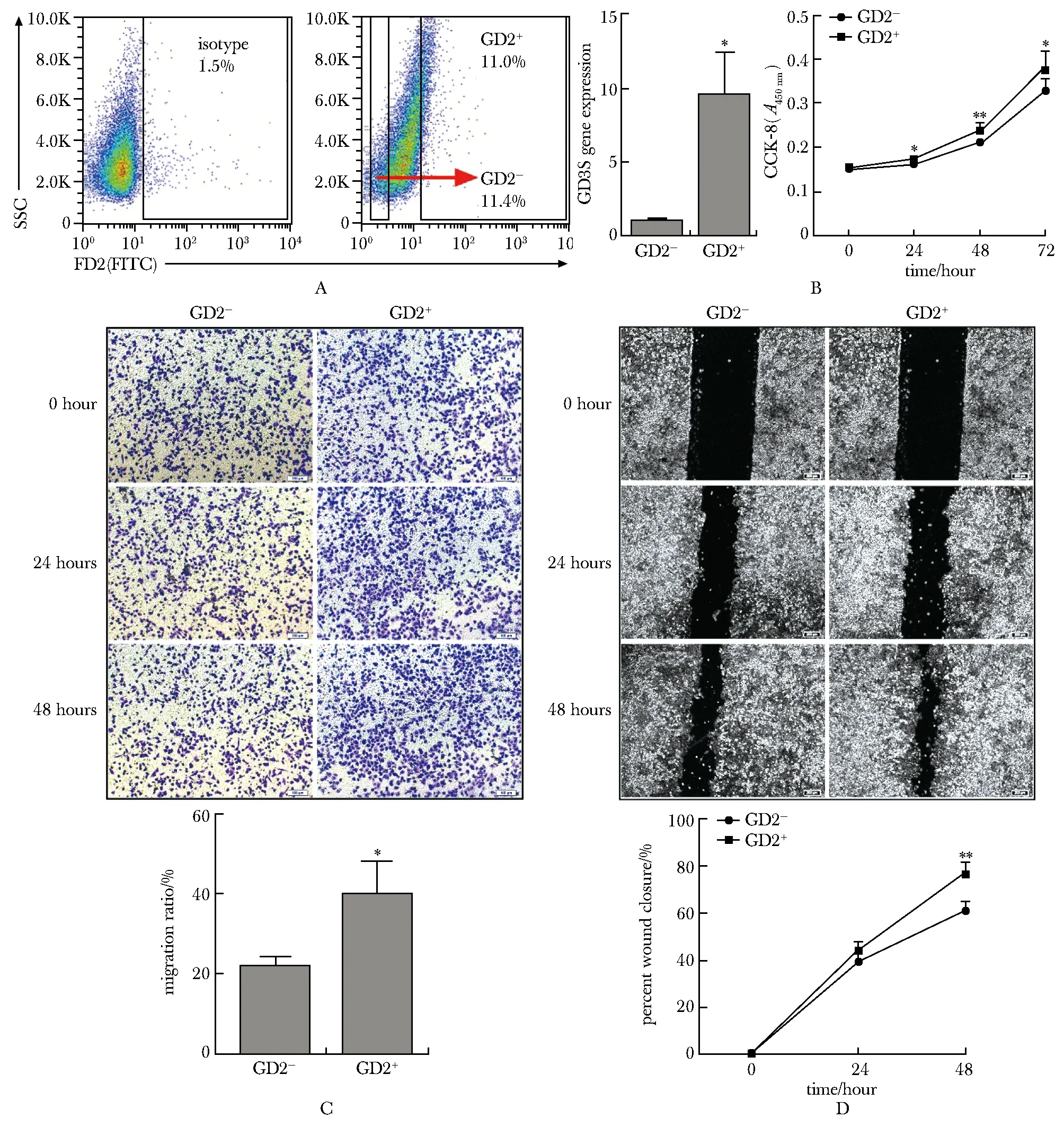
A.obtaining GD2-/GD2+ A549 cells by flow sorting; B.CCK8 assays of GD2-/GD2+ A549 cells; C.Transwell assays of GD2-/GD2+ A549 cells; D.wound healing assays of GD2-/GD2+ A549 cells; *P<0.05, **P<0.01 compared with GD2- group
2.4 GD2与肺癌干细胞表型CD44hi和EpCAM+密切联系
GD2+和GD2-A549细胞中CD44hi(CD44 high expression)的细胞比例分别为79.3%和17.1%,经统计,前者是后者的3.43倍(P<0.01)(图4A)。与此同时,CD44lo(CD44 low expression)A549细胞中仅有0.57%的细胞表达GD2,而CD44hiA549细胞中GD2+细胞比例高达34.4%,统计后是CD44loA549细胞的40倍(P<0.001)(图4B)。另外,相较于GD2-A549细胞,GD2+A549细胞中EpCAM的表达从2.67%上升到了11.2%,统计后其EpCAM+细胞的比例是GD2-A549细胞的4.13倍(P<0.001)(图4C)。最后,EpCAM-A549细胞中有2.67%的细胞表达GD2,而EpCAM+A549细胞的GD2+细胞比例达到了11.7%,统计后是EpCAM-A549细胞的4.13倍(P<0.001)(图4D)。
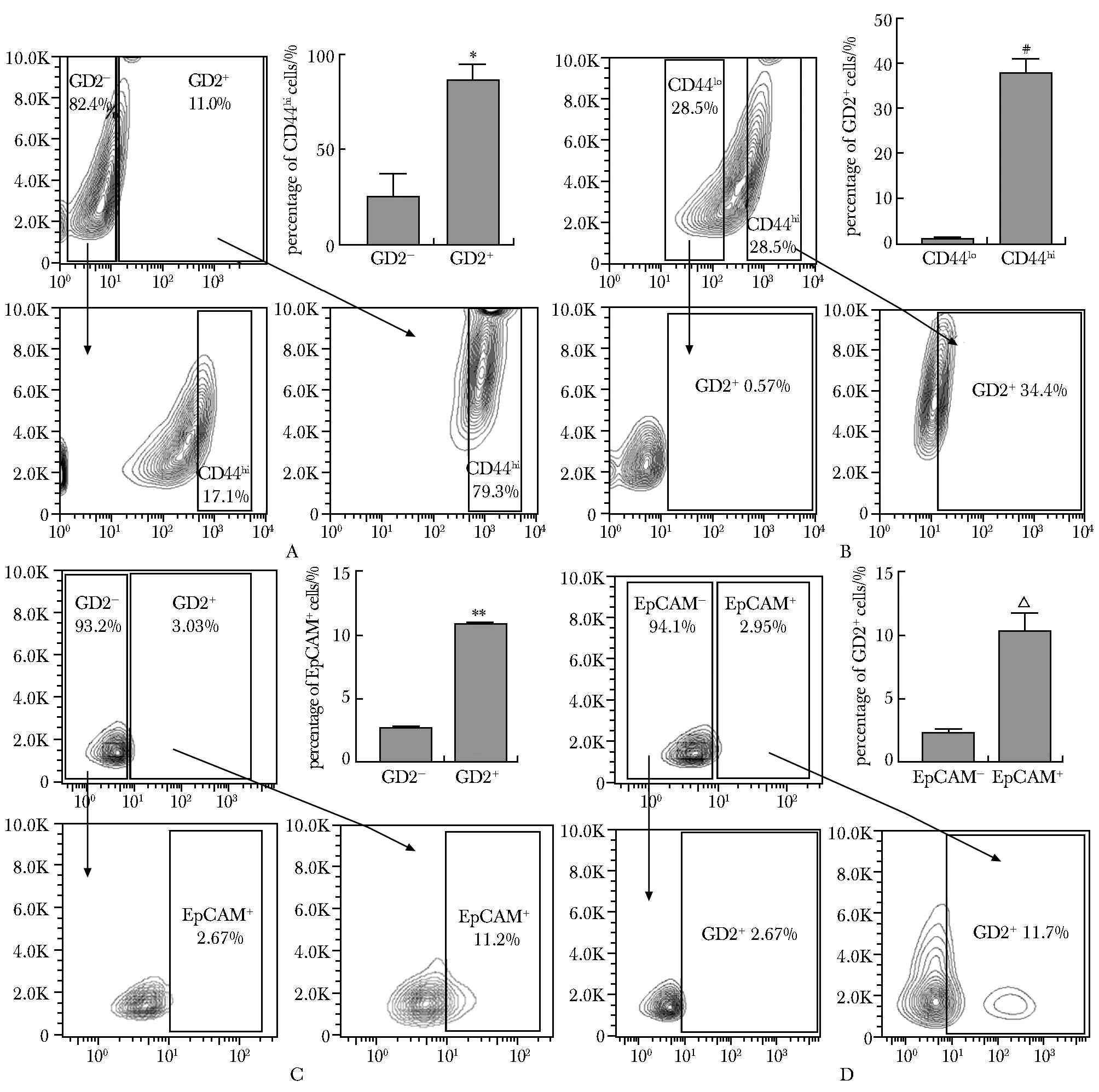
CD44hi.CD44 high expression; CD44lw.CD44 low expression; A.expression of CD44hi in GD2-/GD2+ A549 cells; B.expression of GD2 in CD44lo/CD44hi A549 cells; C.expression of EpCAM in GD2-/GD2+ A549 cells; D.expression of GD2 in EpCAM-/EpCAM+ A549 cells; *P<0.01, **P<0.001 compared with GD2- group;#P<0.001 compared with CD44lo group; △P<0.001 compared with EpCAM-group
2.5 GD2+ A549细胞形成的肿瘤恶性程度更高
相较于接种GD2-A549细胞,接种GD2+A549细胞后肿瘤的生长速度显著提高(P<0.001)(图5A),肿瘤的体积显著增大(图5B), GD2+A549肿瘤的质量是GD2-A549肿瘤的3.84倍(P<0.01)(图5C)。
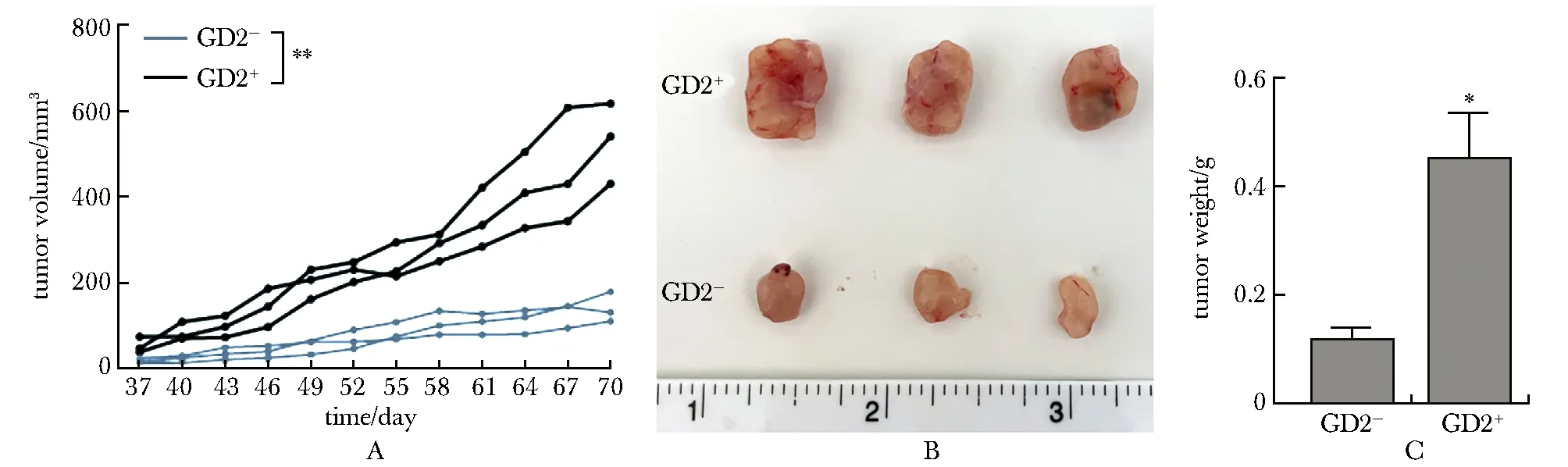
A.tumor growth curve; B.tumor images; C.tumor weight; *P<0.01, **P<0.001 compared with GD2- group
3 讨论
肿瘤干细胞是癌转移和复发的主要原因,目前用于肺癌治疗的治疗手段却未能根除CSC群体[6],因此,寻求一个特异性高的靶向肺癌干细胞的靶点可以提供一种更精确、更有效的治疗策略以清除CSC。本研究结果显示,在众多肺癌细胞系中,GD2的表达水平不尽相同,一方面是由于不同细胞系中肿瘤干细胞的比例不同,另一方面是基因突变型不同的肺癌干细胞的细胞表面分子有所不同[12],提示基于GD2的靶向CSC的治疗策略要更加精准。
人肺腺癌细胞系A549在成球培养后,其干性基因NANOG、SOX2和OCT4的mRNA和蛋白质(NANOG和OCT4)的表达增高证明了肿瘤干细胞的成功富集。调控GD2合成的关键限速酶GD3S和GD2在成球培养后的A549细胞中的上调表达与预期的肺癌干细胞高表达GD2一致。从另外一方面看,GD2+A549细胞相较于GD2-A549细胞表现出了更强的细胞增殖、迁移和侵袭等干性特征。这是因为GD2可以通过保持细胞增殖能力的增加在转移部位的附着和固定中发挥作用,高水平的GD2表达会增强细胞从原发位点的脱离和细胞迁移,从而导致肿瘤的远处转移[13-14]。然而,抗GD2单克隆抗体dinutuximab可以选择性地识别GD2+肿瘤细胞,与GD2结合后显著降低肿瘤细胞的黏附和迁移,抑制肿瘤的生长[11],提示dinutuximab抗体有潜力成为肺癌的新治疗方法。
本研究还发现GD2的表达水平与另外两种肺癌干细胞表型CD44和EpCAM的表达呈正相关,这证明GD2是具有干细胞特性的肿瘤细胞子集的标志物,GD2可鉴定肺癌干细胞。与此同时,这还提供了新的用于识别肺癌干细胞的标志物组合,例如GD2+CD44hi或GD2+EpCAM+,提高了鉴别的特异性和准确度。A549肺癌移植瘤模型更是展示了GD2+A549细胞的强致瘤特性,相比GD2-A549细胞,其恶性程度更高,靶向GD2+肿瘤细胞或许是肺癌免疫治疗成功的关键。
综上所述,本研究通过分析肺癌球细胞上GD2的表达情况以及GD2+肿瘤细胞的干性表型,初步证明了GD2可作为肺癌干细胞的标志物以识别肿瘤干细胞。为将靶向GD2+肿瘤细胞作为抑制CSC相关肿瘤生长、化疗耐药和肿瘤转移的新策略,扩大抗GD2单克隆抗体的应用范围提供了一定的理论基础。
