酱香型大曲中产4-乙基愈创木酚芽孢杆菌的筛选、鉴定及特性研究
2023-05-02王成俊李玲珊袁思棋
王成俊,李玲珊,范 梅,刘 君,3*,袁思棋*
(1.四川轻化工大学生物工程学院,四川宜宾 644000;2.四川宜宾五粮液股份有限公司,四川宜宾 644000;3.酿酒生物技术与应用四川省重点实验室,四川宜宾 644000)
4-乙基愈创木酚(4-Ethylguaiacol,简称4-EG;CAS No.2785-89-9),化学名为4-乙基-2-甲氧基苯酚,呈木香、烟味、香辛料和甜香兰素风味,具有缓和咸味等作用[1]。4-EG 是酱香型白酒重要的微量香气成分,茅台酒中含0.025 mg/L 的4-EG 时,赋予茅台悠香醇厚风味,凸显其酱香风味[2]。此物质因具有酱香特征成为酱油的重要香气物质,酱油中蛋氨酰与4-EG 的含量分别为3.99 mg/L 与0.3 mg/L 时,能让酱油呈现最佳风味[3],在一定程度上减轻酱油的咸味,使味道呈现圆滑的效果[4],还具有增香、防腐、杀菌等作用[1,5]。4-EG具有良好的活性氧消除功能,在抗氧化和预防心血管等多种疾病方面有一定作用[6-8],是白酒中重要的风味物质和健康因子之一[9-10],被广泛应用于酒类、酱油、饮料、食品、烟草等行业[1,3-5,11]。
目前,生产4-EG 的方法有直接提取法[12]、人工合成法[13-14]、生物转化法[15-16]。生物转化法生产4-EG 是目前应用较为广泛的方法,具有反应条件温和,生产周期短,价格低廉,环境友好和生产成本低等优点[15-17],已引起各国研究者的高度关注。本研究拟从酱香型大曲中分离具有产4-EG能力的芽孢杆菌类微生物作为目的菌株并探索其耐受条件,旨在为后续研究4-EG 的生物合成及应用提供理论基础。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品
酱香型大曲:来自于某酒业有限公司制曲车间。
1.1.2 试剂
4-乙基愈创木酚(C9H12O2,色谱级,CAS No.2785-89-9)标准品,购于上海源叶科技生物有限公司。其他试剂和药品均购于国内相关公司。
1.1.3 仪器设备
气相色谱-质谱联用仪:TSQ8000(安捷伦公司,美国);PCR 仪:5020(Thermo Fisher 公司,美国);可见光分光光度计:UV-1800 型(翱艺仪器上海有限公司)等。
1.1.4 培养基
富集培养基、分离培养基、发酵培养基、葡萄糖试验培基、蔗糖试验培养基、乳糖试验培养基、淀粉试验培养基、VP试验培养基等培养基(表1)。富集培养基用于目的菌株的分离培养,发酵培养基只添加麸皮作为发酵前体物质进行目的菌株的复筛,葡萄糖培养基用于生理生化试验,淀粉培养基用于检验菌株是否能分解淀粉,VP 培养基用于生理生化鉴定。

表1 培养基
1.2 试验方法
1.2.1 菌种分离及筛选
1.2.1.1 富集培养
称取10 g 大曲,粉碎后加入到50 mL 富集培养基中,185 r/min 振荡培养4 h,取10 mL 于80 ℃水浴锅中处理30 min,静置,取1 mL 上清液加入到装有50 mL 的富集培养基中,37 ℃、180 r/min 培养过夜。
1.2.1.2 初筛
过夜培养的菌悬液按10 倍梯度稀释到10-7,分别取10-5、10-6、10-7的稀释液0.1 mL 涂布于分离培养基,37 ℃培养24 h,根据菌落形态大小、颜色等挑取菌落划线分离纯化,将纯化后的纯菌落接种到斜面培养基上,37 ℃培养24 h。过滤发酵液,通过GC-MS 检测4-EG 相对含量,选择出产4-EG 较高的菌株进行后续复筛。
1.2.1.3 复筛
初筛分离得到的菌株经活化后,培养成种子菌悬液,按5 %的接种量接入复筛培养基,于37 ℃、180 r/min 培养6 d,同时设置空白组。过滤发酵液,通过GC-MS检测4-EG相对含量。
1.2.2 菌种鉴定
1.2.2.1 菌种的形态学鉴定
复筛得到的目的菌株,将其菌悬液梯度稀释后,涂布于平板上,37 ℃培养32 h,观察菌落形态,挑单个菌落进行革兰氏染色和芽孢染色,用光学显微镜观察个体形态。
1.2.2.2 分子系统学鉴定
分子系统学鉴定:离心收集对数期的培养菌液,采用Bacterial DNA Kit 试剂盒提取总DNA,提取得到的总DNA 采用0.8 %琼脂糖凝胶电泳检测。以目标菌株的总DNA 为模板,采用16S rDNA通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'),进行PCR 扩增。扩增后产物送至上海生物生工公司进行测序。测序获得的数据进行人工比对和校正,在NCBI 数据库中BLAST 进行比对和数据相似性分析,借助MEGA7.0 软件[18],将目的基因序列与相关序列用Clustal W 算法进行序列比对,利用p-distance计算[19]并构建N-J法系统发育树[20]。
1.2.3 菌株的生理生化实验
菌株生理生化鉴定包括接触酶试验、厌氧生长试验(浇筑法)、柠檬酸盐试验、糖发酵试验、淀粉水解试验、V-P 试验、明胶试验。以上实验的操作流程按照实验流程进行。
1.2.4 菌种耐受性分析
1.2.4.1 耐酒精能力测定
分别制备初始酒精度为0、4 %vol、8 %vol、10 %vol 和12 %vol 的LB 液体培养基,将培养好的目的菌株按2%的接种量分别接到各培养基中,于37 ℃、185 r/min 培养24 h,600 nm 测其吸光度,每个样品平行测3次取其平均值。
1.2.4.2 耐酸性能力测定
分别制备初始pH值为3.5、4.0、4.5、5.0、5.5、6.0的LB 液体培养基,将培养好的目的菌株按2 %的接种量分别接到各培养基中,于37 ℃、185 r/min 培养24 h,600 nm 测其吸光度,每个样品平行测3 次取其平均值。
1.2.4.3 耐糖性能力测定
分别制备初始葡萄糖质量分数为0 %、5 %、10 %、15 %、20 %、25 %的LB 液体培养基,将培养好的目的菌株按2 %的接种量分别接到各培养基中,于37 ℃、185 r/min 培养24 h,600 nm 测其吸光度,每个样品平行测3次取其平均值。
1.2.5 4-EG的GC-MS分析
初筛发酵液前处理方式:各发酵液在8000 r/min下离心5 min,离心2 次,得到的上清液用0.22 μm过滤器过滤,将滤液和95%乙醇1∶1 均匀混合。通过GC-MS进行检测,采用外标法进行定量分析。
复发酵实验发酵液前处理方式:将发酵液8000 r/min 离心5 min,离心2 次,取离心后的发酵液5 mL,加氯化钠(约1.4 g)至饱和,振荡摇匀,加入2 mL 二氯甲烷,振荡摇匀后充分萃取1 min,8000 r/min离心5 min,取下层清液,进行定量测定[20]。
色谱条件:进样口温度250 ℃,初始温度250 ℃;分流模式;初始柱温50 ℃,保持1 min,以30 ℃/min 的速度升温至280 ℃,保持2 min,分析时间10 min。
质谱条件:全扫描模式;离子源温度280 ℃;扫描范围40~500 amu。
2 结果与分析
2.1 菌落及形态学观察
酱香型大曲样品经过多次稀释和划线分离,根据平板上菌落的形态、颜色、菌落边缘隆起情况、菌落的透明度等菌落特征(表2),并闻香初步识别筛选分离获得10 株目的菌株。从形态上判断10 株菌株均为细菌,分别对这些菌株进行产4-EG试验。
以上10 株筛选获得的菌株,观察菌落形态(表2),结果表明所有菌株的形态学结果显示在培养基上生长时一部分菌株菌落颜色为奶白色,另一部分为半透明,菌落扁平,除菌株wsp-3-3 边缘不规则外,其余菌株的边缘均表现出规则状态,仅有菌株wsp-1-3菌落较小,其余菌落均较大。
对所有筛选的目的菌株进行3 次革兰氏染色实验(表3),结果显示,除wsp-2-2 和wsp-4-1 外,其余均为革兰氏阳性菌(图1、图2)。菌株wsp-2-2菌株的3 次染色实验在显微镜下观察为红紫色,少量芽孢未染色成功,呈现蓝色(图2),判断为革兰氏阴性菌,同样,菌株wsp-4-1 为革兰氏阴性菌(图2)。
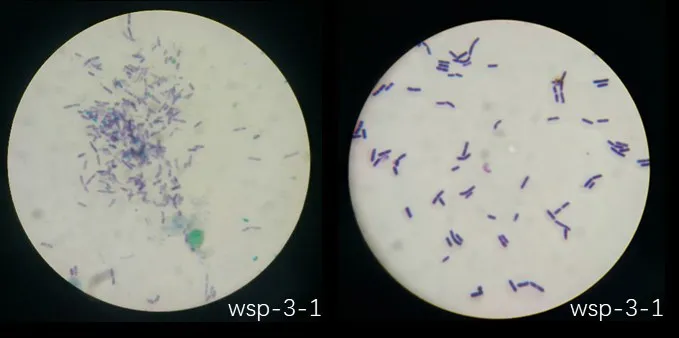
图1 菌株wsp-3-1革兰氏染色和芽孢染色

图2 菌株wsp-2-2和wsp-4-1革兰氏染色和芽孢染色
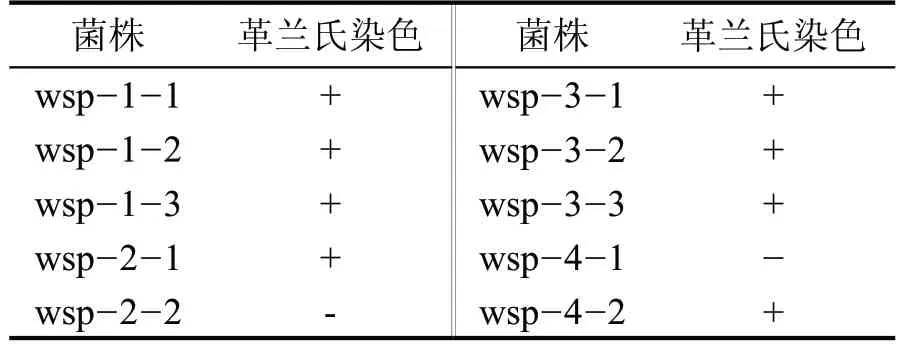
表3 菌株革兰氏染色结果
2.2 菌株产4-EG能力测定
产4-EG 试验发酵产物经过前处理后利用GC-MS 检测发酵产物中挥发性组分,以挥发性组分中的4-EG 含量为基准,筛选获得4-EG 产量较高的菌株(图3)。外标法确定4-EG 的线性方程为y=2076576454.970x-135388350.970(R2=0.9927>0.99),可计算出各单菌落发酵液中4-EG 的含量(图3)。
根据测定的实验数据(图3),除空白组外,其余菌株全部检测出4-EG,wsp-3-1 发酵液中4-EG含量最高为149.53 μg/L,菌株wsp-2-2 的发酵液中4-EG 含量为141.30 μg/L,其余菌株相对较低(130 μg/L左右)。
将以上产量较高的菌株wsp-2-1、wsp-2-2、wsp-3-1 和wsp-4-1 进行复发酵实验。发酵液经过改良的前处理后进行GC-MS 检测,复发酵后菌株wsp-2-2 中4-EG 产量为245.3 μg/L,明显高于菌株wsp-3-1中4-EG含量(121.3 μg/L),其余菌株产量均低于120 μg/L。
2.3 部分生理生化实验鉴定
挑选产4-EG 较多的菌株wsp-2-1、wsp-2-2、wsp-3-1 和wsp-4-1 进行生理生化实验,结果如表4所示。

表4 生理生化结果
4株目的菌株革兰氏染色、芽孢染色、接触酶试验、运动性试验、葡萄糖产酸试验、淀粉分解试验、VP 试验、明胶分解试验均为阳性,葡萄糖产气试验、乳糖分解试验为阴性。厌氧生长实验菌株wsp-3-1 为阳性,蔗糖分解试验菌株wsp-4-1 为阴性。
查阅《伯杰氏细菌鉴定手册》和《常见细菌鉴定手册》中芽孢杆菌属的描述,发现以上4 株菌株有芽孢杆菌属或类似芽孢杆菌属微生物的特征,需要进一步的分子生物学鉴定。
2.4 菌株分子生物学鉴定
提取菌株wsp-2-1、wsp-2-2、wsp-3-1、wsp-4-1 的基因组DNA,以总DNA 为模板,经过PCR 扩增获得16S rDNA 序列,扩增后的目标片段约1500 bp(图4)。
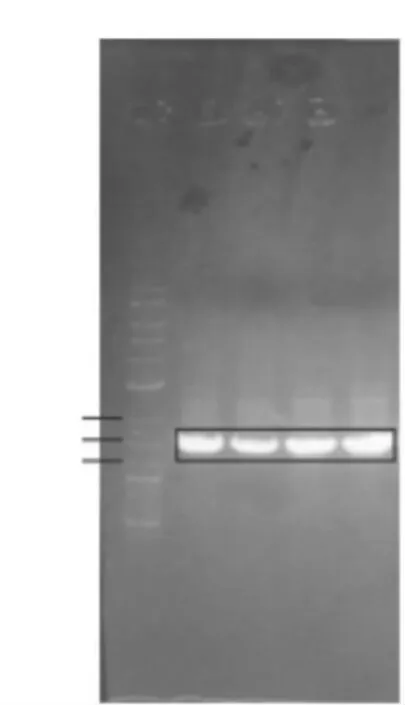
图4 菌株DNA PCR产物电泳图
根据扩增片段测序结果,菌株wsp-2-1、wsp-3-1、wsp-4-1 经过多次DNA 扩增,测序结果均为双峰,以上3 菌株暂时未进行分子生物学鉴定。采用NCBI 提供的BLAST 程序将菌株wsp-2-2 的PCR 测序结果与GenBank 中已注册的16S rRNA基因序列进行同源性比对,结果显示,该菌株与芽孢杆菌属(Bacillus sp.)的几个种之间同源性均达到98%以上。因此,初步判断菌株wsp-2-2 属于芽孢杆菌属Bacillus物种。
下载同源性已知序列和本实验中的序列进行MEGA7.0 比对和人工校正,采用基于p 距离(pdistance)的邻近法分别构建系统发育树(图5)。除Bacillus mesophilusACCC03113(序列号MK881071.1)序列长度为956 bp 外,其余菌株的序列长度在1415 bp 左右;碱基T、C、A、G 平均比例分别为20.8、23.0、25.6、30.7,菌株wsp-2-2 与上述平均比例基本一致(表5)。
表5 序列简介组成情况
根据序列的所有信息,选用p 距离(p-distance)和替换模型为转换和颠换(substitutions to include d:Transitions +Transversions)进行序列间遗传距离计算,所有序列的遗传距离为0.000~0.073 之间,平均遗传距离为0.029。菌株wsp-2-2 遗传距离与Bacillus circulansATCC4513(0.06)、Bacillus oleroniusATCC700005(0.072)和Bacillus mesophilusACCC03113(0.066)均大于平均遗传距离,推测菌株wsp-2-2 直接的系统发育关系较远,与其余的物种距离较近(<0.029)。
基于以上序列信息,采用p 距离(p-distance)和替换模型为转换和颠换(substitutions to include d:Transitions+Transversions)构建N-J 系统发育树(图5),可以看出:(1)Bacillus circulansATCC4513、Bacillus oleroniusATCC700005 和Bacillus mesophilusACCC03113 聚为一个单系,其余物种全部聚为一个单系;(2)菌株wsp-2-2 的序列与蜡样芽孢杆菌Bacillus cereusATCC14579 聚为一支(自展值为85),表现出很近的亲缘关系。上述结果与遗传距离的结果基本一致。
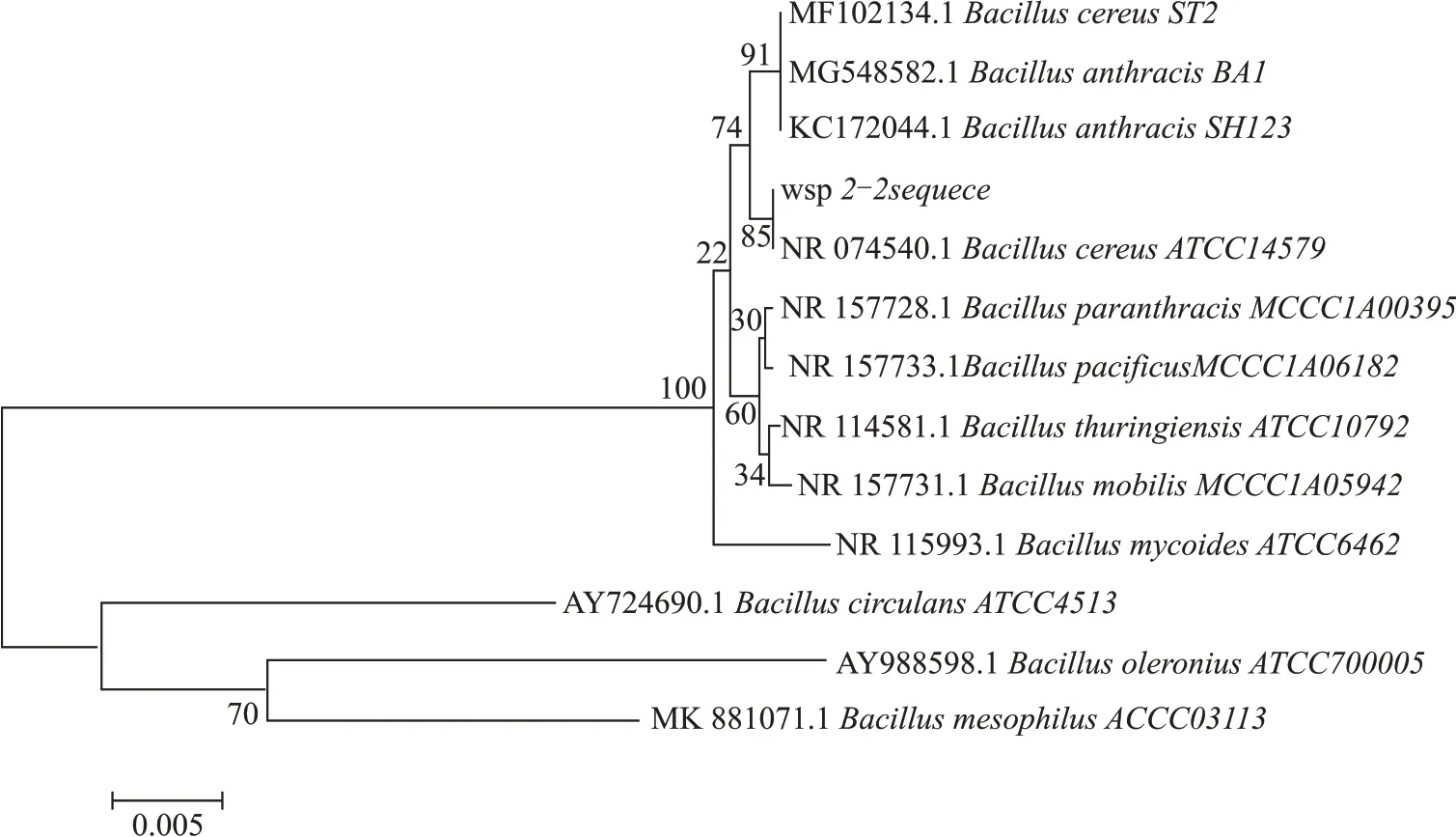
图5 基于p距离的菌株wsp-2-2构建N-J系统进化树
表6 基于p距离的序列间遗传距离(替换模型为转换和颠换)
因此,结合形态学、生理生化实验和系统发育树结果,菌株wsp-2-2 确认为蜡样芽孢杆菌Bacillus cereus,命名为Bacillus cereuswsp-2-2。
2.5 耐受性分析
根据单菌株发酵实验产4-EG 的能力,选取菌株wsp-2-2进行耐受性分析。
2.5.1 耐酒精能力的测定
对筛选得到的蜡样芽孢杆菌wsp-2-2 进行耐酒精能力的测定,从图6 可以看出,随着培养基中酒精浓度增加,在吸光度为600 nm 时的OD 值呈现出不断下降的趋势,当酒精浓度达到8%vol 时,菌株wsp-2-2 表现出基本上不生长,OD 值接近0,即在酒精浓度超过8 %vol 时菌株的生长受到明显抑制。

图6 菌株wsp-2-2耐酒精能力
2.5.2 耐糖能力的测定
对筛选得到的菌株wsp-2-2 进行耐糖能力的测定(图7),结果显示,随着培养基中糖度增加,在吸光度为600 nm 时的OD 值呈现出先上升后下降的趋势。可能是随着糖度的不断增加,当糖度为10%时,菌株能够充分利用糖进行生长,提供生长充足的碳源和良好的生长环境;当糖度小于10 %时,提供的碳源相对不足,造成生长速度相对缓慢;当糖度大于10 %时(特别是超过15 %时),糖度较高形成了高渗透压的环境,生长曲线急剧下降,使菌的生长受到了显著的限制。
2.5.3 耐酸能力的测定
对筛选得到的菌株wsp-2-2 进行耐酸能力的测定(图8),结果显示,随着培养基中pH 值不断上升,OD600nm呈现不断增加的趋势,当pH 值小于5时,OD600nm基本接近0,菌株的生长明显受到抑制,当pH 值为5.5 时,菌株基本上可以正常生长,说明该菌株在偏酸性的培养基或者培养环境中生长。

图8 菌株wsp-2-2耐酸能力
3 结论
本实验以酱香型大曲为原料,进行80 ℃高温处理,经过富集、初筛和复筛,以及发酵实验,获得4-EG 含量最高的菌株为wsp-2-2(245.3 μg/L)。生理生化试验显示,菌株wsp-2-2 革兰氏染色镜检阴性,葡萄糖试验产酸不产气,能分解蔗糖和淀粉,不能分解乳糖,接触酶试验呈阳性,明胶分解试验呈阳性,运动性试验呈阳性,VP 试验呈阳性,都符合芽孢杆菌属的描述,初步判定为芽孢杆菌属物种。通过16S rDNA 测序,在NCBI 上Blast 比对后可以确定其种属,菌株的系统进化树结果显示菌株wsp-2-2 为蜡样芽孢杆菌Bacillus cereus。菌株wsp-2-2 耐受性试验结果表明菌株wsp-2-2 耐4 %vol 酒精度、15 %的糖度和pH5.5 的酸碱度,为白酒生产中控制4-EG 的含量提供了一定的参考,也为生产健康保健功效的酱香型白酒打下了基础。
