吲哚-2,3-环氧的酸开环反应
2023-04-29傅凯张振国郭晶晶荀苗苗袁长春
傅凯 张振国 郭晶晶 荀苗苗 袁长春


以吲哚-2,3-环氧化合物和商品化的酸为主要反应物,经环氧的酸开环反应,可以高收率地得到一系列的酯基取代的二氢吲哚化合物. 该方法简便高效,首次实现了吲哚-2,3-环氧化合物在酸性条件下的开环反应,为酯基取代的吲哚化合物的合成提供了一种新的合成方法.
吲哚-2,3-环氧化合物; 环氧; 酸; 开环反应
O629.9A2023.025001
收稿日期: 2022-10-04
基金项目: 山西省自然科学基金(201901D211220)
作者简介: 傅凯(1990-), 男, 山西太原人, 博士, 讲师. E-mail: kaifu@nuc.edu.cn
通讯作者: 袁长春. E-mail: ycc543700483@nuc.edu.cn
The ring-opening reaction of indole-2,3-epoxides with acid
FU Kai, ZHANG Zhen-Guo, GUO Jing-Jing, XUN Miao-Miao, YUAN Chang-Chun
(National Demonstration Center for Experimental Chemical Engineering Comprehensive Education, School of Chemistry and Chemical Engineering, North University of China, Taiyuan 030000, China)
A series of dihydroindoles 3-ester substituted compounds can be obtained in high yield through the acid ring-opening reaction of epoxy using indole-2,3-epoxy compounds and commercial acids as the main reactants. This method is simple and efficient, and it is the first time to realize the ring opening reaction of indole-2,3-epoxy compounds under acidic conditions, which provides a new synthesis method for the synthesis of ester substituted indole compounds.
Indole-2,3-epoxides; Epoxides; Acid; Ring opening reaction
1 引 言
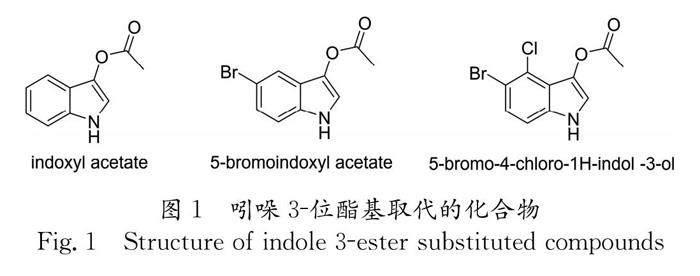
吲哚以及二氢吲哚骨架化合物作为药物和生化试剂等有着重要的市场应用[1-5]. 例如:解热镇痛类药物阿西美辛[6]、肿瘤抑制剂褪黑素[7]和治疗慢粒白血病的药物靛玉红[8]等都含有吲哚骨架,抗癌天然药物长春碱以及长春新碱[9]、镇静药利血平[10]和生物试剂荧光染料D149 Dye等都具有二氢吲哚结构. 不仅如此,以吲哚为基本骨架所设计的吲哚类衍生物,也均表现了良好的生物活性. 因此,吲哚骨架类化合物的化学合成研究一直是有机合成研究中的热点问题之一. 吲哚3-位被酯基取代的化合物,如:5-溴代-3-羟基吲哚乙酸酯、3-吲哚乙酸酯和乙酸-5-溴-4-氯-3-吲哚氧基酯为分析胆碱酯酶、脂肪酶、酰基转移酶和酸性磷酸酶的荧光底物[11-14] (图1). 在以往的报道中,合成吲哚3-位酯基取代的化合物需要使用当量的氧化剂,而本文另辟蹊径,通过对吲哚-2,3-环氧化合物的开环反应得到一系列吲哚3-位酯基取代的化合物.
本文通过吲哚-2,3-环氧化合物(HITAB)在酸性条件下与酸发生环氧开环,得到一系列取代的酯基取代二氢吲哚化合物. 在以往报道的吲哚-2,3-环氧化合物的开环反应中,吲哚-2,3-环氧化合物的开环反应都是在碱性三乙胺的条件下发生开环反应[15-17] (图2). 而本文报道了首例在酸性条件下进行吲哚-2,3-环氧化合物的开环反应.
2 实验部分
2.1 仪器与试剂
瑞士Bruker公司Advance Ⅲ HD 600 MHz型核磁共振波谱仪(CDCl3为溶剂,TMS为内标);美国Thermo Fisher Exactive Plus型高分辨质谱仪.
吲哚和N-溴代丁二酰亚胺,百灵威科技有限公司;对甲苯磺酰氯、氢化钠、苯甲酸、2-萘甲酸、2-呋喃甲酸和三乙胺,萨恩化学技术(上海)有限公司. N,N-二甲基甲酰胺、丙酮、乙酸乙酯、乙腈、乙醇和四氢呋喃均为分析纯,用前未经处理.
2.2 合 成
2.2.1 化合物HITAB的合成 根据已知步骤可合成化合物HITAB(路线如图3所示),白色固体,纯度99.5%,收率67%.
2.2.2 化合物 1的合成 在装有冷凝回流管的试管中,加入HITAB(46.8 mg, 0.1 mmol)和苯甲酸(24.4 mg, 0.2 mmol)后,再加入0.5 mL乙酸乙酯搅拌,将反应液加热到80 ℃,反应8 h后停止加热并冷却至室温. 然后室温搅拌下,向反应体系加入3.0 mL饱和碳酸氢钠,水相使用乙酸乙酯萃取(5 mL×3次),合并有机相并用无水硫酸钠干燥除去水分,过滤除去硫酸钠,在旋转蒸发仪上减压浓缩后经硅胶层析柱 [洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=8∶1] 纯化后得到白色固体化合物1,共37.6 mg,纯度99.2%,收率92%.
2.2.3 化合物 2的合成 在装有冷凝回流管的试管中加入HITAB(46.8 mg, 0.1 mmol)和2-萘甲酸(34.4 mg, 0.2 mmol)后,再加入0.5 mL乙酸乙酯搅拌,将反应液加热到80 ℃,反应8 h后停止加热并冷却至室温. 然后室温搅拌下,向反应体系加入3.0 mL饱和碳酸氢钠,水相使用乙酸乙酯萃取(5 mL×3次),合并有机相并用无水硫酸钠干燥除去水分,过滤除去硫酸钠,在旋转蒸发仪上减压浓缩后经硅胶层析柱 [洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=8∶1] 纯化后得白色固体化合物2,共41.5 mg,纯度99.1%,收率90%.
2.2.3 化合物 3的合成 在装有冷凝回流管的试管中,加入HITAB(46.8 mg, 0.1 mmol)和2-呋喃甲酸(22.4 mg, 0.2 mmol)后,再加入0.5 mL乙酸乙酯搅拌,将反应液加热到80 ℃,反应8 h后停止加热并冷却至室温. 然后室温搅拌下,向反应体系加入3.0 mL饱和碳酸氢钠,水相使用乙酸乙酯萃取(5 mL×3次),合并有机相并用无水硫酸钠干燥除去水分,过滤除去硫酸钠,在旋转蒸发仪上减压浓缩后经硅胶层析柱 [洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=8∶1] 纯化后得白色固体化合物3,共35.5 mg,纯度99%,收率89%.
3 结果与讨论
3.1 反应条件的筛选
以HITAB和苯甲酸为起始原料,比例1∶2,对HITAB的酸开环反应进行了条件优化(表1). 首先考虑添加剂因素,将添加剂三乙胺加入前后进行对比(表1, Entries 1和2),发现在反应体系中三乙胺的加入对反应的影响不大.因此选择不加添加剂. 再对溶剂因素进行考察,分别选取四氢呋喃、乙腈、无水乙醇和乙酸乙酯作为反应溶剂(表1, Entries 1, 3~5),发现溶剂效应对该反应的收率影响很大.其中乙酸乙酯的效果最好, 收率92%,而在乙醇中反应不能发生. 随后又对反应温度进行了考察(表1, Entries 1,6和7),发现随着反应温度的降低,反应收率降低. 最终确定该反应的最优条件为:HITAB和苯甲酸比例1∶2,在乙酸乙酯溶剂中,反应温度为80 ℃条件下反应8 h,收率为92%. 最后通过1H NMR、13C NMR谱表征了该化合物.
3.2 化合物结构表征
化合物HITAB:1H NMR (600 MHz, DMSO-d6) δ 8.02 (d, J = 8.0 Hz, 2H), 7.88 (d, J = 6.9 Hz, 1H), 7.55 (d, J = 8.1 Hz, 1H), 7.48 (t, J = 7.5 Hz, 1H), 7.40 (d, J = 8.0 Hz, 2H), 7.37 (d, J = 8.0 Hz, 1H), 7.14 (t, J = 7.5 Hz, 1H), 6.35 (d, J = 7.5 Hz, 1H), 4.82 (s, 1H), 3.30~3.46 (m, 6H), 2.33 (s, 3H), 1.01 (t, J = 7.5 Hz, 9H); 13C NMR (150 MHz, DMSO-d6) δ 145.4, 142.8, 136.1, 132.9, 130.4, 130.4, 128.2, 124.0, 120.4, 113.8, 84.8, 75.4, 53.3, 21.5, 8.8; HRMS (ESI): m/z 计算值 C21H29N2O3S {[M+H]+}389.1899, 实测值 389.1891.
化合物1:1H NMR (600 MHz, CDCl3) δ 7.72 (d, J = 8.3 Hz, 2H), 7.66 (dd, J = 8.2, 1.1 Hz, 2H), 7.64 (d, J = 8.2 Hz, 1H), 7.54 (t, J = 7.4 Hz, 1H), 7.47 (d, J = 7.5 Hz, 1H), 7.41~ 7.37 (m, 1H), 7.35 (t, J = 7.8 Hz, 2H), 7.18 (d, J = 8.1 Hz, 2H), 7.10 (t, J = 7.5 Hz, 1H), 6.04 (s, 1H), 5.82 (d, J = 2.7 Hz, 1H), 3.62 (d, J = 3.2 Hz, 1H), 2.32 (s, 3H);13C NMR (150 MHz, CDCl3) δ 165.44, 144.38, 141.85, 135.34, 133.39, 131.27, 129.85, 129.71, 129.08, 128.25, 127.78, 127.14, 127.04, 124.64, 115.05, 90.29, 78.07, 21.59;HRMS (ESI): m/z 计算值 C22H10NO5S {[M+H]+}410.1057, 实测值 410.1059.
化合物2:1H NMR (600 MHz, CDCl3) δ 8.30 (s, 1H), 7.88 (d, J = 8.9 Hz, 2H), 7.80 (d, J = 8.6 Hz, 1H), 7.77 (d, J = 8.3 Hz, 2H), 7.71 (dd, J = 8.6, 1.7 Hz, 1H), 7.66 (d, J = 8.2 Hz, 1H), 7.62 (ddd, J = 8.1, 6.9, 1.2 Hz, 1H), 7.59~7.55 (m, 1H), 7.54 (d, J = 7.6 Hz, 1H), 7.45~ 7.40 (m, 1H), 7.17 (d, J = 8.0 Hz, 2H), 7.14 (td, J = 7.5, 0.8 Hz, 1H), 3.71 (d, J = 3.2 Hz, 1H), 2.22 (s, 3H);13C NMR (150 MHz, CDCl3) δ 164.68, 143.39, 140.90, 134.61, 134.38, 131.23, 130.39, 130.26, 128.80, 128.25, 127.58, 127.02, 126.80, 126.76, 126.04, 125.79, 125.25, 124.01, 123.56, 113.93, 89.30, 77.29, 20.45;HRMS (ESI): m/z 计算值 C26H24NO5S {[M+H]+}462.1370, 实测值 462.1374.
化合物3:1H NMR (600 MHz, CDCl3) δ 7.74 (d, J = 7.9 Hz, 2H), 7.58~7.54 (m, 2H), 7.46 (d, J = 7.6 Hz, 1H), 7.37 (t, J = 7.9 Hz, 1H), 7.21 (d, J = 8.2 Hz, 2H), 7.08 (t, J = 7.5 Hz, 1H), 6.80 (d, J = 3.5 Hz, 1H), 6.47~6.43 (m, 1H), 6.02 (s, 1H), 5.83 (d, J = 2.7 Hz, 1H), 3.71 (d, J = 3.1 Hz, 1H), 2.35 (s, 3H);13C NMR (150 MHz, CDCl3) δ 156.46, 145.87, 143.35, 142.64, 140.81, 134.33, 130.31, 128.81, 126.85, 126.14, 125.66, 123.52, 117.68, 113.76, 110.79, 89.18, 77.07, 20.53;HRMS (ESI): m/z 计算值 C20H18NO6S {[M+H]+}400.0849, 实测值 400.0844.
4 结 论
以HITAB和商品化的酸为主要反应物,经环氧的酸开环反应,可以高收率的得到一系列的酯基取代的二氢吲哚化合物. 该方法简便高效,避免了以往报道中氧化剂的使用. 本文首次报道了HITAB在酸性条件下的酸开环反应,为酯基取代的吲哚化合物的合成提供了一种新的合成方法,具有深入研究的价值.
参考文献:
[1] Bharat B, A,Haruyo I. Molecular targets and anticancer potential of indole-3-carbinol and its derivatives [J]. Cell Cycle, 2005, 4: 1201.
[2] Masanori S, Fumio Y. Simple indole alkaloids and those with a non-rearrangedmonoterpenoid unit [J]. Nat Prod Rep, 2005, 22: 73.
[3] Abou-Gharbia M. Discovery of innovative small molecule therapeutics [J]. J Med Chem, 2009, 52: 2.
[4] Barry M T, Megan K B. Asymmetric syntheses ofoxindole and indole spirocyclic alkaloid natural products [J]. Synthesis, 2009, 18: 3003.
[5] Li S M, Prenylated indole derivatives from fungi: structure diversity, biological activities, biosynthesis and chemoenzymatic synthesis [J]. Nat Prod Rep, 2010, 27: 57.
[6] Archana K, Rajesh K S. Medicinal chemistry of indole derivatives: current to future therapeutic prospectives [J]. Bioorg Chem, 2019, 89: 103021.
[7] Tan D, Reiter R J, Manchester L C, et al. Chemical and physical properties and potential mechanisms: melatonin as a broad spectrum antioxidant and free radical scavenger [J]. Curr Top Med Chem, 2002, 2: 181.
[8] Reece G K, Celine J M. Toward multi-targeted platinum and ruthenium drugs-a new paradigm in cancer drug treatment regimens? [J]. Chem Rev, 2019, 119: 1058.
[9] Dumontet C, Jordan M. Microtubule-binding agents: a dynamic field of cancer therapeutics [J]. Nat Rev Drug Discov, 2010, 9: 790.
[10] Susan D, Peter J. Animal models of Parkinsons disease: a source of novel treatments and clues to the cause of the disease [J]. Brit J Pharmacol, 2011, 164: 1357.
[11] Speeleveld E, Fossépré J M, Gordts B, et al. Comparison of three rapid methods, tributyrine, 4-methylumbelliferyl butyrate, and indoxyl acetate, for rapid identification of Moraxella catarrhalis [J]. J Clin Microbiol, 1994, 32: 1362.
[12] Maria José F, Luis C, Arturo L, et al. Arcobacter molluscorum sp. nov., a new species isolated from shellfish [J]. Syst Appl Microbiol, 2011, 34: 105.
[13] Stijn S, Jos V, Roseline R. Indole-3-acetic acid in microbial and microorganism-plant signaling [J]. FEMS Microbiol Rev, 2007, 31: 425.
[14] Duca D, Lorv J, Patten C L, et al. Indole-3-acetic acid in plant-microbe interactions [J]. Anton Leeuw 2014, 106: 85.
[15] Takumi A,Takuro S, Masahiro A, et al. 2-hydroxyindoline-3-triethylammonium bromide: a reagent for formal c3-electrophilic reactions of indole [J]. Org Lett, 2017, 19: 4275.
[16] Takumi A, Haruka S, Shiori T, et al. Double “open and shut” transformation of γ-carbolines triggered by ammonium salts: one-pot synthesis of multiheterocyclic compounds [J]. Org Lett, 2018, 20: 1589.
[17] Takumi A, Koji Y.Dehydrative mannich-type reaction for the synthesis of azepinobisindole alkaloid iheyamine A [J]. Org Lett, 2018, 20: 1469.
