我国部分地区慢性HBV感染者HDV感染情况调查
2023-04-29刘玉梅郭小平张慧敏白洪霞王春梅任姗蒋永芳杨胜彭锋王晓忠于雷廖柏明宁玲何英利杨霞黄亮刘学恩庄辉
刘玉梅 郭小平 张慧敏 白洪霞 王春梅 任姗 蒋永芳 杨胜 彭锋 王晓忠 于雷 廖柏明 宁玲 何英利 杨霞 黄亮 刘学恩 庄辉

摘要:目的 了解目前我國部分地区慢性HBV感染者丁型肝炎病毒 (HDV) 感染流行情况。方法 2021年3月—2022年6月从全国10个省市自治区收集3 131例慢性HBV感染者血清,用抗-HDV IgG酶联免疫试剂检测全部血清标本。对抗-HDV IgG阳性标本用巢式逆转录聚合酶链式反应 (nRT-PCR) 法检测HDV RNA。对HDV RNA阳性标本的nRT-PCR扩增产物测序后进行序列分析,确定HDV基因型。分析抗-HDV IgG阳性患者的临床特征。计量资料两组间比较采用Mann-Whitney U秩和检验。计数资料两组间比较采用χ2检验或Fisher精确检验。结果 3 131例慢性HBV感染者的抗-HDV IgG阳性率为0.70%(22/3 131),内蒙古自治区、新疆维吾尔自治区、北京市和湖南省慢性HBV感染者的抗-HDV IgG阳性率分别为1.81%(16/886)、0.88%(2/226)、0.28%(2/708) 和1.00%(2/200),其中内蒙古自治区慢性HBV感染者抗-HDV IgG阳性率显著高于北京市 (P=0.004),其余地区间比较差异均无统计学意义 (P值均>0.05)。对内蒙古自治区慢性HBV感染者临床特征分析发现,抗-HDV IgG阳性组蒙古族患者(P=0.001)、ALT异常患者(P=0.007) 和抗病毒治疗患者(P=0.029) 的比例显著高于抗-HDV IgG阴性组,而中位HBV DNA水平明显较低(P=0.030)。共检出19例HDV RNA阳性标本,均为HDV基因1型。结论 我国不同地区HDV流行率差异较大,内蒙古自治区慢性HBV感染者中HDV流行率较高。我国北方部分省市的HDV流行基因型主要为1型。
关键词:乙型肝炎病毒; δ肝炎病毒; 抗-HDV IgG; 基因型
An investigation of hepatitis D virus infection among patients with chronic hepatitis B virus infection in some regions of China
LIU Yumei1, GUO Xiaoping2, ZHANG Huimin2, BAI Hongxia3, WANG Chunmei4, REN Shan5, JIANG Yongfang6, YANG Sheng6, PENG Feng6, WANG Xiaozhong7, YU Lei8, LIAO Boming9, NING Ling10, HE Yingli11, YANG Xia12, HUANG Liang13, LIU Xueen1, ZHUANG Hui1. (1. Department of Microbiology and Center of Infectious Diseases, Peking University Health Science Center, Beijing 100191, China; 2. Chifeng Infectious Disease Prevention Hospital of Inner Mongolia Autonomous Region, Chifeng, Inner Mongolia Autonomous Region 024099, China; 3. Inner Mongolia International Mongolian Medical Hospital, Hohhot 010055, China; 4. Hohhot Second Hospital of Inner Mongolia Autonomous Region, Hohhot 010020, China; 5. Department of Hepatology, Beijing YouAn Hospital, Capital Medical University, Beijing 100069, China; 6. Department of Infectious Diseases, The Second Xiangya Hospital of Central South University, Changsha 410011, China; 7. Department of Hepatology, Traditional Chinese Medicine Hospital of Xinjiang Uygur Autonomous Region, Urumqi 830000, China; 8. Department of Infectious Diseases, The Fourth Affiliated Hospital of Harbin Medical University, Harbin 150001, China; 9. Department of Infectious Diseases, The First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China; 10. Department of Infectious Diseases, The First Affiliated Hospital of University of Science and Technology of China & Anhui Provincial Hospital, Hefei 230001, China; 11. Department of Infectious Diseases, The First Affiliated Hospital of Xian Jiaotong University, Xian 710061, China; 12. Jilin Infectious Disease Hospital, Jilin, Jilin 132002, China; 13. Public Health Clinical Center of Chengdu, Chengdu 610066, China)
Corresponding authors:LIU Xueen, xueenliu@bjmu.edu.cn (ORCID:0000-0002-6574-4989); ZHUANG Hui, zhuangbmu@126.com (ORCID:0000-0001-9119-6325)
Abstract:
Objective
To investigate the prevalence of hepatitis D virus (HDV) infection among patients with chronic hepatitis B virus (HBV) infection in some regions of China. Methods Serum samples were collected from 3 131 patients with chronic HBV infection in 10 provinces, cities, and autonomous regions of China from March 2021 to June 2022, and anti-HDV IgG ELISA was used for the detection of all serum samples. Nested reverse transcription-polymerase chain reaction (nRT-PCR) was used to detect HDV RNA in anti-HDV IgG-positive samples, and the nRT-PCR amplification products of HDV RNA-positive samples were sequenced and analyzed to determine HDV genotype. The clinical features of anti-HDV IgG-positive patients were analyzed. The Mann-Whitney U rank sum test was used for comparison of continuous data between two groups, and the chi-square test or the Fishers exact test was used for comparison of categorical data between two groups. Results The positive rate of anti-HDV IgG in the 3 131 patients with chronic HBV infection was 0.70% (22/3 131), and that in the patients with chronic HBV infection in Inner Mongolia Autonomous Region, Xinjiang Uygur Autonomous Region, Beijing, and Hunan Province was 1.81% (16/886), 0.88% (2/226), 0.28% (2/708), and 1.00% (2/200), respectively; the patients with chronic HBV infection in Inner Mongolia Autonomous Region had a significantly higher positive rate of anti-HDV IgG than those in Beijing (P=0.004), and there was no significant difference between the other regions (P>0.05). Clinical features of the patients with chronic HBV infection in Inner Mongolia Autonomous Region showed that compared with the anti-HDV IgG-negative group, the anti-HDV IgG-positive group had a significantly higher proportion of patients with Mongol nationality (P=0.001), abnormal alanine aminotransferase (P=0.007), or antiviral treatment (P=0.029), as well as a significantly lower median HBV DNA level (P=0.030). A total of 19 HDV RNA-positive samples were identified, all of which had HDV genotype 1. Conclusion The prevalence rate of HDV varies greatly across different regions of China, with a higher prevalence rate of HDV in patients with chronic HBV infection from Inner Mongolia Autonomous Region. HDV genotype 1 is the predominant genotype in some provinces and cities of northern China.
Key words:
Hepatitis B Virus; Hepatitis Delta Virus; Anti-HDV IgG; Genotype
丁型肝炎病毒 (HDV) 是δ病毒科δ病毒属的唯一成员,是一种缺陷病毒,需要乙型肝炎表面抗原 (HBsAg) 参与才能复制和组装成完整病毒体[1]。HDV通过与HBV相同的钠离子-牛磺胆酸共转运多肽 (sodium taurocholate cotransporting polypeptide, NTCP) 受体进入肝细胞[2]。虽然HDV从发现至今已40余年,但科学界和公众对其关注有限[3]。我国1992年和1996年的HDV流行率调查结果显示,HBsAg携带者HDV抗体流行率分别为1.15%和1.46%[4-5]。此后,我国暂无全国性的HDV流行情况调查数据。近年来,多篇系统综述[6-7]研究结果显示,我国HBsAg携带者HDV抗体流行率为2.1%~5.57%,远高于早期报道结果。HBV感染者感染HDV表现为HBV/HDV联合感染和重叠感染2种形式[8]。有研究[9]认为,慢性丁型肝炎是导致终末期肝病的重要原因,70%的慢性丁型肝炎患者在确诊后5~10年可进展为肝硬化,15%的患者仅需1~2年即可进展为肝硬化[10]。与HBV单独感染者相比,HBV/HDV合并感染者肝细胞癌 (HCC) 发生风险与死亡风险更高 (OR值分别为1.97、2.05)[11]。另外,对于慢性乙型肝炎、乙型肝炎相关肝硬化和乙型肝炎相关肝癌患者,其感染HDV的风险分别是无症状HBsAg携带者的3.56倍、6.75倍和5.61倍[11]。目前我国为HBV中度流行国家,约有7 000万慢性HBV感染者,其中慢性乙型肝炎患者2 000万~3 000万,HBV相关肝硬化和HCC患者分别为100万和30万[12]。因此,有必要对HBV感染者的HDV感染情况进行筛查,以利于指导患者的临床管理和治疗。刘慧敏等[13]发现,近10年间,我国西南医院HBsAg阳性患者的HDV筛查率仅1.6% (13 585/832 144),建议加大筛查力度,重视丁型肝炎。由于系统综述研究结果差异大,大样本的真实世界研究开展少,所以目前我国HDV的真实流行情况仍未知。本研究对我国10个省市自治区12家医院收集的慢性HBV感染者血清标本进行检测,了解我国不同地区HBV感染者的HDV感染流行情况。
1 资料与方法
1.1 研究对象 2021年3月—2022年6月,从全国10个省、自治区和直辖市的12家医院共收集HBsAg阳性慢性HBV感染者 (包括HBsAg阳性携带者、慢性乙型肝炎患者、乙型肝炎肝硬化患者和乙型肝炎肝癌患者) 血清3 131例,其中赤峰市传染病防治医院500例,内蒙古国际蒙医医院300例,呼和浩特市第二医院86例,哈尔滨医科大学附属四院400例,吉林市传染病医院100例,北京市佑安医院708例,中南大学湘雅二医院200例,广西医科大学第一附属医院203例,安徽省立医院217例,新疆维吾尔自治区中医医院226例,西安交通大学第一附属医院135例,成都市公共卫生临床医疗中心56例。血清标本采集后于-20 ℃冰箱保存,通过冷链运输至北京大学医学部病原生物系实验室。HBsAg阳性携带状态、慢性乙型肝炎、乙型肝炎肝硬化的诊断参照《慢性乙型肝炎防治指南 (2019年版) 》[14],乙型肝炎肝癌的诊断参照《原发性肝癌诊疗规范 (2019年版) 》[15]。同时,收集患者的基本人口学信息,以及乙型肝炎血清学指标5项、HBV DNA、肝功能、HCV和HIV检测结果等。
1.2 抗-HDV IgG检测 应用万泰抗-HDV IgG试剂检测全部3 131例血清标本,其中500例血清标本并用贝尔抗-HDV IgG试剂检测(包括来自内蒙古标本450例、北京30例、湖南20例,其中含有全部万泰试剂检出抗-HDV IgG阳性标本),2种试剂均获得北京食品药品监督管理局批准。严格按照各厂家说明书进行操作。任一试剂检测结果呈阳性即认为该标本抗-HDV IgG阳性。
1.3 HDV RNA检测 采用德国Qiagen公司 “QIAamp Viral RNA Mini Kit” 对抗-HDV IgG阳性标本进行HDV RNA提取。应用巢式逆转录聚合酶链式反应 (nested reverse transcription- polymerase chain reaction, nRT-PCR) 扩增部分HDV基因序列,先采用赛默飞世尔公司逆转录试剂 “RevertAid First Strand cDNA Synthesis Kit” 将HDV RNA转录为cDNA;然后采用翌圣生物科技公司 “Hieff Canace Gold High Fidelity DNA Polymerase 高保真DNA聚合酶” 进行nRT-PCR反应。严格按试剂说明书进行操作。nRT-PCR引物见参考文献[16],第一輪引物序列为:HDV-819 (5′-TCC CTT AGC CAT CCG AGT GGA C-3′) 和HDV-1303 (5′-AGG GTT CAC CGA CAA GGA GAG G-3′)。第二轮引物序列为:HDV-856 (5′-GGA TGC CCA GGT CGG ACC G-3′) 和HDV-1282 (5′-AAG GAA GGC CCT CGA GAA CAA G-3′)。引物由上海生工生物工程股份有限公司合成。
1.4 HDV基因型检测 将抗-HDV IgG阳性标本的nRT-PCR产物送至上海生工生物工程股份有限公司进行序列测定。采用Bioedit软件对测序结果进行预处理;从NCBI GenBank数据库下载8个HDV基因型的参考序列 (见参考文献[17]),采用MEGA 7.0软件构建基于邻位连接法的系统发育树进行基因型分析。
1.5 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U秩和检验。计数资料以频数和百分比表示,两组间比较采用χ2检验或Fisher精确检验。HBV DNA水平以log10 IU/mL表示。P<0.05为差异有统计学意义。
2 结果
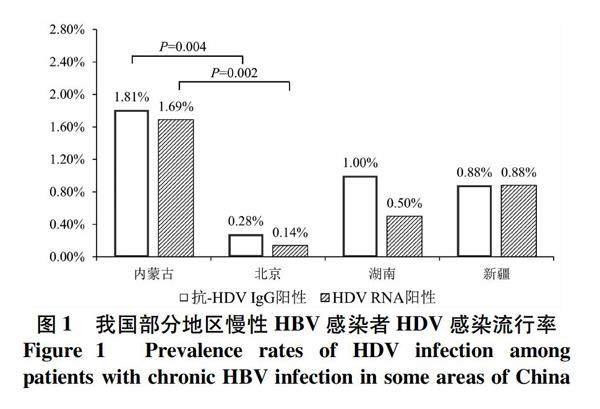
2.1 慢性HBV感染者抗-HDV IgG阳性率 本研究共采集到3 131例慢性HBV感染者血清,共检出抗-HDV IgG阳性血清标本22例 (0.70%),其中内蒙古自治区886例标本检出抗-HDV IgG阳性标本16例 (1.81%);北京市708例标本检出2例 (0.28%);湖南省200例标本检出2例 (1.00%);新疆维吾尔自治区226例标本检出2例 (0.88%),其余省市自治区均未检出抗-HDV IgG阳性标本。慢性HBV感染者的抗-HDV IgG阳性率及地理分布见图1。经χ2检验,内蒙古自治区的抗-HDV IgG阳性率显著高于北京市 (P=0.004) 和其他地区 (除内蒙古外的其余9个地区) (P<0.001),其余地区间抗-HDV IgG阳性率比较均无显著差异 (P值均>0.05)。
对各类慢性HBV感染者分层分析,发现内蒙古地区的慢性乙型肝炎患者和乙型肝炎肝硬化患者抗-HDV IgG阳性率显著高于其他地区 [慢性乙型肝炎: 1.71% (9/525) vs 0.31% (4/1 298), P=0.003; 乙型肝炎肝硬化: 6.06% (2/33) vs 0.23% (1/437), P=0.014]。对内蒙古地区有明确诊断的720例各类慢性HBV感染者的抗-HDV IgG阳性率比较,发现HBsAg携带者、慢性乙型肝炎患者和乙型肝炎肝硬化患者的抗-HDV IgG阳性率逐渐升高,分别为0.63% (1/160)、1.71% (9/525)和6.06% (2/33),但各类型患者的抗-HDV IgG阳性率比较无显著差异 (P值均>0.05),2例乙型肝炎肝癌患者抗-HDV IgG均阴性 (表1)。其他地区 (除内蒙古外的其余9个地区)抗-HDV IgG阳性患者较少 (5例),有明确诊断的2 106例慢性HBV感染者中,各类患者的抗-HDV IgG阳性率比较均无显著差异 (P>0.05)。
2.2 抗-HDV IgG阳性标本HDV RNA检测 22例抗-HDV IgG阳性标本经nRT-PCR检测,有19例HDV RNA阳性,内蒙古自治区标本HDV RNA阳性率为1.69% (15/886),北京市标本为0.14% (1/708),湖南省标本为0.50% (1/200),新疆维吾尔自治区标本为0.88% (2/226)。各省市自治区HDV RNA阳性
标本检出情况见图1。内蒙古自治区标本HDV RNA
阳性率明显高于北京市 (P=0.002) 和其他地区 (除内蒙古外的其余9个地区) (P<0.001)。对19例HDV RNA阳性标本进行序列测定,利用MEGA 7.0软件构建基于邻位连接法的系统发育树,结果显示,19条HDV序列均与HDV-1型聚类成簇,属于HDV基因1型。
2.3 HDV感染者临床特征分析
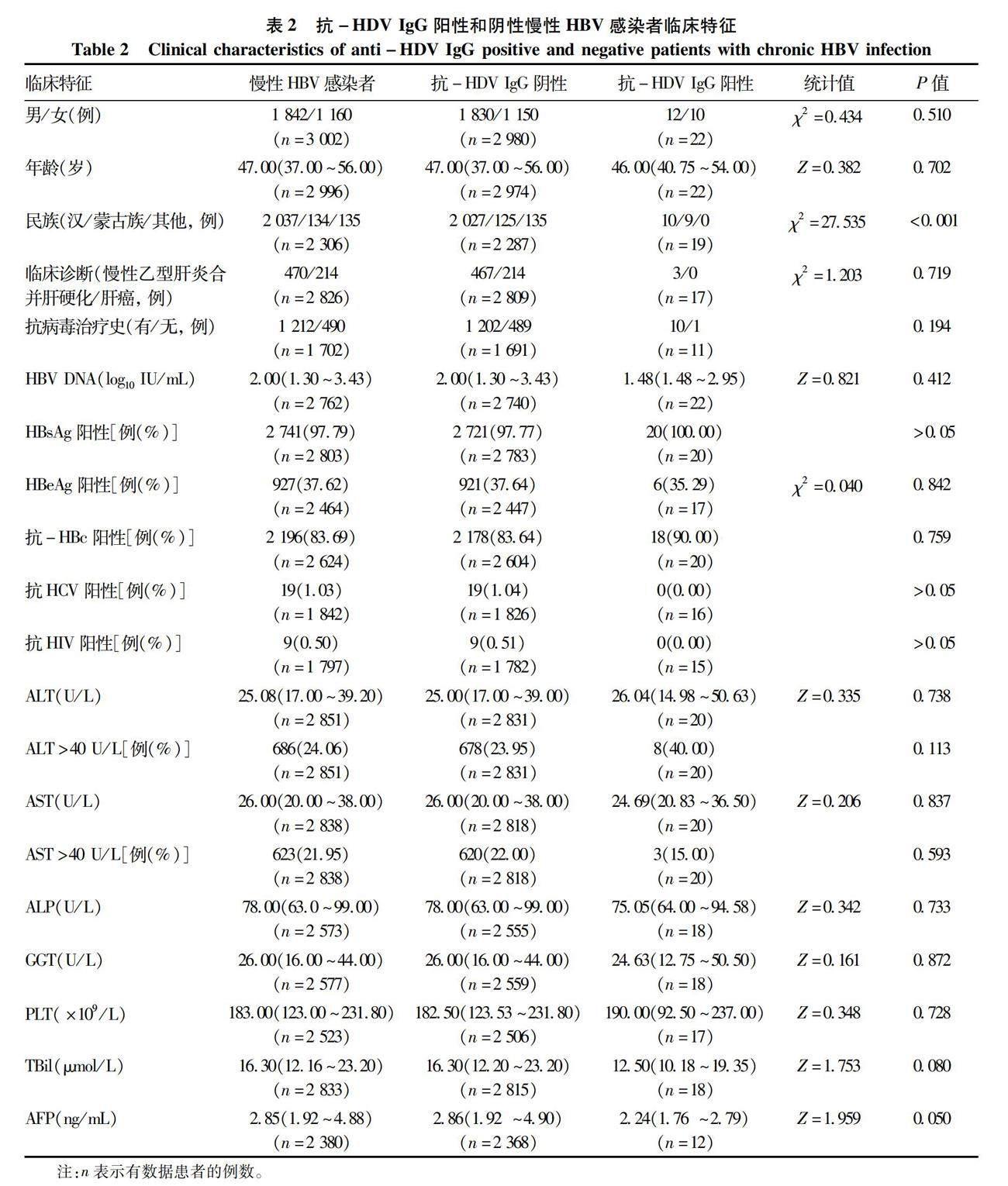
2.3.1 总体HDV感染者临床特征分析 根据抗-HDV IgG检测结果,对慢性HBV感染者的临床特征进行统计分析,因部分患者临床信息缺失,在表2中已标出每项检查有数据患者的例数 (n)。3 131例患者中,抗-HDV IgG阳性22例,阴性3 109例。抗-HDV IgG阳性组与阴性组的年龄及性别差异均无统计学意义 (P值均>0.05)。研究共采集到1 702例患者的抗病毒治疗史信息,其中71.21% (1 212/1 702) 进行过抗病毒治疗,抗-HDV IgG阳性组抗病毒治疗率为90.91%(10/11) ,阴性组为 71.08%(1 202/1 691);同时阳性组HBV DNA为1.48 (1.48 ~ 2.95) log10 IU/mL,陰性组为2.00 (1.30 ~ 3.43) log10 IU/mL,组间差异均无统计学意义 (P值均>0.05)。共收集到2 826例患者的临床诊断信息,诊断为乙型肝炎相关肝硬化/肝癌患者共684例,其中抗-HDV IgG阴性组681例,抗-HDV IgG阳性组3例,两组比较无统计学差异 (P>0.05)。根据慢性HBV感染者民族信息分为汉族、蒙古族和其他少数民族,经Fisher精确检验,抗-HDV IgG阳性组蒙古族患者的比例 (47.37%, 9/19) 明显高于抗-HDV IgG阴性组 (5.47%, 125/2 287) (P<0.001)。其余指标 (如HBV感染相关指标、肝功能指标) 在两组间的比较均无统计学差异(P值均>0.05)。
2.3.2 内蒙古自治区HDV感染者临床特征分析 本研究检测出的抗-HDV IgG阳性患者主要来自内蒙古地区,所以对内蒙古地区抗-HDV IgG阳性和阴性慢性HBV感染者的临床特征进行比较分析。本研究共采集到内蒙古自治区慢性HBV感染者血清886例,抗-HDV IgG阳性组16例,阴性组870例,性别和年龄在两组间比较无统计学差异 (P值均>0.05)。抗-HDV IgG阳性组蒙古族患者占比60.00%(9/15)、ALT异常 (ALT>40 U/L) 患者占比57.14%(8/14)、进行过抗病毒治疗患者占比87.50%(7/8),均显著高于阴性组 (P值均<0.05)。而抗-HDV IgG阳性组患者的HBV DNA水平中位数 [1.90(1.48~3.07) log10 IU/mL] 显著低于阴性组 [2.85(1.48~5.00) log10 IU/mL, P=0.030](图2)。其余指标如AST、ALP、GGT、HBsAg、HBeAg等在抗-HDV IgG阳性和阴性组间均无显著差异 (P值均>0.05)。
3 讨论
HDV通过HBV/HDV联合感染或重叠感染2种形式导致急性或慢性丁性肝炎,加速乙型肝炎患者的疾病进展[18]。7%~14%的HBV/HDV重叠感染者或2%~3%的HBV/HDV联合感染者可发展为重症肝炎,90%的HBV/HDV重叠感染者或2%~5%的HBV/HDV联合感染者可转为慢性丁型肝炎[19]。慢性丁型肝炎是最严重形式的病毒性肝炎,且疾病进展迅速[20]。由于丁型肝炎无特异性疾病表现,若未进行HDV检测,难以区分单纯乙型肝炎和HBV/HDV联合或重叠感染,因此,有必要对HBV感染者进行HDV感染筛查,使HBV感染者知晓自己的HDV感染情况,有利于丁型肝炎患者的进一步临床管理和治疗。目前,无论是欧美国家还是我国的HDV筛查率均较低,这也是很多国家无法获得准确HDV流行病学数据的原因之一[13,21-22]。一些国际指南[23-25]建议对所有慢性HBV感染者或有HDV感染风险因素的HBsAg阳性患者进行HDV感染筛查。当下,丁型肝炎治疗药物研发已取得很大进展,HDV进入抑制剂——Hepcludex于2020年7月获得欧洲药品管理局有条件批准上市,用于治疗血浆 (或血清) HDV RNA阳性的代偿期成人慢性丁型肝炎,其他靶点抗HDV治疗药物的临床试验也在推进[26]。因此,及时掌握HDV感染流行情况,识别HDV感染者,可使患者尽早纳入临床管理,控制病情发展,减少终末期肝病发生,也有利于实现世界卫生组织提出的2030年消除病毒性肝炎公共卫生危害的目标[3]。
系统综述研究[6-7]结果提示,我国HBsAg携带者HDV抗体流行率有所上升,但不同研究结果差异较大,我国现阶段真实的HDV感染流行情况仍需进一步研究。Roggenbach等[27]收集了我国11个省市自治区的3 065例HBsAg阳性患者血清,对HDV流行情况进行分析,结果显示,内蒙古自治区和新疆维吾尔自治区HDV流行率偏高,分别为13.9%和3.9%,其余9个省市未检出HDV抗体阳性标本。王彦[28]对我国7个省市自治区的3 000例慢性乙型肝炎患者进行HDV流行情况调查,发现单独慢性乙型肝炎患者的HDV流行率为0.85%,HIV/HBV合并感染者的HDV流行率为7.91%,四川省 (13.88%) 和广西壮族自治区 (5.32%) HDV流行率偏高,与纳入研究的HIV/HBV合并感染者比例高有关。本研究对来自全国10个省市自治区的3 131例慢性HBV感染者进行HDV感染情况调查,发现内蒙古自治区、北京市、湖南省和新疆维吾尔自治区慢性HBV感染者的抗-HDV IgG阳性率分别为1.81%(16/886)、0.28%(2/708)、1.00%(2/200)和0.88%(2/226),其余地区未检出,总体抗-HDV IgG阳性率为0.70%(22/3 131)。内蒙古自治区慢性HBV感染者抗-HDV IgG阳性率较高,并且蒙古族患者阳性率显著高于汉族和其他民族,其原因可能与民族习惯有关,蒙古族使用刀具的机会较多,这可能会使当地人感染血源性传播疾病的可能性增加,导致HDV流行率较高;也可能与地理位置毗邻HDV高流行区 (蒙古国) 有关[27]。王彦[28]研究报道,少数民族 (以彝族为主) HDV感染者的比例也明显高于汉族。以上研究结果提示,HDV在我国处于低流行态势,不同地区HDV流行率差异大,高风险人群的HDV流行率高。不同研究对同一地区筛查得出的HDV流行率存在差别,可能与研究的地理区域、纳入研究的人群类别及使用的HDV抗体检测试剂不同有关。
另外,本研究在内蒙古地区慢性HBV感染者中发现,HBV/HDV合并感染者接受抗病毒治疗比例高、HBV DNA水平显著低于HBV单独感染者,而ALT异常患者比例显著高于HBV单独感染者。Jang等[29]发现与单独慢性乙型肝炎患者相比,合并HDV感染的患者在抗HBV治疗1年和2年后 ALT异常的风险分别增加30倍和10倍。既往研究[28,30-31]也发现,HDV感染可抑制HBV复制或HBeAg表达,HDV感染者ALT水平反复波动,ALT异常患者比例更高,可能与HDV感染后进一步加重乙型肝炎患者肝损伤有关。因此,建议对抗病毒治疗后无生化学应答的慢性乙型肝炎患者,尤其是HBV DNA低水平患者,进行HDV感染相關检查。但Liao等[32]发现,对慢性乙型肝炎患者,HDV感染者的HBV DNA水平明显低于HBV单独感染者;而对终末期肝病患者,HDV感染者的HBV DNA水平却明显较高,可能提示HDV抑制HBV复制与肝病进展情况有关。
本研究存在一些不足之处。由于本研究为多中心研究,各医院开展的检测项目有差异,收集的临床资料不够完善,部分患者检测项目信息缺失,给临床数据分析造成影响。其次,本研究中大部分患者都接受过乙型肝炎抗病毒治疗,重症肝病患者比例少,可能会影响HDV流行率的估计。除用于治疗乙型肝炎外,聚乙二醇干扰素 (PEG-IFNα) 是目前国外指南唯一推荐用于治疗丁型肝炎的药物,持续病毒学应答率为20%~30%[10,33]。因此,对于使用PEG-IFNα治疗的乙型肝炎患者,若合并HDV感染,也有一定治疗效果。核苷 (酸) 类似物是另一类用于治疗乙型肝炎的药物,虽然对丁型肝炎无治疗效果或效果甚微,但可有效控制乙型肝炎患者的病情进展[34]。研究[35]认为,HDV抗体阳性率随肝病严重程度而明显增加,在轻症肝病患者中发现HDV抗体阳性患者的概率小。另外,本研究未招募到高风险人群 (如HIV、HCV感染者,静脉吸毒者,高风险性行为者等),而有研究[6]发现,这部分人群的HDV感染率显著高于普通HBV感染者。
综上所述,本研究中3 131例慢性HBV感染者的HDV IgG抗体流行率为0.70% (22/3 131),不同地区HDV流行率差异大,内蒙古自治区抗-HDV IgG抗体阳性率 (1.81%) 相对较高。HDV RNA阳性感染者的HDV基因型均为1型。本研究发现我国部分地区HDV流行率较低,但考虑到HDV流行的地区差异、人群差异和HDV感染后的疾病特点,建议对重点地区和高风险人群加大HDV筛查力度,使丁型肝炎患者能获得及时有效治疗;在开展全国乙型肝炎血清流行病学调查时,对HBsAg阳性人群检测抗-HDV IgG,了解我国一般人群的抗-HDV IgG流行率。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:刘玉梅完成实验和数据分析,撰写论文;郭小平、張慧敏、白洪霞、王春梅、任姗、蒋永芳、杨胜、彭锋、王晓忠、于雷、廖柏明、宁玲、何英利、杨霞、黄亮参与收集样本和临床数据;刘学恩、庄辉负责课题设计,指导撰写文章并最后定稿。
参考文献:
[1]
RIZZETTO M. The adventure of delta[J]. Liver Int, 2016, 36(Suppl 1): 135-140. DOI: 10.1111/liv.13018.
[2]YAN H, ZHONG G, XU G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. Elife, 2012, 1: e00049. DOI: 10.7554/eLife.00049.
[3]MIAO Z, XIE Z, REN L, et al. Hepatitis D: advances and challenges[J]. Chin Med J (Engl), 2022, 135(7): 767-773. DOI: 10.1097/CM9.0000000000002011.
[4]DAI ZC, QI GM. National sero-epidemiological survey of viral hepatitis (volume I) 1992-1995[M]. Beijing: Scientific and Technical Documents Publishing House, 1997.
戴志澄, 祁国明. 中国病毒性肝炎血清流行病学调查 (上卷) 1992—1995[M]. 北京: 科学技术文献出版社, 1997.
[5]ZHAN MY, LIU SL, YI YJ, et al. Molecular biology and sero-epidemiology of hepatitis D virus in China[J]. Bulletin Med Res, 1996, 25(10): 9-11.
詹美云, 刘善虑, 易炎杰, 等. 我国丁型肝炎病毒分子生物学和血清流行病学研究[J]. 医学研究通讯, 1996, 25(10): 9-11.
[6]STOCKDALE AJ, KREUELS B, HENRION MYR, et al. The global prevalence of hepatitis D virus infection: systematic review and meta-analysis[J]. J Hepatol, 2020, 73(3): 523-532. DOI: 10.1016/j.jhep.2020.04.008.
[7]CHEN HY, SHEN DT, JI DZ, et al. Prevalence and burden of hepatitis D virus infection in the global population: a systematic review and meta-analysis[J]. Gut, 2019, 68(3): 512-521. DOI: 10.1136/gutjnl-2018-316601.
[8]KOH C, HELLER T, GLENN JS. Pathogenesis of and new therapies for hepatitis D[J]. Gastroenterology, 2019, 156(2): 461-476. DOI: 10.1053/j.gastro.2018.09.058.
[9]FARCI P, NIRO GA. Clinical features of hepatitis D[J]. Semin Liver Dis, 2012, 32(3): 228-236. DOI: 10.1055/s-0032-1323628.
[10]NIRO GA, FERRO A, CICERCHIA F, et al. Hepatitis delta virus: from infection to new therapeutic strategies[J]. World J Gastroenterol, 2021, 27(24): 3530-3542. DOI: 10.3748/wjg.v27.i24.3530.
[11]MIAO Z, ZHANG S, OU X, et al. Estimating the global prevalence, disease progression, and clinical outcome of hepatitis delta virus infection[J]. J Infect Dis, 2020, 221(10): 1677-1687. DOI: 10.1093/infdis/jiz633.
[12]LIU J, LIANG W, JING W, et al. Countdown to 2030: eliminating hepatitis B disease, China[J]. Bull World Health Organ, 2019, 97(3): 230-238. DOI: 10.2471/BLT.18.219469.
[13]LIU HM, TAN ZX, YANG J, et al. Prevalence and clinical characteristics of hepatitis D in southwest of China[J]. Chin J Exp Clin Virol, 2022, 36(1): 85-91. DOI: 10.3760/cma.j.cn112866-20210611-00096.
劉慧敏, 谭朝霞, 杨京, 等. 中国西南地区丁型肝炎的流行状况与临床特征分析[J]. 中华实验和临床病毒学杂志, 2022, 36(1): 85-91. DOI: 10.3760/cma.j.cn112866-20210611-00096.
[14]Chinese Society of Infectious Disesses, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南 (2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.
[15]Bureau of Medical Administration, National Health Commission of the Peoples Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. J Clin Hepatol, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.
中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范 (2019年版)[J]. 临床肝胆病杂志, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.
[16]PERVEEN S, NASIR MI, SHAHID SM, et al. Phylogenetic analysis of HDV isolates from HBsAg positive patients in Karachi, Pakistan[J]. Virol J, 2012, 9: 162. DOI: 10.1186/1743-422X-9-162.
[17]LIU YM, BAI HX, MA YH, et al. Evaluation of four anti-HDV IgG detection reagents for hepatitis D virus[J]. Chin J Viral Dis, 2022, 12(3): 170-174. DOI: 10.16505/j.2095-0136.2022.0024.
刘玉梅, 白洪霞, 马亚红, 等. 4种丁型肝炎病毒IgG抗体检测试剂的评价[J]. 中国病毒病杂志, 2022, 12(3): 170-174. DOI: 10.16505/j.2095-0136.2022.0024.
[18]BOTELHO-SOUZA LF, VASCONCELOS MPA, DOS SANTOS AO, et al. Hepatitis delta: virological and clinical aspects[J]. Virol J, 2017, 14(1): 177. DOI: 10.1186/s12985-017-0845-y.
[19]SAGNELLI C, PISATURO M, CURATOLO C, et al. Hepatitis B virus/hepatitis D virus epidemiology: changes over time and possible future influence of the SARS-CoV-2 pandemic[J]. World J Gastroenterol, 2021, 27(42): 7271-7284. DOI: 10.3748/wjg.v27.i42.7271.
[20]RIZZETTO M, HAMID S, NEGRO F. The changing context of hepatitis D[J]. J Hepatol, 2021, 74(5): 1200-1211. DOI: 10.1016/j.jhep.2021.01.014.
[21]EL BOUZIDI K, ELAMIN W, KRANZER K, et al. Hepatitis delta virus testing, epidemiology and management: a multicentre cross-sectional study of patients in London[J]. J Clin Virol, 2015, 66: 33-37. DOI: 10.1016/j.jcv.2015.02.011.
[22]SAFAIE P, RAZEGHI S, ROUSTER SD, et al. Hepatitis D diagnostics: utilization and testing in the United States[J]. Virus Res, 2018, 250: 114-117. DOI: 10.1016/j.virusres.2018.03.013.
[23]European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
[24]TERRAULT NA, LOK ASF, MCMAHON BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599. DOI: 10.1002/hep.29800.
[25]SARIN SK, KUMAR M, LAU GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016, 10(1): 1-98. DOI: 10.1007/s12072-015-9675-4.
[26]LIU YM, LIU XE, ZHUANG H. Advances in development of new anti-HDV drugs[J]. Chin J Viral Dis, 2021, 11(6): 414-419. DOI: 10.16505/j.2095-0136.2021.0054.
刘玉梅, 刘学恩, 庄辉. 丁型肝炎抗病毒新药研究进展[J]. 中国病毒病杂志, 2021, 11(6): 414-419. DOI: 10.16505/j.2095-0136.2021.0054.
[27]ROGGENBACH I, CHI X, LEMPP FA, et al. HDV seroprevalence in HBsAg-positive patients in China occurs in hotspots and is not associated with HCV mono-infection[J]. Viruses, 2021, 13(9): 1799. DOI: 10.3390/v13091799.
[28]
WANG Y. Survey of HDV infection and molecular characterization of HDV, HBV and HIV-1 among chronic hepatitis B patients in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2018.
王彥. 我国丁型肝炎病毒感染情况调查和病毒分子特性研究[D]. 北京: 中国疾病预防控制中心, 2018.
[29]JANG TY, WEI YJ, YEH ML, et al. Role of hepatitis D virus in persistent alanine aminotransferase abnormality among chronic hepatitis B patients treated with nucleotide/nucleoside analogues[J]. J Formos Med Assoc, 2021, 120(1 Pt 2): 303-310. DOI: 10.1016/j.jfma.2020.10.002.
[30]GU XH, LI QF, WANG YM. Clinical characteristics of the patients with hepatitis B combining hepatitis D infection[J]. Chin J Hepatol, 2001, 9(1): 34-36.DOI:10.3760/j.issn:1007-3418.2001.01.011.
顾小红, 李奇芬, 王宇明. 伴HDV感染的乙型肝炎患者的临床特征[J].中华肝脏病杂志, 2001, 9(1): 34-36.DOI:10.3760/j.issn:1007-3418.2001.01.011.
[31]WU S, ZHANG Y, TANG Y, et al. Molecular epidemiology and clinical characteristics of hepatitis delta virus (HDV) infected patients with elevated transaminases in Shanghai, China[J]. BMC Infect Dis, 2020, 20(1): 565. DOI: 10.1186/s12879-020-05275-1.
[32]LIAO B, ZHANG F, LIN S, et al. Epidemiological, clinical and histological characteristics of HBV/HDV co-infection: a retrospective cross-sectional study in Guangdong, China[J]. PLoS One, 2014, 9(12): e115888. DOI: 10.1371/journal.pone.0115888.
[33]LEE AU, LEE C. Hepatitis D review: challenges for the resource-poor setting[J]. Viruses, 2021, 13(10): 1912. DOI: 10.3390/v13101912.
[34]FARCI P, ANNA NIRO G. Current and future management of chronic hepatitis D[J]. Gastroenterol Hepatol (N Y), 2018, 14(6): 342-351.
[35]RIZZETTO M, HAMID S. The medical impact of hepatitis D virus infection in Asia and Africa; time for a reappraisal[J]. Liver Int, 2021, 41(1): 16-19. DOI: 10.1111/liv.14729.
收稿日期:
2022-11-06;录用日期:2022-12-10
本文编辑:刘晓红
