miR-429对乳腺癌细胞增殖和迁移的影响及其机制
2023-04-29牛婷婷吴琍侯琳仇碧茹赵晓晖李金洋
牛婷婷 吴琍 侯琳 仇碧茹 赵晓晖 李金洋

[摘要] 目的 探討miR-429对乳腺癌细胞增殖和迁移的影响及其机制。方法 采用实时荧光定量PCR(RT-qPCR)法和免疫印迹法,分别检测乳腺癌MCF-7、MDA-MB-231、MDA-MB-468、BT-549细胞及正常乳腺上皮细胞MCF-10A的eIF4E mRNA和蛋白相对表达量。在MCF-7细胞中转染miR-429 mimics(A组)、mimics NC(B组)、miR-429 inhibitors(C组)及inhibitors NC(D组),采用RT-qPCR法、CCK8法、细胞划痕实验和免疫印迹法检测A~D组细胞miR-429表达情况、细胞增殖和迁移情况、eIF4E mRNA和蛋白相对表达量。在293T细胞中转染eIF4E-3′UTR-Wt+miR-429 mimics(E组)、eIF4E-3′UTR-Wt+mimics NC(F组)、eIF4E-3′UTR-Mut+miR-429 mimics(G组)、eIF4E-3′UTR-Mut+mimics NC(H组),检测E~H组细胞相对荧光素酶活性,分析miR-429对eIF4E的靶向调控作用。结果 RT-qPCR与免疫印迹检测结果显示,MCF-7、MDA-MB-231、MDA-MB-468、BT-549细胞中的eIF4E mRNA以及蛋白的相对表达量均明显高于正常乳腺上皮细胞MCF-10A(F=74.414、1 981.243,P<0.01)。RT-qPCR法检测结果显示,A组细胞的miR-429相对表达量明显高于B组(t=25.390,P<0.01),而eIF4E mRNA相对表达量明显低于B组(t=-6.363,P<0.05),C组细胞miR-429相对表达量明显低于D组(t=-4.652,P<0.05),而eIF4E mRNA相对表达量明显高于B组(t=-2.928,P<0.05)。CCK8实验检测结果显示,与B组细胞相比,A组细胞第24、48、72小时时的增殖活力明显降低(F=26.148~40.997,P<0.01);与D组细胞相比,C组细胞第24、48、72小时增殖活力明显增高(F=6.410~82.593,P<0.05)。细胞划痕实验显示,A组细胞愈合率明显低于B组(t=-22.584,P<0.01),C组细胞愈合率明显高于D组(t=11.464,P<0.01)。免疫印迹法检测结果显示,A组细胞中eIF4E蛋白相对表达量明显低于B组(t=-20.355,P<0.01),C组细胞eIF4E蛋白相对表达量明显高于D组(t=3.622,P<0.01)。双荧光素酶报告基因实验结果显示,各组细胞相对荧光素酶活性比较差异具有显著性(F=366.823,P<0.05),而且E组细胞相对荧光素酶活性显著低于F组(t=-42.961,P<0.01)。结论 miR-429或通过靶向调控eIF4E基因进而抑制乳腺癌细胞的增殖和迁移。
[关键词] 乳腺肿瘤;微RNAs;真核细胞起始因子4E;细胞增殖;细胞运动
[中图分类号] R737.9
[文献标志码] A
EFFECT OF miR-429 ON THE PROLIFERATION AND MIGRATION OF BREAST CANCER CELLS AND ITS MECHANISM\ NIU Tingting, WU Li, HOU Lin, QIU Biru, ZHAO Xiaohui, LI Jinyang (Department of Breast Surgery, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT] Objective To investigate the effect of miR-429 on the proliferation and migration of breast cancer cells and its mechanism. Methods RT-qPCR and Western blotting were used to measure the relative mRNA and protein expression levels of eIF4E in breast cancer MCF-7, MDA-MB-231, MDA-MB-468, and BT-549 cells and normal breast epithelial MCF-10A cells. MCF-7 cells were transfected with miR-429 mimics (group A), mimics NC (group B), miR-429 inhibitors (group C), and inhibitors NC (group D), and RT-qPCR, CCK-8 assay, wound healing assay, and Western blotting were used to measure the expression of miR-429, cell proliferation and migration, and the relative mRNA and protein expression levels of eIF4E in groups A-D. The 293T cells were transfected with eIF4E-3′UTR-Wt+miR-429 mimics (group E), eIF4E-3′UTR-Wt+mimics NC (group F), eIF4E-3′UTR-Mut+miR-429 mimics (group G), and eIF4E-3′UTR-Mut+mimics NC (group H), and relative luciferase activity was measured for groups E-H. The targeted regulatory effect of miR-429 on eIF4E was analyzed. Results RT-qPCR and Western blotting showed that the relative mRNA and protein expression levels of eIF4E in MCF-7, MDA-MB-231, MDA-MB-468, and BT-549 cells were significantly higher than those in normal breast epithelial MCF-10A cells (F=74.414,1 981.243,P<0.01). RT-qPCR showed that compared with group B, group A had a significantly higher relative expression level of miR-429 (t=25.390,P<0.01) and a significantly lower relative mRNA expression level of eIF4E (t=-6.363,P<0.05); group C had a signi-ficantly lower relative expression level of miR-429 than group D (t=-4.652,P<0.05) and a significantly higher relative mRNA expression level of eIF4E than group B (t=-2.928,P<0.05). CCK8 assay showed that compared with group B, group A had a significant reduction in proliferation activity at 24, 48, and 72 hours (F=26.148-40.997,P<0.01), and compared with group D, group C had a significant increase in proliferation activity at 24, 48, and 72 hours (F=6.410-82.593,P<0.05). Wound healing assay showed that group A had a significantly lower healing rate than group B (t=-22.584,P<0.01), and group C had a significantly higher healing rate than group D (t=11.464,P<0.01). Western blotting showed that group A had a significantly lower relative protein expression level of eIF4E than group B (t=-20.355,P<0.01), and group C had a significantly higher relative protein expression level of eIF4E than group D (t=3.622,P<0.01). Dual-luciferase reporter assay showed that there was a significant difference in relative luciferase activity between groups (F=366.823,P<0.05), and group E had a significantly lower relative luciferase activity than group F (t=-42.961,P<0.01). ConclusionThis study shows that miR-429 may inhibit the proliferation and migration of breast cancer cells through targeted regulation of the eIF4E gene.
[KEY WORDS] Breast neoplasms; MicroRNAs; Eukaryotic initiation factor-4E; Cell proliferation; Cell movement
乳腺癌的发病率远高于其他女性肿瘤,严重威胁着女性生命健康,已成为全球第一大常见肿瘤[1]。微小RNA(miRNA)是在真核生物中内源性的具有调控功能的一类小分子非编码RNA,其作用机制为通过与目的基因mRNA的3′非翻译区(UTR)碱基互补配对结合,以转录后调节的方式调控靶基因的表达水平,影响细胞增殖、迁移等的生物学行为[2]。miR-429属于miRNA-200家族,作为癌基因或抑癌基因在多种肿瘤的发生发展中发挥着重要的调控作用[3-4]。相关研究表明miR-429在乳腺癌中呈低表达,扮演抑癌基因的角色[5]。真核细胞翻译起始因子4E(eIF4E)可在翻译起始时特异性识别结合真核mRNA的5′端帽子结构[6],通过使5′UTR解旋影响mRNAs的代谢、加工、运输、翻译等,在帽依赖的翻译起始阶段发挥限制调控作用,调控蛋白质合成[7-9]。近年研究发现,eIF4E在乳腺癌组织中可能呈高表达,且其表达水平与乳腺癌的发生、浸润和转移密切相关[10]。目前关于miR-429在乳腺癌发生进展中的调控机制尚不明确。本研究主要验证和探讨miR-429与eIF4E在乳腺癌中的靶向关系及其在乳腺癌细胞增殖、迁移中的作用,以求为乳腺癌的早期诊断、治疗提供新的靶点。
1 材料与方法
1.1 细胞与试剂
人正常乳腺上皮细胞MCF-10A、人乳腺癌细胞系MDA-MB-231、MDA-MB-468、MCF-7、BT-549以及293T细胞获自青岛大学医学部分子生物学与生物化学实验室。DMEM培养基购于武汉普诺赛生命科技有限公司,胰蛋白酶消化液、青/链霉素混合液、CCK-8试剂盒、蛋白浓度测定试剂盒购于自北京索莱宝生物科技有限公司,双荧光素酶报告基因检测试剂盒购买于北京全式金生物;转染试剂RNAi购于上海汉恒生物科技有限公司,Trizol Reagent购于美国Invitrogen公司,eIF4E抗体购于英国Abcam公司,GAPDH单克隆抗体购于武汉爱博泰克生物科技有限公司。
1.2 细胞培养及分组
将MCF-7、MDA-MB-231、MDA-MB-468、BT-549、MCF-10A、293T细胞置于含体积分数0.10胎牛血清和青/链霉素溶液的DMEM培养基中(其中青霉素浓度为1 000 U/L,链霉素浓度为1 mg/L),于37 ℃、含体积分数0.05 CO2的细胞培养箱中常规培养,传1~2代且待细胞融合度达到80%~90%时备用。在6孔板中培养MCF-7细胞,当其融合度达到60%~70%时,细胞分别转染miR-429 mimics(A组)、mimics NC(B組)、inhibitors(C组)以及inhibitors NC(D组)。构建eIF4E-野生型(Wt)和eIF4E-突变型(Mut)重组质粒,接种239T细胞于6孔板中,37 ℃下培养,待其融合度约达40%时,分别转染eIF4E-3′UTR-Wt+miR-429 mimics(E组)、eIF4E-3′UTR-Wt+mimics NC(F组)、eIF4E-3′UTR-Mut+miR-429 mimics(G组)以及eIF4E-3′UTR-Mut+mimics NC(H组)。
1.3 实时荧光定量PCR(RT-qPCR)法和免疫印迹法检测乳腺癌细胞MCF-7、MDA-MB-231、MDA-MB-468、BT-549以及正常乳腺上皮细胞MCF-10A中eIF4E mRNA、蛋白相对表达量
使用Trizol试剂提取MCF-7、MDA-MB-231、MDA-MB-468、BT-549、MCF-10A细胞RNA,逆转录构建cDNA,eIF4E mRNA以GAPDH为内参照,采用RT-qPCR法检测各细胞系eIF4E mRNA的表达。上机反应条件为:95 ℃预变性5 min;然后95 ℃变性10 s,60 ℃退火/延伸30 s,共循环40次。各样本重复检测3次,以2-△△CT方法计算eIF4E mRNA相对表达量。各引物序列见表1。
以RIPA裂解液裂解提取上述细胞中的蛋白,BCA试剂盒测定蛋白浓度,然后在SDS-PAGE上80 V电泳30 min,转膜,室温下以50 g/L脱脂奶粉封闭2 h,加入内参GAPDH一抗(1∶1 000)、目的基因eIF4E一抗(1∶2 000),4 ℃下过夜,1×TBST洗膜3次,每次10 min;二抗室温孵育1 h,用1×TBST洗膜3次,每次10 min;ECL发光液1∶1加到PVDF膜上,室温放置1 min,采用成像系统显影、拍照并测量灰度值,以计算eIF4E蛋白的相对表达量。eIF4E蛋白相对表达量=eIF4E蛋白条带灰度值/内参GAPDH蛋白条带灰度值。
1.4 CCK-8法检测A~D组细胞增殖活力
收集转染后各组MCF-7细胞以2 000个/孔接种至96孔板,37 ℃常规培养,每组设置5个复孔,待细胞贴壁后转染,第0、24、48、72小时时分别向各孔细胞中加入10 μL CCK8检测试剂,细胞培养箱内孵育2 h,酶标仪测定波长450 nm处各孔吸光(A)值,以吸光度值反映细胞的增殖活力。
1.5 细胞划痕实验检测A~D组细胞迁移能力
准备6孔板,用马克笔在6孔板背后画横线,横线相隔1 cm。将A~D组细胞接种于6孔板内,待细胞生长至铺满整孔时,用200 μL枪头垂直于6孔板背后横线划痕,此时可出现一条无细胞区域,用无血清培养基冲洗除去所有被刮下的细胞及碎片,在6孔板中每孔加入2 mL无血清培养基,拍照显微镜在第0、24小时时拍摄划痕愈合的情况,并计算愈合率。愈合率=(24 h痕迹面积-0 h痕迹面积)/0 h痕迹面积×100%。
1.6 E~H组细胞双荧光素酶报告基因活性检测
在37 ℃下培养E~H组细胞48 h,收集各组细胞并接种于96孔板中。裂解细胞,离心取上清液备用,使用双荧光素酶报告基因试剂盒于多功能酶标仪中测定萤火虫荧光素酶和海肾荧光素酶的活性值,并计算相对荧光素酶的活性值。相对荧光素酶的活性值=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.7 RT-qPCR法检测A~D组细胞中miR-429、eIF4E mRNA相对表达量
使用Trizol试剂提取A~D组细胞总RNA,逆转录构建cDNA,miR-429以U6为内参照,eIF4E mRNA以GAPDH为内参照,采用RT-qPCR法检测各组细胞miR-429及eIF4E mRNA的表达。上机反应条件同1.3。各引物序列见表1。
1.8 免疫印迹法测定A~D组MCF-7细胞eIF4E蛋白相对表达量
收集A~D组MCF-7细胞,RIPA裂解液裂解提取蛋白,BCA试剂盒测定蛋白浓度。采用免疫印迹法检测各组细胞eIF4E蛋白的表达量。
1.9 统计学方法
使用SPSS 26.0软件对实验数据进行统计学分析,以Image J软件处理图像。所有实验均独立重复3次,结果取均值。各细胞系中eIF4E mRNA及蛋白均以MCF-10A作为对照,A、C组miR-429、eIF4E mRNA及蛋白以B、D组为对照,将数据进行归一化处理。正态分布的计量资料以x?±s表示,两组比较采用t检验,多组数据比较采用单因素方差分析,两组不同时间比较采用重复测量设计方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各乳腺癌细胞系及正常乳腺上皮细胞eIF4E mRNA及蛋白表达情况
RT-qPCR法检测结果显示,乳腺癌MDA-MB-468、MCF-7、BT549、MDA-MB-231细胞以及正常乳腺上皮细胞MCF-10A的eIF4E mRNA相对表达量分别为2.077±0.119、1.443±0.055、1.175±0.064、1.113±0.041、1.000±0.057,各组比较差异有显著性(F=74.414,P<0.01)。免疫印迹结果显示,上述各细胞系中eIF4E蛋白相对表达量分别为3.483±0.025、2.675±0.038、2.038±0.019、1.635±0.039、1.000±0.027,各组比较差异有显著性(F=1 981.243,P<0.01)。
2.2 A~D组细胞miR-429相对表达量比较
RT-qPCR结果显示,A~D组细胞miR-429相对表达量分别为41.565±2.259、1.000±0.048、0.578±0.087、1.000±0.094,各组细胞miR-429相对表达量比较差异均具有显著性(F=647.102,P<0.01);其中A组较B组细胞miR-429相对表达量显著增高(t=25.390,P<0.01),C组较D组细胞miR-429的相对表达量显著降低(t=-4.652,P<0.05),说明转染成功,可进行后续实验。
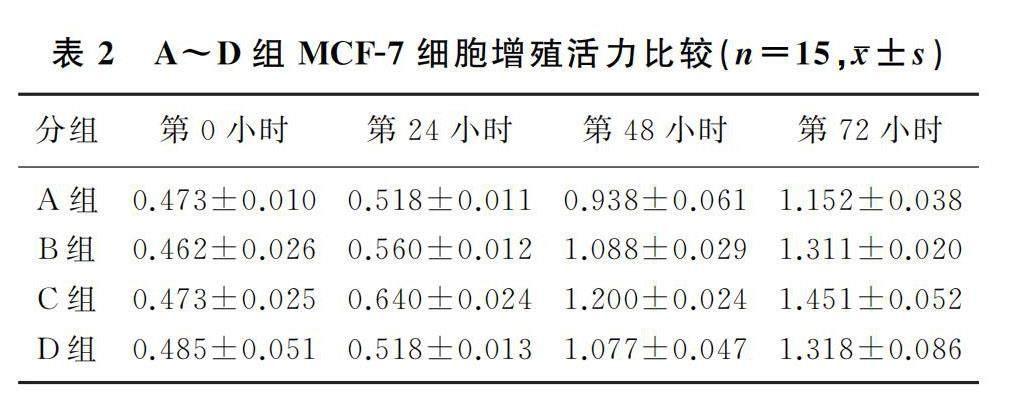
2.3 A~D组细胞增殖活力比较
重复测量设计的方差分析结果显示,时间、组别、时间与组别交互作用对A、B组MCF-7细胞增殖活力均具有显著的影响(F时间=1 146.338,F组别=39.809,F时间*组别=14.510,P<0.01)。单独效应分析结果显示,A组细胞第0、24小时时的增殖活力相比,B组细胞第0、24小时时的增殖活力相比,差异均有显著性(F=332.338、827.901,P<0.01);培养至第24、48、72小时时,A组细胞增殖活力明显低于B组(F=26.148~40.997,P<0.01)。重复测量设计的方差分析结果显示,时间、组别、时间与组别交互作用对C、D组MCF-7细胞增殖活力均具有明顯的影响(F时间=682.353,F组别=32.159,F时间*组别=4.321,P<0.01)。单独效应分析结果显示,C组细胞第0、24小时时的增殖活力相比,D组细胞第0、24小时时的增殖活力相比,差异均具有显著性(F=756.132、209.376,P<0.01);培养至第24、48、72小时时,C组细胞的增殖活力较D组显著性增强(F=6.410~82.593,P<0.05)。见表2。
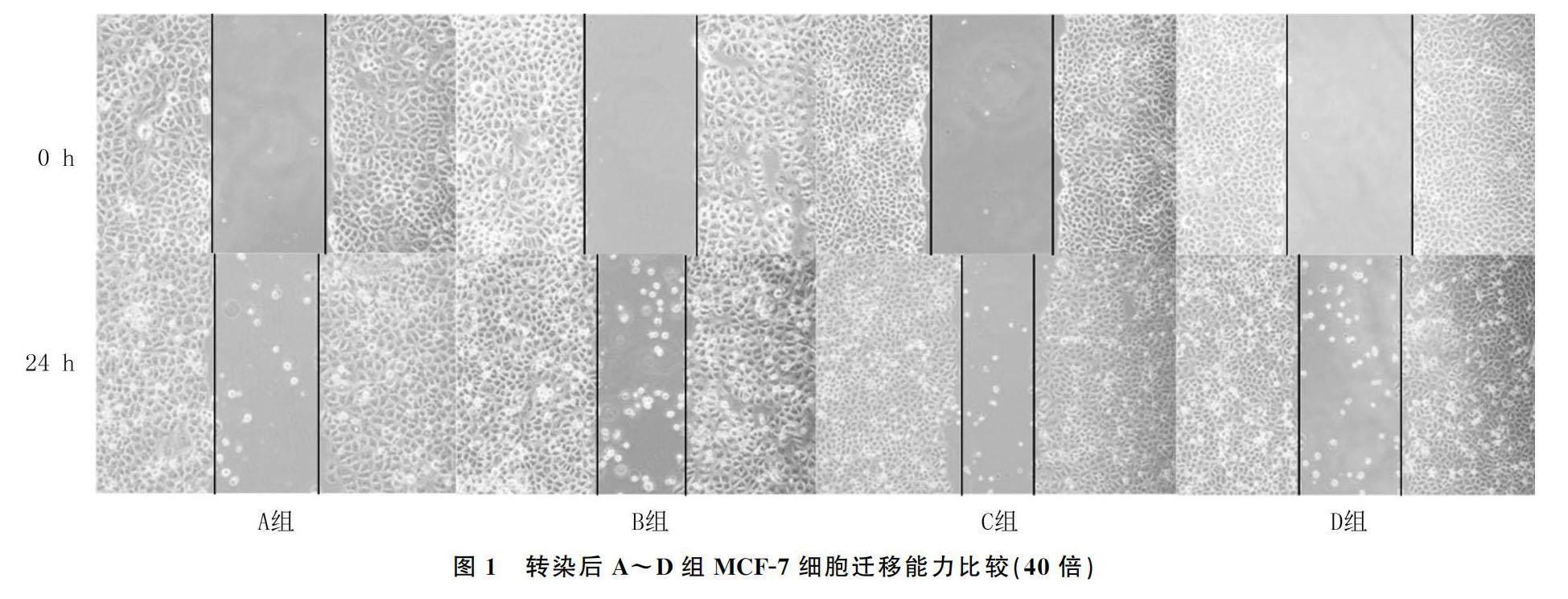
2.4 A~D组细胞迁移能力比较
细胞划痕实验结果显示,A~D组的细胞愈合率分别为16.497±0.419、31.806±0.862、39.293±0.715、31.428±0.656,各组细胞愈合率比较差异有显著性(F=392.425,P<0.01);其中A组细胞较B组细胞愈合率明显降低(t=-22.584,P<0.01);而C组细胞较D组细胞愈合率明显增高(t=11.464,P<0.01)。见图1。
2.5 E~H组细胞双荧光素酶报告基因活性检测
双荧光素酶报告基因实验检测结果显示,E~H组细胞相对荧光素酶活性值分别为0.503±0.008、0.997±0.014、0.995±0.031、0.995±0.011,各组细胞相对荧光素酶活性比较差异均具有显著性(F=366.823,P<0.05);其中E组较F组细胞相对荧光素酶活性显著性下调(t=-42.961,P<0.01),G组与H组细胞比较相对荧光素酶活性无显著性变化(P>0.05)。
2.6 A~D组细胞eIF4E mRNA相对表达量比较
RT-qPCR法结果显示,A~D组细胞eIF4E mRNA的相对表达量分别为0.304±0.050、1.000±0.144、1.727±0.328、1.000±0.126,各组细胞中eIF4E mRNA相对表达量比较差异有显著性(F=18.342,P<0.01);其中A组较B组细胞eIF4E mRNA的相对表达量显著降低(t=-6.363,P<0.05),C组较D组细胞eIF4E mRNA的相对表达量显著升高(t=-2.928,P<0.05)。
2.7 A~D组eIF4E蛋白相对表达量比较
免疫印迹结果显示,A~D组细胞eIF4E蛋白相对表达量分别为0.309±0.012、1.000±0.046、1.166±0.058、1.000±0.028,各组细胞eIF4E蛋白相对表达量比较差异具有显著性(F=178.306,P<0.01);其中A组较B组细胞eIF4E蛋白相对表达量显著降低(t=-20.355,P<0.01),C组较D细胞eIF4E蛋白的相对表达量显著升高(t=3.622,P<0.05)。见图2。
3 讨论
乳腺癌是一种十分常见女性恶性肿瘤,目前其发病率呈逐年上升趋势,因此发现并了解参与乳腺癌发生发展的可能基因位点,探讨乳腺癌发生的分子机制,具有十分重要的意义[11]。
miRNA通過与目的基因mRNA的3′UTR碱基互补配对结合,降解或抑制靶基因转录,从而抑制转录后蛋白质的翻译,负性调节基因表达,影响癌细胞生物学功能[2-3,12]。有研究发现,miR-429在多种肿瘤中存在表达并发挥调控作用。如miR-429在肾细胞癌[13]、胰腺导管腺癌[14]、子宫颈癌[15]等肿瘤中呈低表达,可发挥抑癌基因作用;但在肺癌[16]、前列腺癌[17]、子宫内膜癌[18]等肿瘤中呈高表达,发挥癌基因作用。目前相关的研究发现,miR-429可通过调控Bcl-2、LRP1、ZEB1/ZEB2等靶基因来参与细胞增殖[4]、侵袭及上皮间质转化等过程[19]。
研究发现,eIF4E的过表达在体外可促进细胞的增殖和恶性转化,在体内实验中则可促进小鼠肿瘤的形成并增加肿瘤侵袭性[20]。eIF4E作为正常的翻译起始因子存在于所有正常细胞中,但在多种恶性肿瘤中被检测到其高表达,因此eIF4E可能作为癌基因在肿瘤发病中起着重要作用[21]。eIF4E表达水平与肿瘤的发生、进展和转移等恶性生物学行为密切相关,elF4E表达升高时可以促进一部分eIF4E敏感性的基因(如c-Myc[22]、VEGF[23]以及MMP-9等)的出核和翻译启动,进而促进癌基因表达。eIF4E蛋白磷酸化在eIF4E致癌机制中起决定性的作用[6],eIF4E的磷酸化水平在多种肿瘤中升高并与肿瘤进展和预后相关。研究证实,磷酸化的eIF4E可以使肿瘤细胞获得最大的侵袭和转移潜能[24-25],转移性肿瘤细胞中磷酸化eIF4E水平远高于非侵袭性或非转移性细胞[26]。miR-429是否参与调控eIF4E磷酸化过程以及是否能够调控磷酸化eIF4E蛋白参与肿瘤细胞恶性行为,有待进一步实验验证和探讨。
本研究采用生物信息学方法预测miR-429与eIF4E靶向关系,结果显示eIF4E基因3′UTR与miR-429存在互补配对的结合位点;E组细胞较F组细胞相对荧光素酶活性显著下调,双荧光素酶实验表明miR-429与eIF4E间存在结合作用;A组细胞较B组细胞miR-429表达水平增高,细胞增殖及迁移能力被显著抑制,eIF4E mRNA和蛋白表达水平显著降低;而C组细胞较D组细胞miR-429表达被抑制,细胞增殖、迁移能力明显增强,eIF4E mRNA和蛋白表达水平升高。故而证明miR-429通过靶向eIF4E调控乳腺癌的增殖、迁移能力,从而抑制乳腺癌的发生发展。miR-429与eIF4E基因3′UTR互补结合以实现调控作用,调控机制可能为miR-429抑制或降解eIF4E mRNA,进而抑制翻译产生eIF4E蛋白,最终减少翻译起始复合物的形成,影响基因5′UTR解旋,减少其他相关癌蛋白的合成。
综上所述,miR-429可通过靶向调控eIF4E抑制乳腺癌细胞的增殖和迁移,从而抑制乳腺癌发生进展。生物信息学预测发现miR-429参与调控多个靶基因以及信号通路,其调控更多靶基因的机制以及eIF4E促癌的机制尚需进一步研究。
作者声明:牛婷婷、侯琳、吴琍参与了研究设计;牛婷婷、吴琍、仇碧茹、赵晓晖、李全洋参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]宓露丝,李婧婷,边学海,等. CYFRA21.1在辅助乳腺癌临床诊疗中的应用进展[J]. 中国实验诊断学, 2021,25(8):1240-1243.
[2]CORREIA DE SOUSA M, GJORGJIEVA M, DOLICKA D, et al. Deciphering miRNAs' action through miRNA editing[J]. Int J Mol Sci, 2019,20(24):6249.
[3]韩清昕,侯琳,吴琍,等. miR-429对乳腺癌细胞增殖的影响及其作用机制[J]. 精准医学杂志, 2020,35(4):334-338.
[4]GUO C M, LIU S Q, SUN M Z. miR-429 as biomarker for diagnosis, treatment and prognosis of cancers and its potential action mechanisms: A systematic literature review[J]. Neoplasma, 2020,67(2):215-228.
[5]ZHANG X X, YU X Y, ZHAO Z G, et al. microRNA-429 inhibits bone metastasis in breast cancer by regulating CRKL and MMP-9[J]. Bone, 2020,130:115139.
[6]YANG X T, ZHONG W, CAO R F. Phosphorylation of the mRNA cap-binding protein eIF4E and cancer[J]. Cell Signal, 2020,73:109689.
[7]UTTAM S, WONG C, PRICE T J, et al. eIF4E-dependent translational control: A central mechanism for regulation of pain plasticity[J]. Front Genet, 2018,9:470.
[8]ROSS-KASCHITZA D, ALTMANN M. eIF4E and interactors from unicellular eukaryotes[J]. Int J Mol Sci, 2020,21(6):2170.
[9]HERNNDEZ G. The versatile relationships between eIF4E and eIF4E-interacting proteins[J]. Trends Genet, 2022,38(8):801-804.
[10]田世馨,尚立娜,馬应全,等. 乳腺癌中肿瘤相关巨噬细胞的浸润与eIF4E表达的关系[J]. 西北民族大学学报(自然科学版), 2019,40(3):54-58.
[11]何丽杰,陈会佳,王静,等. miRNA-200b通过靶向RhoA抑制宫颈癌细胞增殖、促进细胞凋亡[J]. 中国免疫学杂志, 2021,37(13):1576-1581.
[12]LU T X, ROTHENBERG M E. microRNA[J]. J Allergy Clin Immunol, 2018,141(4):1202-1207.
[13]郭春梅,刘淑清,孙明忠. miR-429与肿瘤[J]. 中国生物化学与分子生物学报, 2018,34(8):826-832.
[14]LIU D, SONG L Q, DAI Z J, et al. miR-429 suppresses neurotrophin-3 to alleviate perineural invasion of pancreatic cancer[J]. Biochem Biophys Res Commun, 2018,505(4):1077-1083.
[15]SHEN F J, ZHENG H Y, ZHOU L M, et al. Overexpression of MALAT1 contributes to cervical cancer progression by ac-ting as a sponge of miR-429[J]. J Cell Physiol, 2019,234(7):11219-11226.
[16]张文思,陈吉. 肝癌缺失基因-1在结肠癌中的相关性研究[J]. 中西医结合心血管病电子杂志, 2018,6(16):27,30.
[17]ABISOYE-OGUNNIYAN A, LIN H X, GHEBREMEDHIN A, et al. Transcriptional repressor kaiso promotes epithelial to mesenchymal transition and metastasis in prostate cancer through direct regulation of miR-200c[J]. Cancer Lett, 2018,431:1-10.
[18]DONKERS H, BEKKERS R, GALAAL K. Diagnostic value of microRNA panel in endometrial cancer: A systematic review[J]. Oncotarget, 2020,11(21):2010-2023.
[19]SHEN J, HONG L, YU D, et al. LncRNA XIST promotes pancreatic cancer migration, invasion and EMT by sponging miR-429 to modulate ZEB1 expression[J]. Int J Biochem Cell Biol, 2019,113:17-26.
[20]ROBICHAUD N, HSU B E, ISTOMINE R, et al. Translational control in the tumor microenvironment promotes lung metastasis: Phosphorylation of eIF4E in neutrophils[J]. Proc Natl Acad Sci U S A, 2018,115(10):E2202-E2209.
[21]LIU X J, VAIDYA A M, SUN D, et al. Role of eIF4E on epithelial-mesenchymal transition, invasion, and chemoresistance of prostate cancer cells[J]. Cancer Commun, 2020,40(2-3):126-131.
[22]KNIGHT J R P, ALEXANDROU C, SKALKA G L, et al. MNK inhibition sensitizes KRAS-mutant colorectal cancer to mTORC1 inhibition by reducing eIF4E phosphorylation and c-MYC expression[J]. Cancer Discov, 2021,11(5):1228-1247.
[23]胡權腾,郭海谢,吴春雷,等. 基于AKT/mT0RC1和HIF1/VEGF通路研究eIF4E基因调控肺腺癌血管新生中的作用机制[J]. 中国卫生检验杂志, 2020,30(18):2183-2185,2207.
[24]邢运,周大臣,贺良,等. 萝卜硫素下调结直肠癌中eIF4F翻译起始复合物的表达[J]. 安徽医科大学学报, 2022,57(10):1645-1649,1655.
[25]JIA X F, ZHOU H. Phospho-eIF4E: A new target for acute myeloid leukemia[J]. Curr Protein Pept Sci, 2021,22:328-335.
[26]TANG Y X, LUO J D, YANG Y, et al. Overexpression of p-4EBP1 associates with p-eIF4E and predicts poor prognosis for non-small cell lung cancer patients with resection[J]. PLoS One, 2022,17(6):e0265465.
(本文编辑 范睿心 厉建强)
