外周血NLR和LMR与2型糖尿病患者颈动脉粥样硬化的关系
2023-04-29邓志莹郭宗君廖萍萍唐思思王超
邓志莹 郭宗君 廖萍萍 唐思思 王超
[摘要] 目的 探討血浆中中性粒细胞/淋巴细胞比值(NLR)、淋巴细胞/单核细胞比值(LMR)与2型糖尿病(type 2 diabete mellitus,T2DM)颈动脉粥样硬化(CAS)的关系。方法 选择2021年8月—2022年10月就诊于我院内分泌科及保健科的211例T2DM患者作为试验组,根据是否合并CAS将试验组患者分为CAS组(136例)和非CAS组(75例);另选取同期我院健康体检中心的47例健康体检者作为对照组。收集并比较3组患者的一般资料及血常规、血生化等实验室检查结果,采用Pearson相关分析法分析血浆NLR、LMR与T2DM CAS患者各临床指标的相关性,采用多因素logistic回归分析T2DM患者CAS的影响因素。结果 3组受试者的年龄、体质量指数、病程、收缩压、血浆中的中性粒细胞计数、淋巴细胞计数、单核细胞计数、NLR、LMR及空腹血糖(FBG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平比较差异有显著性(χ2=33.651、14.038,F=4.714~68.693,H=6.192~112.809,P<0.05)。Pearson相关分析显示,试验组患者血浆NLR与FBG、HbA1c水平呈正相关性(r=0.232、0.273,P<0.05);试验组患者血浆LMR与HDL-C水平呈正相关性(r=0.155,P<0.05),与病程、收缩压及血浆TC、FBG、HbA1c水平呈负相关性(r=-0.353~-0.131,P<0.05)。多因素logistic回归分析显示,年龄、病程、LMR、NLR和HbA1c均为T2DM CAS的影响因素(P<0.05);受试者工作特征曲线示血浆NLR、LMR水平评估T2DM患者合并CAS风险的曲线下面积均>0.70,评估价值较高。结论 T2DM人群中血浆NLR和LMR水平与CAS的发生显著相关,利用血浆NLR、LMR水平在一定程度上可以预测T2DM合并CAS的发生。
[关键词] 糖尿病,2型;中性白细胞;淋巴细胞计数;颈动脉疾病
[中图分类号] R587.1;R543.4
[文献标志码] A
ASSOCIATION OF PERIPHERAL BLOOD NEUTROPHIL-TO-LYMPHOCYTE RATIO AND LYMPHOCYTE-TO-MONOCYTE RATIO WITH CAROTID ATHEROSCLEROSIS IN PATIENTS IN TYPE 2 DIABETES MELLITUS \ DENG Zhiying, GUO Zongjun, LIAO Pingping, TANG Sisi, WANG Chao (Department of Geriatrics, The Affiliated Hospital of Qingdao University, Qingdao 266100, China)
[ABSTRACT] Objective To investigate the association of plasma neutrophil-to-lymphocyte ratio (NLR) and lymphocyte-to-monocyte ratio (LMR) with carotid atherosclerosis (CAS) in type 2 diabetes mellitus(T2DM). Methods A total of 211 T2DM patients who attended Department of Endocrinology and Department of Health Care in our hospital from August 2021 to October 2022 were enrolled as experimental group, and according to the presence or absence of CAS, the experimental group was further divided into CAS group with 136 patients and non-CAS group with 75 patients. A total of 47 individuals who underwent physical examination in Physical Examination Center of our hospital during the same period of time were enrolled as control group. The three groups were compared in terms of general information and laboratory examination results including routine blood test and blood biochemistry. The Pearson correlation analysis was used to investigate the correlation of NLR and LMR with the clinical indices of T2DM patients with CAS, and the multivariate logistic regression analysis was used to investigate the influence factors for CAS in T2DM patients. Results There were significant differences between the three groups in age, body mass index, course of disease, systolic pressure, plasma neutrophil count, lymphocyte count, monocyte count, NLR, LMR, fasting blood glucose (FBG), glycosylated hemoglobin (HbA1c), total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C), and low-density lipoprotein cholesterol (χ2=33.651,14.038,F=4.714-68.693,H=6.192-112.809,P<0.05). The Pearson correlation analysis showed that in the experimental group, plasma NLR was positively correlated with FBG and HbA1c (r=0.232,0.273,P<0.05); plasma LMR was positively correlated with HDL-C (r=0.155,P<0.05) and was negatively correlated with course of di-sease, systolic pressure, TC, FBG, and HbA1c (r=-0.353--0.131,P<0.05). The multivariate logistic regression analysis showed that age, course of disease, LMR, NLR, and HbA1c were influence factors for CAS in T2DM patients (P<0.05), and the receiver operating characteristic (ROC) curve showed that the level of plasma NLR and LMR, with an area under the ROC curve of >0.70, had a relatively high value in evaluating the risk of CAS in T2DM patients Conclusion The level of plasma NLR and LMR are significantly associated with the development of CAS in T2DM patients and can predict the development of T2DM with CAS to a certain extent.
[KEY WORDS] Diabetes mellitus, type 2; Neutrophils; Lymphocytecount; Carotid artery diseases
2型糖尿病(type 2 diabete mellitus,T2DM)是中老年人常见的慢性病之一,长期的慢性高血糖状态易导致动脈粥样硬化发生。近年来学界对糖尿病加速动脉粥样硬化的机制有了更深的认识。糖尿病合并颈动脉粥样硬化(CAS)的发病原因复杂,包括血糖升高、血脂异常、胰岛素外激素分泌变化和促炎状态等[1-2]。研究表明,炎症反应和氧化应激在动脉硬化过程中起到核心作用,其互为因果、相互促进,形成恶性循环,最终加重靶器官损害[3-5]。在各种炎症标志物中,白细胞及白细胞亚型(包括中性粒细胞、单核细胞以及淋巴细胞)均与CAS的发生有关[6]。中性粒细胞/淋巴细胞比值(NLR)和淋巴细胞/单核细胞比值(LMR)属于新型慢性炎症标志物,两者过去常被当作肿瘤及其预后标志物[7-8]。
大量研究证实,T2DM患者出现脑血管事件的关键病理因素为CAS,而血浆NLR、LMR作为能够有效反映炎症的指标,在对动脉粥样硬化相关疾病的评估方面,具有很重要的价值[9-10]。目前临床关于T2DM患者血浆NLR、LMR与CAS相关性的研究较少,本研究拟探讨血浆NLR、LMR与T2DM合并CAS的关系,旨在为T2DM合并CAS的临床预防、诊疗及监测提供理论依据。
1 资料与方法
1.1 一般资料
选择2021年8月—2022年10月于我院内分泌科及保健科住院的T2DM患者作为试验组。患者纳入标准:①符合2020年《中国2型糖尿病防治指南》[11]T2DM诊断者;②临床资料完整者。排除标准:①T1DM患者;②患有精神疾病不能配合者;③合并急性并发症或急、重度感染,或患有实体肿瘤、血液病者;④近6个月发生过急性心脑血管事件或合并下肢动脉闭塞者;⑤入组2个月内有糖皮质激素或非甾体类抗炎药物使用者。根据患者是否合并CAS将试验组患者分为CAS组和非CAS组,另外选取同期于我院健康体检中心的体检健康者作为对照组。
分别收集3组受试者的性别、年龄、吸烟史、饮酒史、高血压史、高脂血症史、糖尿病史及入院时的体质量指数(BMI)、血压、血常规指标[中性粒细胞计数(NEUT)、淋巴细胞计数(LYM)以及单核细胞计数(MONO)]、血生化指标[高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)以及糖化血红蛋白(HbA1c)]检查结果以及颈动脉彩色超声的检查结果。
1.2 统计学方法
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以x?±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis H检验,两两比较采用Bonferroni检验。计数资料以例(率)表示,组间比较采用χ2检验。采用Pearson相关分析法进行指标间的相关性分析,采用多因素logistic回归进行危险因素分析,并绘制受试者工作特征(ROC)曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 3组受试者一般资料比较
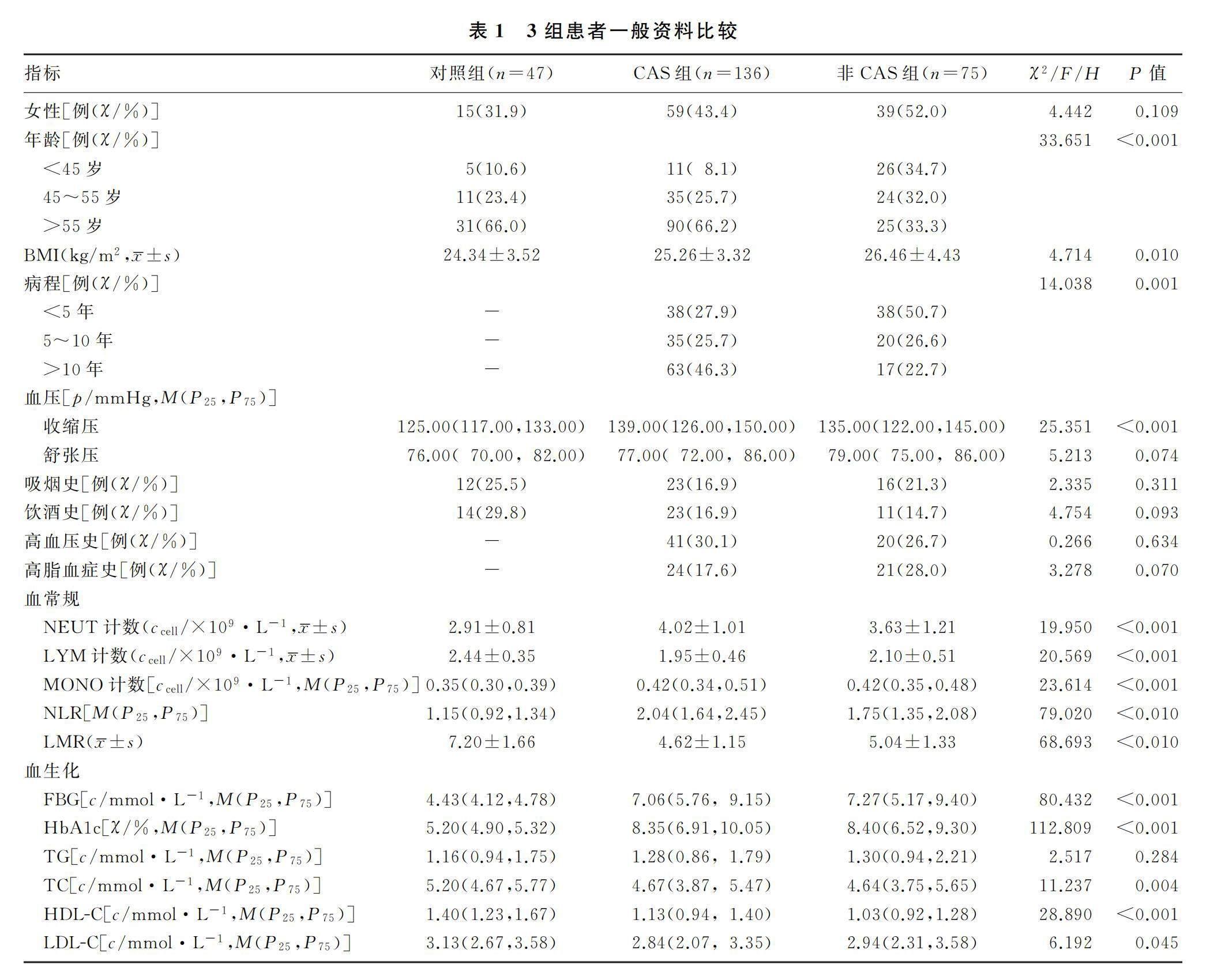
本研究共纳入受试者258例,其中试验组受试者211例(CAS组136例,非CAS组75例),对照组受试者47例。3组受试者的年龄、BMI、病程、收缩压、FBG以及血浆中NEUT、LYM、MONO、NLR、LMR、HbA1c、TC、LDL-C水平比较,差异均有显著性(χ2=33.651、14.038,F=4.714~68.693,H=6.192~112.809,P<0.05),其中CAS组受试者年龄、病程、收缩压及血浆NEUT、NLR水平均显著高于非CAS组及对照组,BMI、血浆LYM、LMR水平均显著低于非CAS组及对照组(P<0.05);非CAS组受试者的高龄患者构成比、BMI、收缩压、FBG及血浆NEUT、MONO、NLR、HbA1c水平均显著高于对照组,血浆中LYM、LMR、TC、LDL-C、HDL-C水平显著低于对照组(P<0.05)。见表1。
2.2 试验组受试者血浆NLR、LMR与各临床指标的相关性
Pearson相关性分析显示,试验组受试者的血浆NLR与FBG、HbAc1水平呈正相关(r=0.232、0.273,P<0.05);试验组受试者血浆LMR与HDL-C水平呈正相关(r=0.155,P<0.05),与病程、收缩压、FBG及血浆TC、HbAc1水平均呈负相关(r=-0.353~-0.131,P<0.05)。
2.3 影响T2DM合并CAS的logistic回归分析
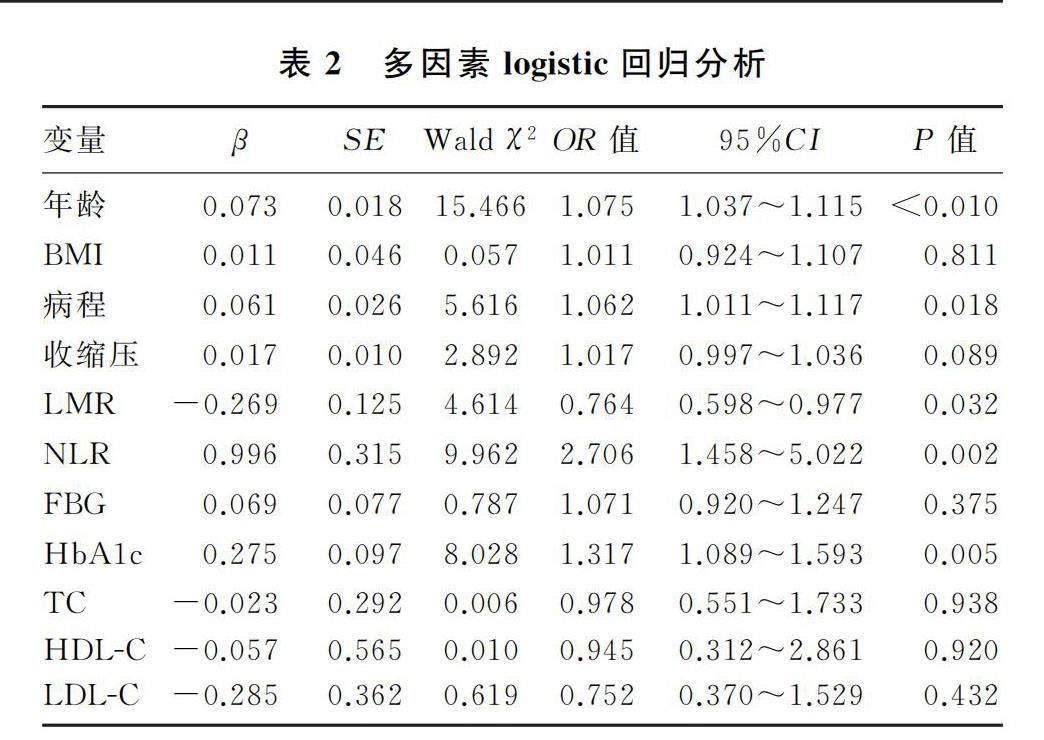
以是否发生CAS为因变量,以试验组受试者的年龄、BMI、病程、收缩压、FBG及血浆NLR、LMR、TC、HDL-C、LDL-C、HbA1c为自变量,校正混杂因素影响后发现,年龄、病程、LMR、NLR和HbA1c为T2DM合并CAS影响因素(P<0.05)。见表2。
2.4 血浆NLR、LMR评估T2DM合并CAS的ROC曲线
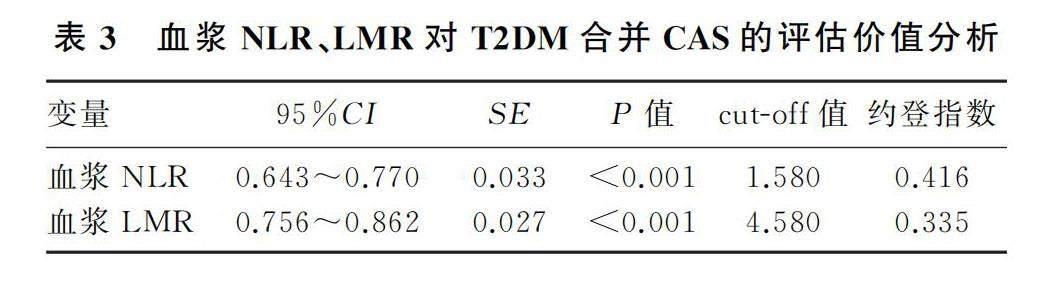
将T2DM是否合并CAS作为状态变量绘制ROC曲线,血浆NLR、LMR评估T2DM合并CAS风险的曲线下面积(AUC)分别为0.760和0.706,灵敏度分别为80.10%和79.4%,特异度分别为61.5%和54.1%。见表3、图1。
3 讨论
T2DM是一种慢性炎症性疾病,而炎症是血管斑块形成、破裂和发生急性心血管事件的关键因素。近年来大量研究发现,炎症的血浆标志物可较好协
助临床识别包括动脉粥样硬化在内的相关炎性疾病[12]。动脉粥样硬化是T2DM最常见的并发症之一,超半数的T2DM患者可患有动脉粥样硬化,动脉粥样硬化常引起心、脑严重并发症而导致患者死亡[13]。CAS是全身动脉粥样硬化在颈动脉的表现,T2DM合并CAS患者受到多种因素影响,其中除年龄和病程等因素外,血浆中多种炎症因子浓度的升高也可促使T2DM患者血管病变的形成[14]。本研究中CAS组受试者的血浆中的NEUT、MONO水平显著高于非CAS组及对照组,血浆LYM水平显著低于非CAS组及对照组;非CAS组受试者血浆NEUT、MONO水平显著高于对照组,血浆LYM水平显著低于对照组。多项研究表明T2DM的血管并发症与糖毒性和脂毒性密切相关,高血糖可导致线粒体功能障碍,引发氧化应激,进而增加活性氧的产生;而高脂血症则通过脂肪组织释放促炎细胞因子导致血管内皮的损伤[15]。本研究并未显示出T2DM患者的血糖和血脂与CAS的关联性,推测可能与样本量偏小或试验组受试者服用降糖及降脂药有关。本研究结果显示CAS组受试者血浆NLR显著高于非CAS组及对照组,血浆LMR显著低于非CAS组及对照组;非CAS受试者血浆NLR高于对照组,血浆LMR低于对照组。说明炎症因子参与了T2DM合并CAS的发生和发展,而且炎症负荷越高的T2DM患者,越易发生CAS。本研究相关性分析结果显示,试验组受试者血浆NLR与FBG、HbAc1水平呈正相关;血浆LMR与HDL-C水平呈正相关,与病程、收缩压、FBG及血浆TC、HbAc1水平呈负相关,提示外周血NLR和LMR与血糖、血脂升高等导致T2DM合并CAS的影响因素具有一定关系。
动脉粥样硬化在老年人中发病率较高,60岁以上老年糖尿病患者血管病变患病率高达80%。本研究显示年龄是T2DM合并CAS的独立危险因素,这与高龄激活慢性炎症小体,减弱各种抗炎机制,加速血管老化均有关,与既往研究结果相符[16]。此外,T2DM病程也是T2DM合并CAS的独立危险因素,T2DM病程延长使得机体长期处于高血糖状态,与体内蛋白质、脂肪酸等共同作用,产生糖基化终末产物、激活血管内皮的氧化应激反应,加速了CAS的发生发展[17]。血漿HbA1c水平是反映机体血糖调节的一个重要指标。本研究结果显示血浆HbA1c水平升高是T2DM合并CAS的影响因素,与既往研究结果一致[18]。吸烟、血脂升高、血压升高及BMI异常是T2DM合并CAS的独立危险因素,本研究并未得出上述结论,分析原因可能由于该样本中肥胖率和吸烟比率比较低,且部分患者使用了降压、降脂药物,使血压以及血脂水平得到改善有关[19-20]。
CAS的形成过程是复杂的,慢性炎症目前被认为是T2DM合并CAS的原因之一[21]。本研究结果表明,血浆NLR升高以及LMR降低是T2DM合并CAS的影响因素。本研究使用ROC曲线分析了血浆NLR、LMR对T2DM合并CAS的诊断价值,其结果显示血浆NLR、LMR对诊断T2DM合并CAS的AUC分别为0.760、0.706,提示诊断具有一定准确性。血浆NLR、LMR可作为新型全身慢性炎症标志物,考虑可能存在以下几种机制:①中性粒细胞活化后释放大量蛋白水解酶、花生四烯酸、活性氧,导致血管内皮损伤、斑块破裂[22]。同时脂质水平升高激活了血管内皮细胞和中性粒细胞,促进中性粒细胞与其他不同亚型的白细胞如单核细胞、巨噬细胞、淋巴细胞等的相互作用,进一步加重了血管内皮功能障碍并促进粥样斑块壁的炎症反应[23-24]。②淋巴细胞是适应性免疫系统的效应细胞,与CAS发生密切相关,较低的淋巴细胞代表了机体免疫力低下的一种状态,免疫功能受损会降低机体抗炎能力,淋巴细胞总数下降,T淋巴细胞亚群比例失衡,导致炎症的发生[25-26]。③单核细胞可以被多种炎性因子激活进入血液系统,进而发育成巨噬细胞,吞噬脂质,形成泡沫细胞,从而发展成CAS[27-28]。血浆中NLR和LMR整合了上述两种白细胞亚型的信息,可以比较稳定地反映机体的炎症状态,避免了单独白细胞亚型在感染、脱水情况下绝对值可能受到影响的弊端。
综上所述,T2DM人群中血浆NLR和LMR与CAS的发生显著相关,但两者能否作为CAS严重程度的独立预测指标,还需要进一步的研究。血浆NLR、LMR等常规检测,不仅简单快速,并且方便获得,经济成本低。本研究不足之处是小样本的回顾性研究,且未进行基础性的实验研究以阐明其具体机制,仍需要后期进行大样本、更深入的基础和临床研究加以证实。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL27758)。所有试验过程均遵照《人体医学研究的伦理准则》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:邓志莹、郭宗君、唐思思、王超参与了研究设计;邓志莹、郭宗君、廖萍萍参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]YUAN T, YANG T, CHEN H, et al. New insights into oxidative stress and inflammation during diabetes mellitus-acce-lerated atherosclerosis[J]. Redox Biol, 2019,20:247-260.
[2]BERKOVITCH A, YOUNIS A, GROSSMAN Y, et al. Relation of neutrophil to lymphocyte ratio to risk of incident atrial fibrillation[J]. Am J Cardiol, 2019,123(3):396-401.
[3]胡佳,周伟,周志明,等. 炎症指标对缺血性脑卒中卒中后抑郁的预测价值[J]. 南方医科大学学报, 2019,39(6):665-671.
[4]韩淑娴,王春淼,李玉洁,等. 血管外膜炎症在动脉粥样硬化中的作用及研究进展[J]. 中国比较医学杂志, 2019,29(9):114-119,126.
[5]李贞贞,唐海涛,王怡,等. miR-29c通过调控SIRT1表达介导动脉粥样硬化氧化应激与炎症反应[J]. 安徽医科大学学报, 2020,55(2):172-176.
[6]LIBBY P, THEROUX P. Pathophysiology of coronary artery disease[J]. Circulation, 2005,111(25):3481-3488.
[7]高鹤. 乳腺癌术前NRL、PLR、RDW、MPV血常规参数与预后的相关性[J]. 中国老年学杂志, 2020,40(4):750-752.
[8]HOSHINO S, TAKEUCHI M, KAWAKUBO H, et al. Usefulness of neutrophil to lymphocyte ratio at recurrence for predicting long-term outcomes in patients with recurrent esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2021,28(6):3001-3008.
[9]NAM K W, KWON H M, JEONG H Y, et al. High neutrophil to lymphocyte ratios predict intracranial atherosclerosis in a healthy population[J]. Atherosclerosis, 2018,269:117-121.
[10]GARY T, PICHLER M, BELAJ K, et al. Lymphocyte-to-monocyte ratio: A novel marker for critical limb ischemia in PAOD patients[J]. Int J Clin Pract, 2014,68(12):1483-1487.
[11]中華医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021,41(5):482-548.
[12]LIBBY P. Inflammation in atherosclerosis-No longer a theory[J]. Clin Chem, 2021,67(1):131-142.
[13]GOODARZI M O, ROTTER J I. Genetics insights in the relationship between type 2 diabetes and coronary heart disease[J]. Circ Res, 2020,126(11):1526-1548.
[14]白慧华,周铸,邓楠. 2型糖尿病患者发生血管并发症的危险因素分析[J]. 海南医学, 2018,29(13):1802-1804.
[15]LAAKSO M, KUUSISTO J. Insulin resistance and hyperglycaemia in cardiovascular disease development[J]. Nat Rev Endocrinol, 2014,10(5):293-302.
[16]WONG M Y Z, YAP J, HUANG W T, et al. Impact of age and sex on Subclinical Coronary atherosclerosis in a Healthy Asian population[J]. JACC Asia, 2021,1(1):93-102.
[17]黄燕,陈献红,吴佳,等. 颈动脉粥样硬化斑块患者的相关因素分析[J]. 黑龙江医学, 2021,45(17):1807-1809.
[18]寿广丽,朱方方,许媛媛,等. 2型糖尿病合并急性脑梗死患者糖化血红蛋白与血清相关炎症因子及颈动脉粥样硬化斑块的相关性研究[J]. 齐齐哈尔医学院学报, 2021,42(20):1757-1760.
[19]高莹,郭远林,许海燕. 老年人心血管疾病风险与血脂管理[J]. 中华老年心脑血管病杂志, 2022,24(5):551-552.
[20]卜云翎,李嘉雯,徐帆,等. 老年单纯收缩期高血压患者血压昼夜节律异常与晨峰现象对动脉僵硬度的影响[J]. 中华老年医学杂志, 2022,41(1):1-4.
[21]POZNYAK A, GRECHKO A V, POGGIO P, et al. The diabetes mellitus-atherosclerosis connection: The role of lipid and glucose metabolism and chronic inflammation[J]. Int J Mol Sci, 2020,21(5):1835.
[22]BLANCH-RUIZ M A, ORTEGA-LUNA R, MARTNEZ-CUESTA M , et al. The neutrophil secretome as a crucial link between inflammation and thrombosis[J]. Int J Mol Sci, 2021,22(8):4170.
[23]D?RING Y, SOEHNLEIN O, WEBER C. Neutrophil extracellular traps in atherosclerosis and atherothrombosis[J]. Circ Res, 2017,120(4):736-743.
[24]WONG S L, DEMERS M, MARTINOD K, et al. Diabetes primes neutrophils to undergo NETosis, which impairs wound healing[J]. Nat Med, 2015,21(7):815-819.
[25]SAIGUSA R, WINKELS H, LEY K. T cell subsets and functions in atherosclerosis[J]. Nat Rev Cardiol, 2020,17(7):387-401.
[26]WANG W, SUNG N, GILMAN-SACHS A, et al. T Helper (Th) Cell Profiles in Pregnancy and Recurrent Pregnancy Losses: Th1/Th2/Th9/Th17/Th22/Tfh Cells[J]. Front Immunol, 2020,11:2025.
[27]MORONI F, AMMIRATI E, NORATA G D, et al. The role of monocytes and macrophages in human atherosclerosis, plaque neoangiogenesis, and atherothrombosis[J]. Mediators Inflamm, 2019,2019:7434376.
[28]VANTUIJL J, JOOSTEN L A B, NETEA MG, et al. Immunometabolism orchestrates training of innate immunity in at-herosclerosis[J]. Cardiovasc Res, 2019,115(9):1416-1424.
(本文編辑 范睿心 厉建强)
