长节段脊髓室管膜瘤的显微手术治疗及脊髓功能影响因素
2023-04-29马木提江·木尔提扎范雁东罗坤汪永新孙宏杰依力亚尔·阿里木江王凯
马木提江·木尔提扎 范雁东 罗坤 汪永新 孙宏杰 依力亚尔·阿里木江 王凯
【摘要】 目的 初步探讨长节段脊髓室管膜瘤(范围≥3个椎体水平)的患者手术前后神经功能变化及其相关影响因素。方法 纳入2016年3月—2021年6月于新疆医科大学第一附属医院神经外科接受手术治疗的25例长节段脊髓室管膜瘤患者,回顾性分析手术前后改良McCormick分级(MMCS)变化,探讨其可能的影响因素。结果 25例患者均行后正中全椎板入路肿瘤切除术,全切(Ⅰ级)15例(60%),次全切(Ⅱ级)9例(36%),大部分切除(Ⅲ级)1例(4%)。手术前MMCS 1+2级8例(32%),末次随访MMCS 1+2级15例(68.2%),脊髓功能较术前改善者11例(50%),无变化者6例(27.3%),恶化者5例(22.7%)。与脊髓功能正常或轻度障碍(MMCS 1+2级)的患者进行比较,肿瘤头端位于胸10水平以上为术前脊髓功能不良(MMCS>2级)的独立危险因素(OR=7.497,B=2.015)。对改善/稳定组和加重组进行单因素分析提示脊髓空洞(P=0.019)和脊髓水腫(P=0.030)与术后脊髓功能恶化相关,Logistic回归结果提示术前伴有脊髓水肿(OR=13.914,B=2.633)为术后3个月脊髓功能不良的独立危险因素,而术前伴有脊髓空洞(OR=0.060,B=-2.813)为保护因素。而年龄、性别、手术时长、肿瘤切除程度、病理分级、术中是否脊柱内固定均无统计学意义(均P>0.05)。结论 长节段脊髓室管膜瘤患者的神经功能障碍发生率较高,手术治疗后大部分患者脊髓功能较术前改善,手术效果满意,但术前伴有脊髓水肿或不伴脊髓空洞的患者术后3个月时脊髓功能状态相对不良。
【关键词】 室管膜瘤;脊髓功能;显微手术;核磁共振;神经电生理监测
【中图分类号】 R739.42;R651.2 【文献标志码】 A 【文章编号】 1672-7770(2023)01-0042-06
Abstract: Objective To preliminarily explore the neurological functions and its influencing factors in the treatment of multisegmental intramedullary spinal cord ependymomas(tumor extension over ≥3 vertebrae). Methods 25 patients with multisegmental intramedullary spinal cord ependymomas who underwent microsurgical tumor resection from March 2016 to June 2021 at the Department of Neurosurgery of the First Affiliated Hospital of Xinjiang Medical University were collected. The changes of neurological functions evaluated against the Modified McCormick Scale and Sensory Pain Scale were analyzed retrospectively, and the related factors affecting neurological outcome were discussed. Results All 25 cases underwent tumor resection through posterior median approach, gross total resection(grade Ⅰ) in 15(60%), subtotal resection(grade Ⅱ) in 9(36%), and partial resection(grade Ⅲ) in 1(4%). Preoperative assessment revealed MMCS grade Ⅰ+Ⅱ in 8(32%), and at last follow-up in 15(68.2%)the function status were MMCS grade Ⅰ+Ⅱ, 11 cases(50%)showed neurological improvement, no change in 6(27.3%), while deterioration in 6(27.3%). Compared with the MMCS grade Ⅰ+Ⅱ groups, lesion upper pole located higher than T10 level was the risk factor of preoperative poor functions(MMCS grade>2)(OR=7.497,B= 2.015). Univariate analysis suggested that syringomyelia(P=0.019)and spinal cord edema(P=0.030) were associated with postoperative deterioration of function, and logistic regression indicated that preoperative spinal cord edema was an independent risk factor for function aggravation in 3 months after operation(OR=13.914,B=2.633), while the syringomyelia seemed was considered as a protective factor(OR=0.060,B=-2.813). However, there was no statistical significance in age, gender, surgical duration, extent of tumor resection, pathological grade and simultaneous instrumented fusion(all P>0.05). Conclusions The incidence of neurological dysfunction in patients with long segment spinal cord ependymoma is high. After surgery, the spinal cord function of most patients is improved compared with that before surgery, and the surgical effect is satisfactory. However, the spinal cord function of patients with preoperative spinal cord edema or without syringomyelia is relatively poor 3 months after surgery.
Key words: ependymoma; spinal cord function; microsurgery; magnetic resonance imaging; neuroelectrophysiological monitoring
基金项目:新疆维吾尔自治区自然科学基金资助项目(2019D01C323)
作者单位:830054 乌鲁木齐,新疆医科大学第一附属医院神经外科
通信作者:范雁东
脊髓室管膜瘤占原发性中枢神经系统肿瘤的4%~6%,约占所有脊髓肿瘤的60%,主要发生于成人,除圆锥/终丝室管膜瘤外,脊髓室管膜瘤一般起源于排列在脊髓中央管的室管膜细胞[1],很少浸润性生长,由于肿瘤生长相对缓慢,患者出现症状时肿瘤所累及节段较长。虽然显微手术切除脊髓室管膜瘤可有效解除肿瘤占位效应,防止脊髓神经组织持续受压引起的变性损伤,但术后患者仍存在不同程度的脊髓功能障碍症状,长期影响着患者生活质量,甚至可能危及生命。最新研究表明,长节段脊髓室管膜瘤(范围≥3个椎体水平)的患者术后神经功能障碍发生率高[2],目前保证肿瘤切除率的同时改善功能预后仍具挑战性。因此,本研究纳入2016年3月—2021年6月于新疆医科大学第一附属医院神经外科手术治疗的25例长节段髓内室管膜瘤成人患者,回顾性分析其脊髓功能变化并探讨造成术后神经功能障碍或恶化的相关因素,为今后改善患者神经功能预后提供重要临床经验。现报告如下。
1 资料与方法
1.1 一般资料 选取累及3个或以上椎体水平脊髓的室管膜瘤,排除由脑部或骨骼运动系统疾患等造成功能障碍的患者后,共纳入25例,其中男13例,女12例;年龄18~64岁,中位年龄为39岁;病程为20 d~14年(中位数12个月);术前临床症状疼痛14例,感觉异常10例,肢体运动障碍13例,大小便障碍6例。本研究符合《赫尔辛基宣言》原则,所有患者或家属对手术知情同意并签署知情同意书。
1.2 术前影像学检查 术前所有患者完善脊髓增强MRI,充分了解肿瘤的生长特点,即肿瘤长度和强化方式,脊髓水肿程度以及脊髓积水(空洞)情况等。肿瘤部位颈段9例,颈胸段7例,胸段1例,胸腰段5例,腰段3例;肿瘤长度4.5~19.0 cm,中位数6.1 cm。
1.3 方法
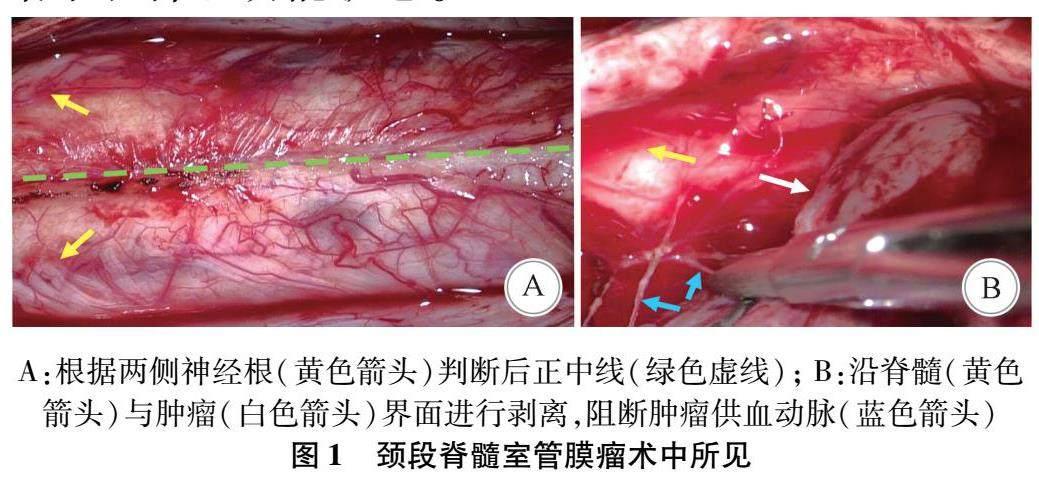
1.3.1 手术方法 所有患者均在全身麻醉下行后正中全椎板入路肿瘤切除术,取全俯卧位,显微镜下根据两侧神经根及后脊静脉位置准确判断后正中线后谨慎切开脊髓(图1A),沿脊髓中央管扩张明显的一端(多为头端)进行肿瘤的分离,当肿瘤体积较大时先行瘤内减压,后沿瘤髓界面分离肿瘤,阻断肿瘤供血分支动脉(图1B),完整切除肿瘤。若肿瘤呈侵袭性生长,瘤髓界限不清,进行分块切除,运动诱发电位(motor evoked potential,MEP)呈下降趋势或显著下降(一般为50%)时立刻停止侵袭性操作。
1.3.2 术后评估及随访 根据术中情况以及术后脊髓增强MRI判断肿瘤切除程度[3]:(1)Ⅰ级,完整切除(100%),术后MRI未发现肿瘤残留;(2)Ⅱ级,次全切除(≥90%),实性部分少量残留;(3)Ⅲ级,肿瘤切除率<90%。采用改良McCormick功能分级(modified McCormick scale,MMCS)[4]进行脊髓神经功能评估,将MMCS>2级视为神经功能不良。分别于术后7 d、3个月复查MRI并进行MMCS分级,根根结果制定随访计划,记录末次随访时的影像结果和神经功能状态。
1.4 统计学方法 应用SPSS 26.0软件进行统计分析。不服从正态分布的定量资料和等级资料采用中位数(四分位数)M(P25,P75)描述,定性资料用率或构成比描述。不同随访时间的功能等级比较采用Wilcoxon配对秩和检验,组间比较采用非参数秩和检验,而计数资料的分析采用Fisher确切概率法。用Logistic回归进行多因素分析,纳入变量α=0.1。以P<0.05为差异有统计学意义。
2 结 果
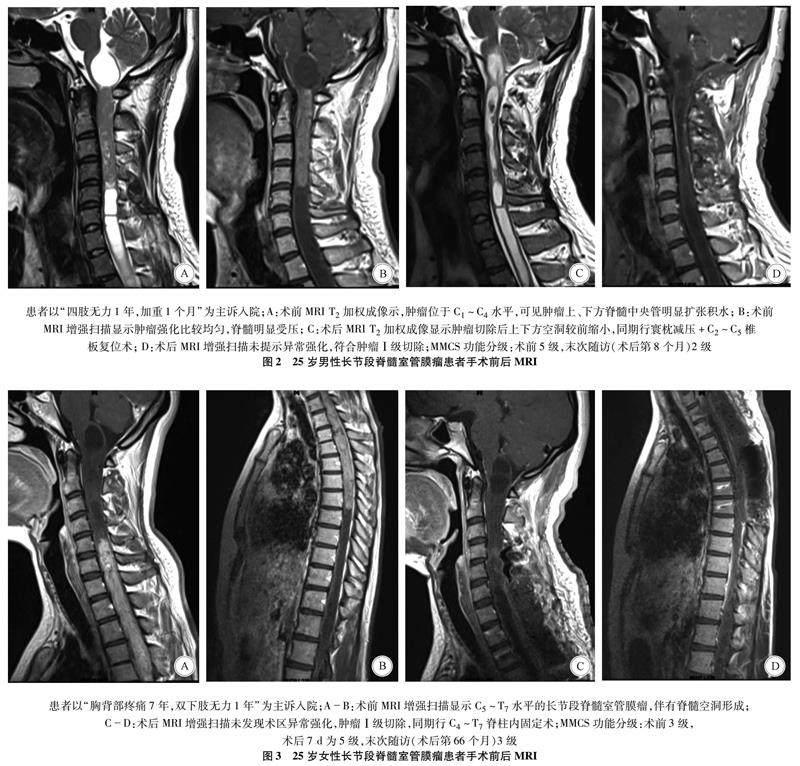
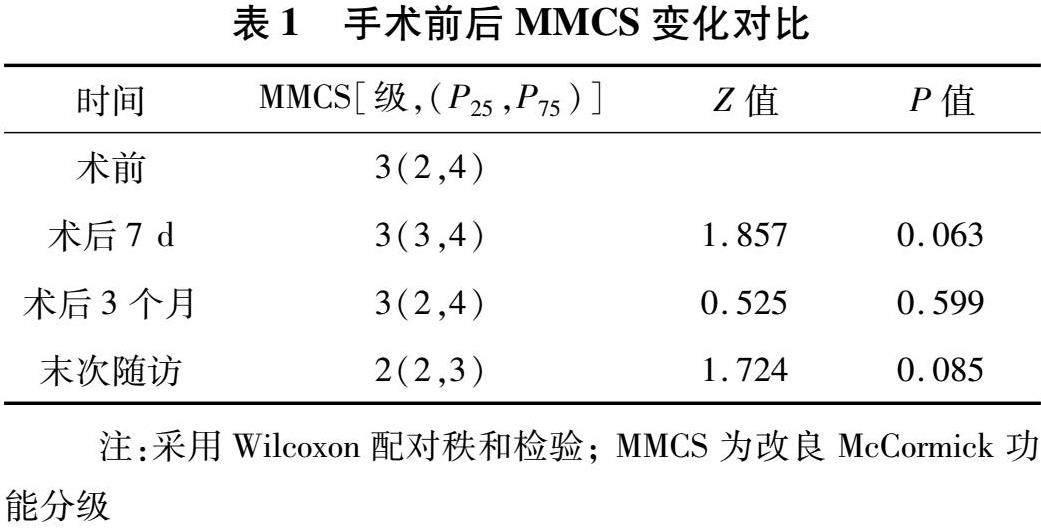
2.1 手术情况及病理结果 25例脊髓长节段室管膜瘤切除程度分级Ⅰ级15例(60%,图2-3),Ⅱ级9例(36%),Ⅲ级1例(4%);15例患者同期行脊柱内固定术。病理结果显示,典型室管膜瘤(WHO Ⅱ级)22例,Ki-67:1%~8%;间变型室管膜瘤(WHO Ⅲ级)3例,Ki-67:15%~30%;随访期间肿瘤进展或复发2例,术后放疗5例。术后3个月内因(呼吸肌力量下降)肺部感染死亡1例。其他主要并发症:脑脊液漏2例,切口感染或愈合不良1例,静脉血栓2例。
2.2 手術前后脊髓功能变化 本组患者中在术前、术后7 d、术后3个月和随访时间半年以上时脊髓功能不良者(MMCS>2级)所占比分别为68%、84%、58.3%和31.8%。22例患者随访时间大于6个月,其神经功能较术前改善者11例(50%),无变化者6例(27.3%),恶化者5例(22.7%),但对手术前后的脊髓功能进行配对秩和检验分析发现MMCS分级变化无统计学意义(表1)。
2.3 影响脊髓神经功能的相关因素分析结果 根据脊髓功能状态分为正常或轻度障碍组(MMCS≤2级)和不良组(MMCS>2级)并按不同时间进行单 因素分析,其结果提示肿瘤长度(P=0.044)和肿瘤头端位于T10水平以上(P=0.046)可能为影响因素(表2),而多因素分析示,肿瘤头端位于T10水平以上为独立危险因素(OR=7.497,B=2.015)。随访期间根据脊髓功能变化分为改善或稳定组和加重组,单因素分析结果提示脊髓空洞(P=0.019)和脊髓水肿(P=0.030)与术后功能加重相关(表3),经Logistic回归分析发现术前伴有脊髓水肿(OR=13.914,B=2.633)为术后3个月脊髓功能恶化的独立危险因素,而伴有脊髓空洞(OR=0.060,B=-2.813)为保护因素(表4)。
3 讨 论
脊髓室管膜绝大多数是良性的,虽然肿瘤无包膜,但与周围正常脊髓组织之间存在比较清楚的界面[5],一般是通过压迫脊髓引起神经功能障碍,而不是直接侵袭周围神经组织。在第5版WHO中枢神经系统肿瘤分类中提出新的分子亚型MYCN扩增型[6],Ghasemi等[7]发现MYCN扩增型脊髓室管膜瘤对于神经系统的侵袭性明显强于其它分子型,表现为早期转移和种植播散,而肿瘤全切率很低(1/12),术后短期内复发造成脊髓功能下降,严重影响患者生活质量。
目前手术切除是脊髓室管膜瘤的主要治疗方式,应用安全而精确的手术策略完全切除脊髓室管膜瘤是预防患者生活质量下降的有效措施[8]。术前MRI检查可提供指导手术的关键信息,室管膜瘤多位于脊髓中心部位,多伴有脊髓积水、出血和帽征(图2A)[9-10],但累及节段脊髓受压变得菲薄,根据MRI测量脊髓厚度存在难度,本组未能量化脊髓压迫程度。McCormick等[11]认为肿瘤两端的脊髓空洞或囊性扩张有利于肿瘤手术切除,并主张沿中央管明显扩张的一端开始分离肿瘤。Samii等[12]发现脊髓空洞最可能发生在肿瘤的头侧端,伴有脊髓空洞的室管膜瘤患者术后往往恢复得更快。本研究也发现术前伴有脊髓空洞为保护因素,肿瘤两端脊髓空洞便于探查瘤髓界线,有利于肿瘤的分离,这可能降低对脊髓的损伤。从神经解剖学角度分析,皮质脊髓外侧束位于脊髓外侧索的内侧,仅由一层薄的中间白质与室管膜瘤相隔。随着肿瘤膨胀性生长,逐渐压迫中间白质使皮质脊髓束向腹侧和外侧移位,因此在深部瘤髓界面操作时,极易损伤下传的运动传导束造成术后运动功能障碍。本组中24例均完成了肿瘤的完整切除,但其中6例肿瘤部分区域与脊髓粘连紧密或界限不清,不宜侵袭性剥离,因此将其视为Ⅱ级切除。另外,当肿瘤使脊髓丢失正常形态或发生扭转时,不易辨别手术切入点,容易造成对脊髓后索的损伤。Katsigiannis等[13]提出脊髓后外侧入路(脊髓背侧根入路),沿神经细根准确识别后外侧沟可保证肿瘤切除率并降低对后索的损伤。但是这会增加对皮质脊髓束、脊髓小脑束和脊髓丘脑束的损伤风险,且对深部和内侧部分肿瘤暴露不够理想。
手术中神经电生理监测是必不可少的。沿后正中线进入时SEP的作用可能不明显,而MEPs可以指导肿瘤腹侧和外侧的操作[14]。当MEP消失或波幅下降50%时认为有显著改变,但这存在一定局限性,因为在肌力2级及以下或严重痉挛的患者中,MEP可能不出现明顯的变化。脊髓前动脉穿支通常分为肿瘤腹侧支、脊髓外侧支和肿瘤内侧支(图1B)。术中保留来自脊髓前动脉的微循环对患者术后功能恢复具有重要意义。Arima等[15]认为术中吲哚菁绿(indocyanine green,ICG)造影技术可根据ICG峰值时间准确判断微循环血管条件,实时观察脊髓前动脉小分支的保留情况,可作为判断术后神经功能的预测方法。Moreno等[16]推荐术中借助5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)引导提高肿瘤切除程度。术后脊髓粘连可能是出现感觉异常的原因,Li等[17]主张逐层间断缝合软脊膜和蛛网膜,连续缝合硬脊膜,本组所有患者均采取同样的缝合方式,随访期间MRI显示脊髓后间隙存在,未提示脊髓后方与硬膜的粘连。
脊髓室管膜瘤患者的功能预后一直以来备受关注,近几年多项研究也重点探讨其可能的影响因素。最新一项系统性回顾与荟萃分析结果显示,肿瘤全切的患者随访期间神经功能改善程度优于非全切组[18]。本组中50%的患者脊髓功能较术前改善,术后随访期间肿瘤全切者在MMCS<2级患者中所占比例逐渐增高(25%,60%,66.7%),改善率全切组46.7%(7/15) vs.非全切组40%(4/10),但此差异不存在统计学意义。多项研究显示术前神经功能状态是独立预测因素,术前神经功能不良的患者功能预后较差[2,19],而本研究中进行手术前后配对比较未发现显著差异。对于手术时机的选择,Tsuji等[20]认为即使是轻度神经障碍者也应早期手术。另外,研究显示术前症状出现时间较长者功能预后不良[21]。肿瘤长度与脊髓功能存在相关性[2,19-20],本研究中也发现肿瘤长度(P=0.044)可能与术前脊髓功能存在相关性。除此,研究显示颈、胸髓室管膜瘤患者术后暂时性神经功能恶化发生率较高(63.2%,50%),肿瘤上端在胸10或以上水平是独立预测因素[19]。本研究发现,其为影响术前脊髓功能的独立危险因素,这可能与胸椎椎管代偿空间较小所致的早期脊髓压迫症有关。
迟发的神经功能减退除了肿瘤复发以外还可能与脊髓局部萎缩有关,但其发生原因尚不清楚,可能是在细胞水平发生了类似于急性脊髓损伤或多发性硬化症的继发性损伤,也可能是由肿瘤压迫解除后的再灌注损伤造成,而脊髓水肿可能意味着脊髓的变性损伤。因此即使肿瘤全切且没有复发也可以出现迟发的脊髓功能减退[20],后凸畸形是长节段髓内室管膜瘤切除术后可能出现的长期并发症,可引起脊髓组织张力增加和缺血,出现迟发的脊髓功能减退,Sciubba等[21]的报道显示因颈段髓内肿瘤切除3个或以上节段椎板后,约33%的患者因脊柱失稳或后凸畸形并再次接受了脊柱矫正手术,其预测因素还包括年龄< 30岁、肿瘤跨越颈胸段或胸腰段[14]。本研究中对肿瘤跨越颈胸段或胸腰段者进行了同期脊柱内固定术,并未发现脊柱内固定与术后神经功能的相关性。
综上所述,长节段脊髓室管膜瘤患者的脊髓功能障碍发生率较高,肿瘤相关因素包括肿瘤长度及部位,是否伴有脊髓空洞、水肿等;手术相关因素可能为机械损伤、术后脊髓粘连,术后脊柱畸形等,为临床提供重要的经验总结。本研究中对绝大多数患者完成了肿瘤的完整切除,并且其脊髓功能较术前有所改善,手术效果满意。但由于样本量小、选择偏倚、随访时间长短不一等原因,仍需多中心的长期随访研究证实所得出的结论。
[参 考 文 献]
[1]Kucia EJ,Bambakidis NC,Chang SW,et al.Surgical technique and outcomes in the treatment of spinal cord ependymomas,part 1:intramedullary ependymomas[J].Neurosurgery,2011,68(1 Suppl Operative):57-63.
[2]zkan N,Gembruch O,Darkwah Oppong M,et al.Risk score for outcome prediction after microsurgical resection of spinal ependymoma(SOURSE score)[J].Clin Neurol Neurosurg,2021,209(10):106923.
[3]Yang CL,Sun JJ,Xie JC,et al.Multisegmental versus monosegmental intramedullary spinal cord ependymomas:perioperative neurological functions and surgical outcomes[J].Neurosurg Rev,2022,45(1):553-560.
[4]Richards O,Goacher E,Pal D,et al.Intramedullary spinal cord tumours-a single centre,10-year review of clinical and pathological outcomes[J].Br J Neurosurg,2021,35(2):125-128.
[5]Chang UK,Choe WJ,Chung SK,et al.Surgical outcome and prognostic factors of spinal intramedullary ependymomas in adults[J].J Neurooncol,2002,57(2):133-139.
[6]Louis DN,Perry A,Wesseling P,et al.The 2021 WHO classification of tumors of the central nervous system:a summary[J].Neuro Oncol,2021,23(8):1231-1251.
[7]Ghasemi DR,Sill M,Okonechnikov K,et al.MYCN amplification drives an aggressive form of spinal ependymoma[J].Acta Neuropathol,2019,138(6):1075-1089.
[8]Nakanishi Y,Naito K,Yamagata T,et al.Health-related quality of life after microscopic total removal of spinal intramedullary ependymomas in a single-institute 3-year prospective study[J].World Neurosurg,2020,136(1):e614-e624.
[9]Lemay A,Gros C,Zhuo ZZ,et al.Automatic multiclass intramedullary spinal cord tumor segmentation on MRI with deep learning[J].Neuroimage Clin,2021,31:102766.
[10]Kim DH,Kim JH,Choi SH,et al.Differentiation between intramedullary spinal ependymoma and astrocytoma:comparative MRI analysis[J].Clin Radiol,2014,69(1):29-35.
[11]McCormick PC,Torres R,Post KD,et al.Intramedullary ependymoma of the spinal cord[J].J Neurosurg,1990,72(4):523-532.
[12]Samii M,Klekamp J.Surgical results of 100 intramedullary tumors in relation to accompanying syringomyelia[J].Neurosurgery,1994,35(5):865-873.
[13]Katsigiannis S,Carolus AE,Schmieder K,et al.Posterolateral myelotomy for intramedullary spinal cord tumors:the other way to do it?[J].Acta Neurochir(Wien),2020,162(1):101-107.
[14]Knafo S,Aghakhani N,David P,et al.Management of intramedullary spinal cord tumors:a single-center experience of 247 patients[J].Rev Neurol(Paris),2021,177(5):508-514.
[15]Arima H,Naito K,Yamagata T,et al.Quantitative analysis of near-infrared indocyanine green videoangiography for predicting functional outcomes after spinal intramedullary ependymoma resection[J].Oper Neurosurg(Hagerstown),2019,17(5):531-539.
[16]Moreno RG,García LMB,Bastidas HI,et al.Fluorescence guided surgery with 5-aminolevulinic acid for resection of spinal cord ependymomas[J].Asian Spine J,2019,13(1):119-125.
[17]Li TY,Chu JS,Xu YL,et al.Surgical strategies and outcomes of spinal ependymomas of different lengths:analysis of 210 patients:clinical article[J].J Neurosurg Spine,2014,21(2):249-259.
[18]Salari F,Golpayegani M,Sadeghi-Naini M,et al.Complete versus incomplete surgical resection in intramedullary ependymomas:a systematic review and meta-analysis[J].Global Spine J,2021,11(5):761-773.
[19]Gembruch O,Chihi M,Haarmann M,et al.Surgical outcome and prognostic factors in spinal cord ependymoma:a single-center,long-term follow-up study[J].Ther Adv Neurol Disord,2021,14(11):17562864211055694.
[20]Tsuji O,Nagoshi N,Ishii R,et al.Poor prognostic factors for surgical treatment of spinal intramedullary ependymoma(World Health Organization grade II)[J].Asian Spine J,2020,14(6):821-828.
[21]Sciubba DM,Chaichana KL,Woodworth GF,et al.Factors associated with cervical instability requiring fusion after cervical laminectomy for intradural tumor resection[J].J Neurosurg Spine,2008,8(5):413-419.
(收稿2022-07-09 修回2022-08-22)
