LncRNA SLC26A4-AS1在人垂体瘤组织中的表达及其意义
2023-04-29彭超李晏丽袁勇
彭超 李晏丽 袁勇
【摘要】 目的 探讨lncRNA SLC26A4-AS1在人垂体瘤中的表达情况,并分析其与垂体瘤侵袭性的关系。方法 收集经病理确诊的16例非侵袭性垂体瘤和25例侵袭性垂体瘤,利用实时荧光定量聚合酶链反应技术检测SLC26A4-AS1在人垂体瘤中的表达,并进一步分析SLC26A4-AS1与垂体瘤临床参数的相关性。结果 与非侵袭性垂体瘤相比,SLC26A4-AS1在侵袭性垂体瘤中表达降低;与无功能瘤相比,SLC26A4-AS1在泌乳素瘤、生长激素瘤和促肾上腺皮质激素瘤中表达无明显差异。与SLC26A4-AS1高表达组相比,SLC26A4-AS1低表达组中肿瘤体积≥3 cm3的比例明显增加、侵袭性垂体瘤的比例明显增加,差异具有统计学意义(P<0.05)。结论 SLC26A4-AS1在侵袭性垂体瘤中表达降低,SLC26A4-AS1的低表达与肿瘤体积和侵袭性相关。
【关键词】 垂体瘤;侵袭性;长链非编码RNA;SLC26A4-AS1
【中图分类号】 R739.41 【文献标志码】 A 【文章编号】 1672-7770(2023)02-0183-06
Abstract: Objective To investigate the expression of lncRNA SLC26A4-AS1 in human pituitary adenoma and analyze its relationship with the invasiveness of pituitary adenoma. Methods The expression of SLC26A4-AS1 was measured in 41 specimens of pituitary adenomas including invasive pituitary adenomas(n=21) and noninvasive pituitary adenoma(n=16) by real-time quantitative reverse transcription polymerase chain reaction. Then, the correlation between SLC26A4-AS1 expression and clinical features of patients with pituitary adenomas were analyzed. Results The expression of SLC26A4-AS1 was decreased in invasive pituitary adenomas compared with noninvasive pituitary adenomas. There was no difference of SLC26A4-AS1 expression between PRL adenoma, GH adenoma and ACTH adenoma and nonfunctional adenomas. Compared with the SLC26A4-AS1 high-expression group, the proportion of tumor volume ≥3 cm3 and the proportion of invasive pituitary adenoma in the SLC26A4-AS1 low-expression group were significantly increased(P<0.05). Conclusions The expression of SLC26A4-AS1 is decreased in invasive pituitary adenomas. The expression of SLC26A4-AS1 is related to tumor volume and invasiveness.
Key words: pituitary adenoma; invasiveness; long non-coding RNA; SLC26A4-AS1
基金项目:广州市卫生健康科技一般引导项目(20201A011079)
作者单位:510080 广州,广东省人民医院神经外科(彭超);广州医科大学附属第二医院内分泌科(李晏丽);昆明医科大学第二附属医院神经外科(袁勇)
通信作者:袁勇
垂体瘤是最常见的中枢神经系统肿瘤之一,占颅内肿瘤的10%~20%左右[1]。既往研究表明,垂体瘤虽然是一类良性肿瘤,但仍有相当一部分会侵袭海绵窦、蝶窦、骨质等周围结构,表现为侵袭性生长,即侵袭性垂体瘤[2]。侵袭性垂体瘤手术后容易残留或复发,给临床治疗带来极大困难[3]。探究侵袭性垂体瘤的发病机制及寻找预测垂体瘤侵袭性和术后复发的标记物是最近的研究热点[4-6]。
长链非编码RNA(long non-coding RNA, lncRNA)是一类转录本长度超过200个核苷酸的非编码RNA,不具有编码蛋白功能,但可通过基因组印记、染色质修饰、染色体沉默、转录激活、转录沉默等方式,在表观遗传学、转录调控、转录后调控等层面参与基因调控过程[7]。随着高通量测序技术的发展,越来越多的lncRNAs被发现与肿瘤的增殖、侵袭、转移及预后等相关[8-9]。近年来研究表明,一些lncRNAs参与垂体瘤侵袭、进展、复发等过程[6,10-11]。目前研究表明,lncRNA中的溶質载体家族26成员4的反义RNA 1(solute carrier family 26 member 4 antisense RNA 1,SLC26A4-AS1)与多种肿瘤的增殖、进展和预后相关[12-15],但其在垂体瘤中的表达作用,尤其是与侵袭性相关的情况尚不清楚。本研究采用实时荧光定量聚合酶链反应(real-time quantitative reverse transcription polymerase chain reaction,qRT-PCR)对16例非侵袭性垂体瘤和25例侵袭性垂体瘤组织中SLC26A4-AS1的表达进行检测,探讨其在垂体瘤中的表达情况,并分析其表达变化与垂体瘤侵袭性的关系。
1 资料与方法
1.1 材料
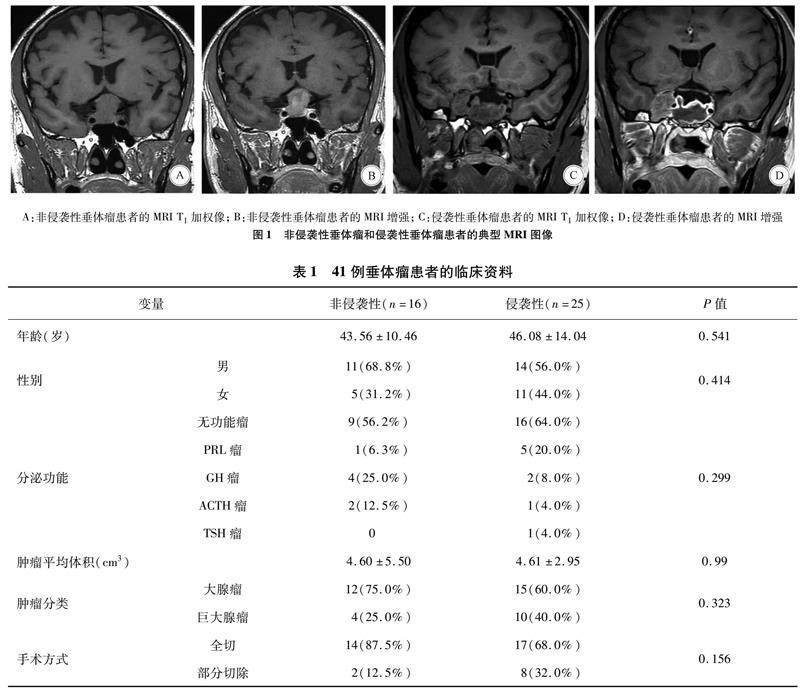
1.1.1 标本来源 所有垂体瘤标本均来自广东省人民医院神经外科,所有患者均接受蝶窦入路的垂体瘤切除术。垂体瘤的诊断基于临床表现、激素分泌生化特征、MRI和手术切除后两位病理医师证实的组织病理学分析[2]。非侵袭性垂体瘤的定义是垂体瘤局限于鞍区,不压迫周围结构,Knosp分级为 Ⅰ-Ⅱ级。侵袭性垂体瘤的定义根据Knosp分级为 Ⅲ-Ⅳ级[16]。本研究共纳入41例标本,包含16例非侵袭性垂体瘤和25例侵袭性垂体瘤,将其按分泌功能分为:无功能瘤25例,泌乳素瘤(prolactin瘤,PRL瘤)6例,生长激素瘤(growth hormone瘤,GH瘤)6例,促肾上腺皮质激素瘤(adrenocorticotropic hormone瘤,ACTH瘤)3例,促甲状腺激素瘤(thyrotropin瘤,TSH瘤)1例。垂体瘤体积计算方式是利用MRI测量并记录垂体瘤的三个平面,即横断面(TR)、正位面(AP)和颅侧面(CC)的尺寸,垂体瘤体积的估算公式为: V=(π×[TR×AP×CC])/6[17]。根据术中肿瘤切除情况及术后72 h的MRI复查结果,计算肿瘤的切除率,定义完全切除为肿瘤切除100%,部分切除,为肿瘤切除≤75%。本研究经医院伦理委员会批准,患者或家属签署知情同意书。
1.1.2 试剂和仪器 Trizol试剂:Invitrogen,美国;逆转录试剂盒:Promega,美国;qRT-PCR试剂盒:Takara,日本;引物:生工生物,中国;NanoDrop 2000分光光度计:Thermo Fisher,美国;qRT-PCR仪:Applied Biosystems(ABI),美国。
1.2 垂体瘤SLC26A4-AS1测定 手术切除后,所有垂体瘤组织样本立即被冷冻在液氮中,并保存在-80 ℃以待检。所有垂体瘤样本经过匀浆仪匀浆后,根据操作说明,使用Trizol试剂提取总RNA。用NanoDrop 2000分光光度计测定总RNA的浓度,并使用吸光度A260/A280对其纯度进行评估。使用逆转录试剂盒将RNA逆转录为cDNA,按照qRT-PCR试剂盒说明书进行qRT-PCR操作,反应体系:SYBR Green 5.0 μL,无RNA酶水3.0 μL,上下游引物各0.5 μL,cDNA 1 μL,总体积为10.0 μL。qRT-PCR获取SLC26A4-AS1及内参基因actin的Ct值后,用Ct值比较法计算SLC26A4-AS1在各组间的相对表达量(2-ΔΔCt)。SLC26A4-AS1的上、下游引物序列分别为5′-ACACGCGGGAAGGAATAAACT-3′和5′-GGTAGG-ATAGCTCCAGCTCCT-3′;actin的上、下游引物序列分别为5′-TGTGGATCGGTGGCTCCATCCT-3′和5′-AAA-CGCAGCTCAGTAACAGTC CGC-3′。
1.3 随访 对41例患者定期于门诊复查或电话等方式进行随访,随访时间为出院日至2021年9月30日,患者死亡、脱失或复发即为终止。利用UCSC Genome Browser软件(https://genome.ucsc.edu/)分析SLC26A4-AS1在人各组织中的表达情况。
1.4 統计学分析 计量资料以均数±标准差(x-±s)表示,计数资料以百分比表示。两组间比较采用t检验,多组间比较采用One-way ANOVA分析。将本研究中垂体瘤组织SLC26A4-AS1的相对表达水平的中位数为界限[18],将41例垂体瘤患者分为SLC26A4-AS1低表达组和SLC26A4-AS1高表达组,分析两组间临床资料的差异。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析和曲线下面积(area under curve,AUC)来评估SLC26A4-AS1对侵袭性垂体瘤的诊断能力。所有的统计分析都是采用SPSS 25.0软件进行统计分析。以P<0.05认为差异有统计学意义。
2 结 果
2.1 垂体瘤的临床资料 非侵袭性垂体瘤和侵袭性垂体瘤的典型MRI见图1。将41例患者分为非侵袭性组(16例)和侵袭性组(25例),两组平均年龄分别为(43.56±10.46)岁、(46.08±14.04)岁,两组在年龄、性别、分泌功能、肿瘤体积、肿瘤分类及手术方式上无统计学差异(表1)。
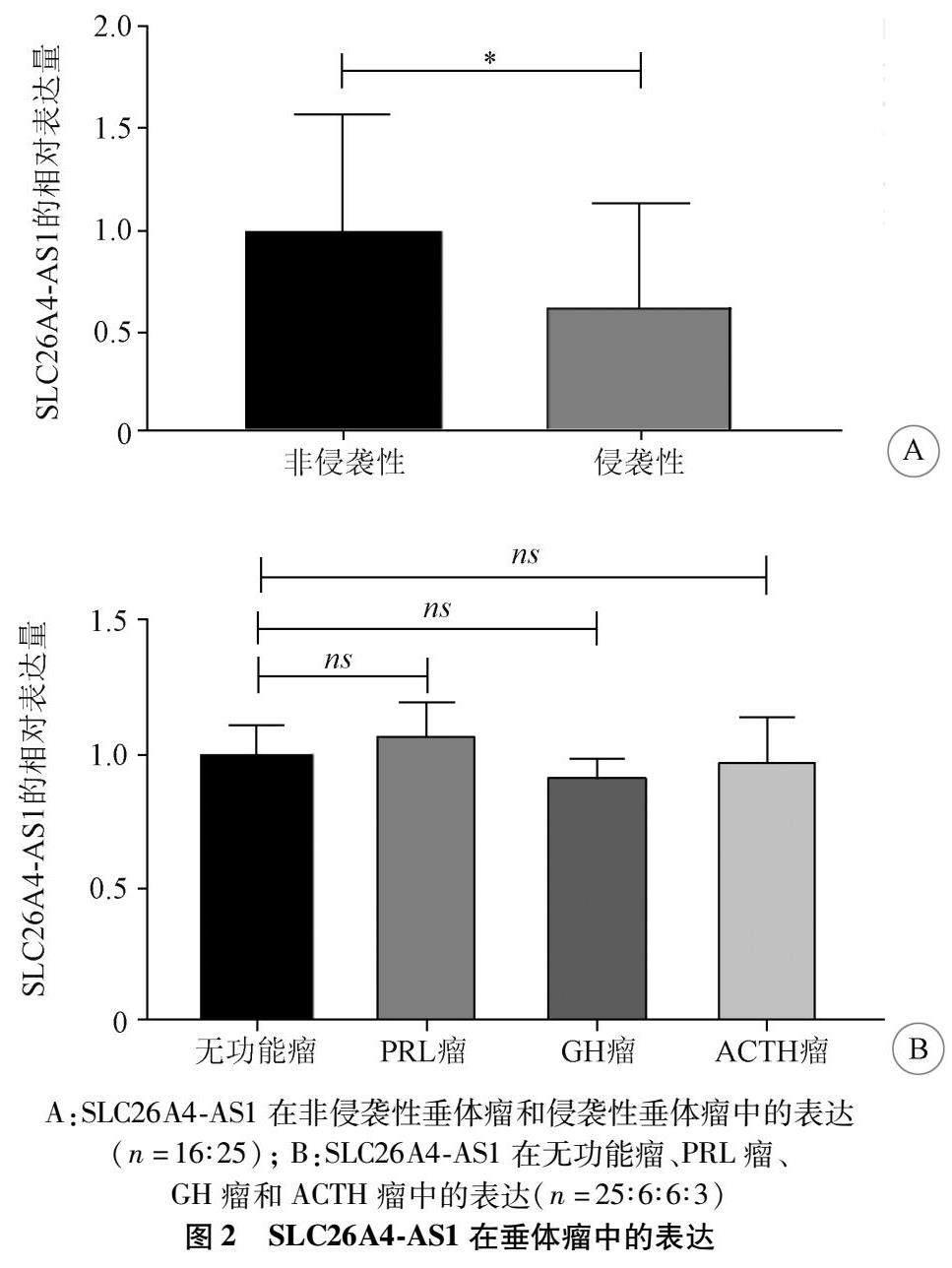
2.2 各组垂体瘤中SLC26A4-AS1的表达 与非侵袭性垂体瘤相比,侵袭性垂体瘤中SLC26A4-AS1的表达水平明显下降,差异具有统计学意义(P<0.05),见图2A。与无功能瘤相比,PRL瘤、GH瘤和ACTH瘤中SLC26A4-AS1的表达水平无显著差异,见图2B。
2.3 侵袭性情况 将本研究中垂体瘤组织中SLC26A4-AS1的相对表达水平的中位数为界限,将41例垂体瘤患者分为SLC26A4-AS1低表达组和SLC26A4-AS1高表达组,与SLC26A4-AS1高表达组相比,SLC26A4-AS1低表达组中肿瘤体积≥3 cm3的比例明显增加,差异具有统计学意义(P<0.05),见表2;与SLC26A4-AS1高表达组相比,SLC26A4-AS1低表达组中侵袭性垂体瘤的比例明显增加,差异具有统计学意义(P<0.05),见表2。而SLC26A4-AS1低表达组和SLC26A4-AS1高表达组在年龄、性别、Ki-67%和手术切除程度上,无统计学差异(表2)。
2.4 SLC26A4-AS1对侵袭性垂体瘤的诊断价值通过ROC曲线分析,确定SLC26A4-AS1对侵袭性垂体诊断的敏感性和特异性(图3),其AUC为0.693(95% CI=0.527~0.858)。
2.5 SLC26A4-AS1在人各组织上表达情况及其与肿瘤相关的研究 利用UCSC Genome Browser软件分析SLC26A4-AS1在人各组织中的表达情况,本研究发现SLC26A4-AS1在甲状腺中表达最丰富,在脑组织中表达较丰富(图 4)。该研究利用Pubmed搜索并总结了目前已发表的关于SLC26A4-AS1与肿瘤的研究报道(表3),可见在大多数的肿瘤中SLC26A4-AS1表达下降,表达下降的SLC26A4-AS1可促进肿瘤的侵袭、转移等,这与本研究在垂体瘤中的研究结果一致。
3 讨 论
垂体腺瘤是最常见的原发性脑肿瘤之一,其患病率约为80~90/10万人,并且有高达20%的复发率[24]。按照影像学资料结合术中所见可将垂体瘤分为非侵袭性和侵袭性垂体瘤[25],但目前仍没有关于垂体瘤侵袭性行为和复发的较可靠的预测因子。因此,探讨侵袭性垂体瘤的发病机制及寻找能高效诊断侵袭性垂体瘤的研究理应受到关注。
lncRNAs是一类长度超过200个核苷酸且基本无蛋白质编码功能的内源性转录本,可参与人体内多种生物学过程,近年来许多研究发现lncRNAs在许多肿瘤的发生发展中发挥着重要的调控作用,如参与增殖、凋亡、侵袭、转移和迁移等生物学过程[8]。
SLC26A4-AS1位于第7号染色体长臂的2区2带,全长为3 888个核苷酸。既往研究报道,SLC26A4-AS1在甲状腺组织表达丰富,多项研究表明SLC26A4-AS1在甲状腺癌组织中表达降低,表达降低的SLC26A4-AS1促进甲状腺癌细胞的增殖、侵袭和转移等过程,参与甲状腺癌转移、复发等,并且与甲状腺癌的生存率相关[14,19-22]。Wang等[14]{Wang,2020 #8}研究表明甲状腺癌组织中SLC26A4-AS1表达降低,在甲状腺癌细胞中过表达SLC26A4-AS1可上调肿瘤蛋白53(tumor protein,TP53)而抑制丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路,从而减少甲状腺癌细胞的增殖、迁移和侵袭,而且促进细胞凋亡,从而具有抗肿瘤的作用。Yuan等[21]研究也表明在甲状腺癌组织中SLC26A4-AS1表达下降,SLC26A4-AS1下调可激活DNA修复,从而促进甲状腺癌细胞的转移。Peng等[22]研究表明过表达SLC26A4-AS1可通过促进肌醇1,4,5-三磷酸受体1型(ITPR1)介导的自噬,从而抑制甲状腺乳头状癌的进展。但亦有一项研究报道,SLC26A4- AS1在甲状腺癌组织中表达升高,在甲状腺癌中扮演促癌因子的角色[23]。Li等[15]研究发现,SLC26A4-AS1通过上调神经穿透素1(NPTX1)在胶质瘤中发挥抗血管生成的作用。Wu等[13]发现在乳腺癌中SLC26A4-AS1表达下降,且与乳腺癌的生存率相关。Li等[12]研究表明,在胃癌中SLC26A4-AS1表达下降,与胃癌的生存率相关。上述研究都提示,SLC26A4-AS1与肿瘤侵袭性等关系密切进而影响肿瘤的侵袭及转移生长等生物学行为。为分析SLC26A4-AS1在垂体瘤中的表达水平及其与侵袭性的关系,本研究对16例非侵袭性垂体瘤和25例侵袭性垂体瘤进行qRT-qPCR检测SLC26A4-AS1在非侵袭性垂体瘤和侵袭性垂体瘤中的表达情况,结果发现,与非侵袭性垂体瘤相比,SLC26A4-AS1在侵袭性垂体瘤中表达明显降低。通过将SLC26A4-AS1的表达分为SLC26A4-AS1低表达组和SLC26A4-AS1高表达组,本研究发现与SLC26A4-AS1高表达组相比,SLC26A4-AS1低表达组中肿瘤体积>3 cm3和侵袭性垂体瘤的比例明显增加,差异具有统计学意义。通过ROC曲线分析发现,SLC26A4-AS1诊断侵袭性垂体瘤的曲线下面积为0.693,其是否可联合影像学或者免疫组化等参数提高诊断侵袭性垂体瘤的特异性和敏感性等有待进一步研究。
尽管本研究首次报道了SLC26A4-AS1在垂体瘤中的表达情况及其与垂体瘤侵袭性的相关情况,但本研究仍存在局限性:(1)本研究缺乏正常垂体组织,未能探讨与正常垂体组织相比,垂体瘤中SLC26A4-AS1的表达情况;(2)由于垂体微腺瘤进行手术的比较少,本研究所纳入的病例是大腺瘤或者巨大腺瘤,未纳入微腺瘤,未能进一步分析SLC26A4-AS1在微腺瘤、大腺瘤和巨大腺瘤中的表达情况;(3)本研究随访时间最长的为1年,总体随访时间不长,暂未能观察到SLC26A4-AS1与垂体瘤预后的相关性;(4)本研究缺乏机制研究,SLC26A4-AS1调控垂体瘤细胞的侵袭、迁移等生物学行为的相关机制未能在此研究中阐明。
与非侵袭性垂体瘤相比,SLC26A4-AS1在侵袭性垂体瘤组织中表达水平明显降低,提示SLC26A4-AS1可能在垂体瘤中的侵袭生长过程中发挥重要。
[參 考 文 献]
[1]Ezzat S,Asa SL,Couldwell WT,et al.The prevalence of pituitary adenomas:a systematic review[J].Cancer,2004,101(3):613-619.
[2]Lopes MBS.World Health Ozganization 2017 classification of pituitary tumors[J].Endocrinol Metab Clin North Am,2020,49(3):375-386.
[3]Sav A,Rotondo F,Syro LV,et al.Invasive,atypical and aggressive pituitary adenomas and carcinomas[J].Endocrinol Metab Clin North Am,2015,44(1):99-104.
[4]Wu SL,Gu Y,Huang YY,et al.Novel biomarkers for non-functioning invasive pituitary adenomas were identified by using analysis of microRNAs expression profile[J].Biochem Genet,2017,55(3):253-267.
[5]Li JJ,Qian Y,Zhang C,et al.LncRNA LINC00473 is involved in the progression of invasive pituitary adenoma by upregulating KMT5A via ceRNA-mediated miR-502-3p evasion[J].Cell Death Dis,2021,12(6):580.
[6]Guo J,Fang QY,Liu YL,et al.Identifying critical protein-coding genes and long non-coding RNAs in non-functioning pituitary adenoma recurrence[J].Oncol Lett,2021,21(4):264.
[7]Ponting CP,Oliver PL,Reik W.Evolution and functions of long noncoding RNAs[J].Cell,2009,136(4):629-641.
[8]Peng WX,Koirala P,Mo YY.LncRNA-mediated regulation of cell signaling in cancer[J].Oncogene,2017,36(41):5661-5667.
[9]Chen SS,Fang Y,Sun LY,et al.Long non-coding RNA:a potential strategy for the diagnosis and treatment of colorectal cancer[J].Front Oncol,2021,11(10):762752.
[10]Xue YH,Ge YQ.Construction of lncRNA regulatory networks reveal the key lncRNAs associated with pituitary adenomas progression[J].Math Biosci Eng,2020,17(3):2138-2149.
[11]Beylerli O,Khasanov D,Gareev I,et al.Differential non-coding RNAs expression profiles of invasive and non-invasive pituitary adenomas[J].Noncoding RNA Res,2021,6(3):115-122.
[12]Li CY,Liang GY,Yao WZ,et al.Integrated analysis of long non-coding RNA competing interactions reveals the potential role in progression of human gastric cancer[J].Int J Oncol,2016,48(5):1965-1976.
[13]Wu J,Li ML,Zhang YJ.Long noncoding RNA HOXA-AS2 regulates the expression of SCN3A by sponging miR-106a in breast cancer[J].J Cell Biochem,2019,120(9):14465-14475.
[14]Wang DP,Tang XZ,Liang QK,et al.Overexpression of long noncoding RNA SLC26A4-AS1 inhibits the epithelial-mesenchymal transition via the MAPK pathway in papillary thyroid carcinoma[J].J Cell Physiol,2020,235(3):2403-2413.
[15]Li HJ,Yan RY,Chen WQ,et al.Long non coding RNA SLC26A4-AS1 exerts antiangiogenic effects in human glioma by upregulating NPTX1 via NFKB1 transcriptional factor[J].FEBS J,2021,288(1):212-228.
[16]Micko ASG,Whrer A,Wolfsberger S,et al.Invasion of the cavernous sinus space in pituitary adenomas: endoscopic verification and its correlation with an MRI-based classification[J].J Neurosurg,2015,122(4):803-811.
[17]Mak HKF,Lai SW,Qian WS,et al.Effective time window in reducing pituitary adenoma size by gamma knife radiosurgery[J].Pituitary,2015,18(4):509-517.
[18]He C,Yang J,Ding JW,et al.Downregulation of glucose-6-phosphate dehydrogenase by microRNA-1 inhibits the growth of pituitary tumor cells[J].Oncol Rep,2018,40(6):3533-3542.
[19]Liang WW,Sun FF.Identification of pivotal lncRNAs in papillary thyroid cancer using lncRNA-mRNA-miRNA ceRNA network analysis[J].PeerJ,2019,7(9):e7441.
[20]Rao YS,Liu HY,Yan XJ,et al.In silico analysis identifies differently expressed lncRNAs as novel biomarkers for the prognosis of thyroid cancer[J].Comput Math Methods Med,2020,2020(4):3651051.
[21]Yuan JP,Song YM,Pan WT,et al.LncRNA SLC26A4-AS1 suppresses the MRN complex-mediated DNA repair signaling and thyroid cancer metastasis by destabilizing DDX5[J].Oncogene,2020,39(43):6664-6676.
[22]Peng D,Li WF,Zhang BJ,et al.Overexpression of lncRNA SLC26A4-AS1 inhibits papillary thyroid carcinoma progression through recruiting ETS1 to promote ITPR1-mediated autophagy[J].J Cell Mol Med,2021,25(17):8148-8158.
[23]Li ZY,Lin WX,Zheng JH,et al.Identification of immune-related lncRNAs to improve the prognosis prediction for patients with papillary thyroid cancer[J].Biosci Rep,2021,41(2):BSR20204086.
[24]Chatzellis E,Alexandraki KI,Androulakis II,et al.Aggressive pituitary tumors[J].Neuroendocrinology,2015,101(2):87-104.
[25]Miermeister CP,Petersenn S,Buchfelder M,et al.Erratum:histological criteria for atypical pituitary adenomas-data from the German pituitary adenoma registry suggests modifications[J].Acta Neuropathol Commun,2016,4(1):21.
(收稿2021-12-31 修回2022-05-04)
