臭氧协同Fe/SSZ-13分子筛催化氧化低浓度甲烷的性能研究
2023-04-25桂煜周光照李佩青陈婷李珂林赫
桂煜,周光照,李佩青,陈婷,李珂,林赫
(1.上海交通大学动力机械与工程教育部重点实验室,上海 200240;2.中国船舶集团有限公司第七一一研究所,上海 201108 )
近些年全球气候变暖引发了一系列环境问题,如冰川融化、海平面上升以及极端恶劣气候频发等。甲烷作为一种强温室气体,在100年内造成的温室效应是CO2的25倍左右。天然气发动机是甲烷排放的主要来源之一,据统计天然气发动机的甲烷排放量大约为传统汽油机和柴油机的10倍[1]。因此,严格控制天然气发动机的甲烷排放将有助于缓解全球温室效应,推进碳达峰、碳中和的实现。
研究表明,天然气发动机尾气中甲烷排放的浓度一般低于0.5%,难以通过直接燃烧的方法去除,而采用催化氧化技术可以降低反应活化能,是去除低浓度甲烷最常见且有效的方法之一。甲烷分子的高结构对称性和低分子极化性使得甲烷必须克服较高的吸附能垒,因此,甲烷催化氧化反应仍需要较高的起燃温度(甲烷转化率达到50%所对应的温度,T50)[2]。目前,商用的甲烷催化氧化催化剂主要是以γ-Al2O3为载体,以贵金属(铂、钯、铑等)为活性组分,通过掺杂Ce、Zr等元素来提高催化剂的热稳定性和抗中毒性。贵金属催化剂中Pd(钯)基催化剂以其优异的催化性能而备受关注,T50可以达到300~350 ℃[3-5]。然而Pd基催化剂价格昂贵以及高温易烧结的问题没有得到解决,并且在富含H2O和SO2的气氛中该类催化剂还会产生严重的失活效应[6-7]。为了减少贵金属用量,降低催化剂成本,非贵金属类催化剂(Co、Fe、Ni、Mn、Cu等)也得到广泛的研究[8-10],但迄今为止非贵金属类催化剂在低温段对甲烷的催化效率仍不及贵金属类催化剂。因此,本研究期望探索一种低成本且高效的低浓度甲烷去除方法。
为开发适用于臭氧气氛下的甲烷催化氧化催化剂,首先通过浸渍法制备了5种不同负载量的Fe/SSZ-13分子筛,探究了O3与Fe/SSZ-13分子筛对甲烷去除的协同效应,发现Fe负载量为1%时甲烷催化氧化效果最佳,并在此基础上考察了O3与CH4进气比和空速对催化性能的影响。其次,通过BET,XRD,NH3-TPD,H2-TPR,XPS,UV-Vis等一系列表征手段揭示了催化剂的孔道结构、晶体组成、酸性位点、表面Fe元素的价态分布以及不同Fe物种对甲烷催化臭氧化的影响,最后基于原位红外技术对甲烷在Fe/SSZ-13分子筛表面上的吸附特性以及催化臭氧化反应路径进行了探索。
1 实验系统与方法
1.1 催化剂的制备
本研究使用的催化剂载体为商用的H-SSZ-13分子筛(n(Si)∶n(Al)=10),通过浸渍法制备出Fe负载量(质量分数)为0.5%,1%,2.5%,5%,10%的Fe-SSZ-13粉末样品,分别记为Fe0.5/SSZ-13,Fe1/SSZ-13,Fe2.5/SSZ-13,Fe5/SSZ-13,Fe10/SSZ-13。首先,将1 g H-SSZ-13溶解于不同浓度的硝酸铁溶液中,并在80 ℃下水浴搅拌直至蒸干,再将样品放置于烘箱中110 ℃干燥12 h,最后将干燥后的样品在马弗炉中550 ℃焙烧4 h,升温速率为10 ℃/min。为了减少反应压降,保持气流通道通畅,需要对焙烧的样品进行压片、研磨,筛选出40~80目颗粒,得到最终成品催化剂。
1.2 实验系统与评价方法
整个反应是在固定床石英流动反应器中进行,实验系统示意见图1。整个系统主要分为3个部分:气路控制系统、催化反应系统以及气体浓度检测系统。气路控制系统中O2,N2,CH4来源于标准气瓶,O3则以纯O2为气源经过臭氧发生器而产生,各分支气路的流量通过精确标定的质量流量器控制。通入反应器前各组分浓度中CH4质量分数为1 000 ×10-6,O3质量分数为1 000×10-6~8 000 ×10-6,O2质量分数为10%,其余气体为N2,总流量为400 mL/min。催化反应系统由程序升温管式炉和石英管反应器组成。取0.3 g催化剂放置于反应器中并以石英棉固定其两端,测试之前,在N2氛围中,在温度为400 ℃的条件下对催化剂预处理1 h,性能测试的温度范围在50~600 ℃之间,升温速率为5 ℃/min,每个采样点维持10 min以保证反应达到稳态。气体浓度检测系统包括傅里叶红外光谱仪和臭氧分析检测仪,用于反应器出入口气体成分和浓度的检测。通过以下公式分别计算CH4、O3转化率和CO2、CO选择性。
(1)
(2)
(3)
(4)
式中:[…]in和[…]out分别代表反应器出入口气体的摩尔浓度。
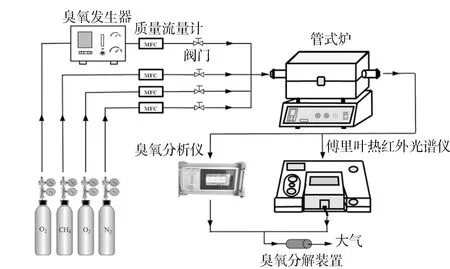
图1 臭氧协同催化氧化实验系统示意
1.3 催化剂的表征技术
催化剂的孔道特征通过Quantachrome的比表面积和孔径分布分析仪(NOVA 2000e)进行测量,使用BET方法计算比表面积,使用BJH方法计算平均孔径。XRD(X射线衍射)采用Rigaku D/max-2200/PC X射线型衍射分析仪,用来表征催化剂的物相成分和晶体结构。XPS(Kα射线光电子能谱)是以镁Kα辐射(h=1 253.6 eV)作为激发源在PHI 5000C ESCA System的X射线光电子能谱仪上进行。采用UV-Vis(紫外-可见光光谱)检测Fe/SSZ-13分子筛中铁物种。H2-TPR被用来测试催化剂的氧化还原性,测试实验在Micromeritics Chemisorb 2720设备上进行。NH3-TPD是以NH3为探针分子来测量催化剂的表面酸性,通过NICOLET6700傅里叶变换红外光谱仪检测随温度上升吸附NH3的脱附情况。为了揭示甲烷催化臭氧化反应的中间物种与机理,利用原位红外光谱仪(in situ FTIR, Thermo Nicolet iS10)对Fe/SSZ-13分子筛表面上甲烷的吸附特性和氧化反应过程进行研究。吸附过程的反应条件为100 ℃,总流量为400 mL/min, CH4质量分数为1 000×10-6,分别在0 min,3 min,5 min,8 min,10 min,15 min和20 min进行记录。氧化过程在100~400 ℃范围内进行,总流量为400 ml/min,CH4质量分数为1 000×10-6,O3质量分数为6 000×10-6,O2质量分数为10%。
2 结果与讨论
2.1 活性评价结果分析
图2a与图2b分别示出了在有臭氧气氛和无臭氧气氛下,不同Fe负载量的Fe/SSZ-13分子筛催化氧化甲烷活性。当未添加臭氧时,所有样品在200~400 ℃的甲烷转化率不超过25%,而添加臭氧后,催化性能得到了明显的提升。此外,从图2a中发现,在添加臭氧后所有样品的催化活性随温度变化都呈现出先增加后减少再增加的趋势。在100~200 ℃之间,温度上升促进了臭氧与甲烷的催化反应,致使甲烷转化率提升,但是在200~350 ℃之间,由于O3的热分解速率加速导致甲烷转化率逐渐下降[13]。随着温度继续上升,此时主要是O2为催化反应提供所需的活性氧,因此在高温段臭氧对甲烷转化率的增益较小。H-SSZ-13分子筛在250 ℃能够达到47.1%的甲烷转化率,这是由于分子筛的强酸位点能够促进O3分解,从而为催化反应提供高活性氧物种[17]。但是,Fe/SSZ-13分子筛的活性随着Fe负载量的变化存在一个最佳值,即负载量为1%时,200 ℃时的甲烷转化率可达80.8%,CO2选择性为94.3%(见表1),这可能与催化剂中Fe的分布位置、价态和种类有关。此外,所有样品的O3转化率在100 ℃以上都能达到100%,表明O3可以被催化剂完全分解,不会因为存在残留O3而造成二次污染。图3a与图3b分别对比了CH4与O3的物质的量之比(n(CH4)∶n(O3))和空速对Fe0.1/SSZ-13分子筛催化性能的影响,可以看到甲烷转化率随n(CH4)∶n(O3)的减小而上升,且当n(CH4)∶n(O3)=1∶8时,甲烷转化率在200 ℃达到97.8%。由于反应活性位数量的限制,反应空速增加会使催化性能有所下降,但在240 000 mL/(g·h)的空速条件下,甲烷转化率仍然能保持在66.4%左右。


图2 Fe负载量对甲烷催化氧化性能的影响
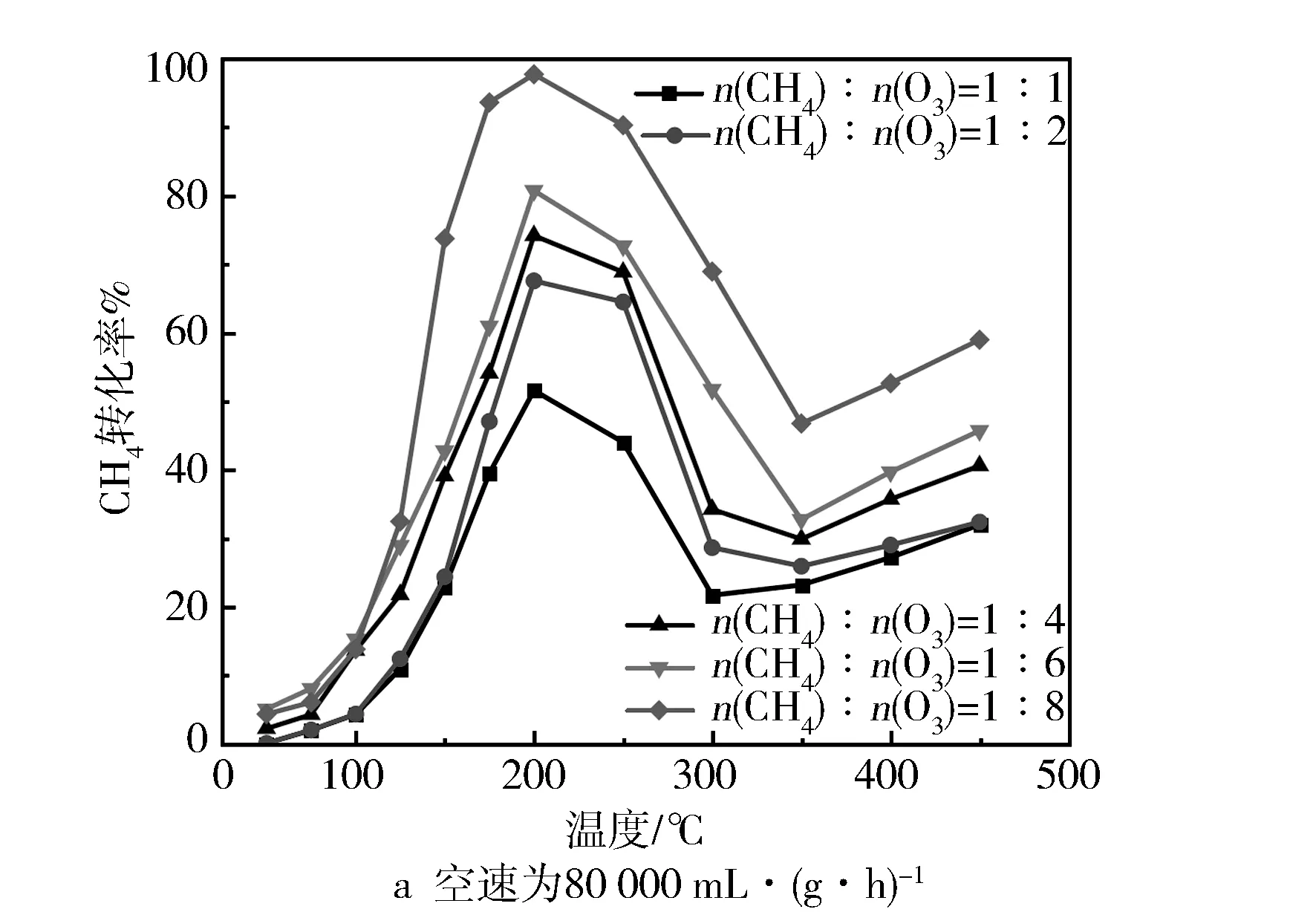
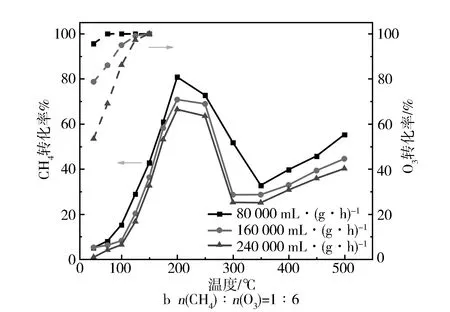
图3 n(CH4)∶n(O3)和质量空速对Fe1/SSZ-13分子筛催化性能的影响
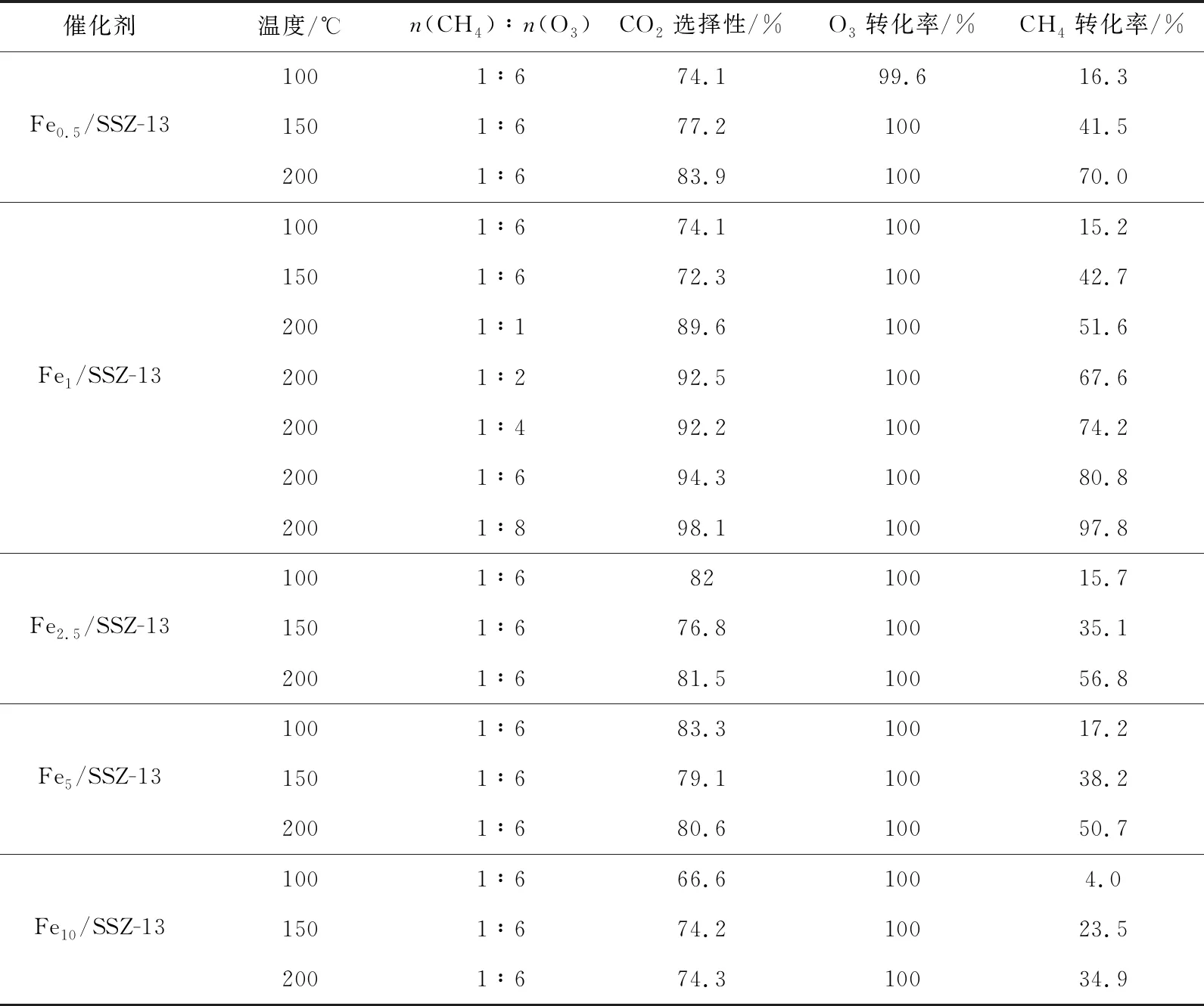
表1 不同Fe/SSZ-13分子筛在不同工况下催化臭氧化甲烷的性能
2.2 表征分析
2.2.1 晶体结构
不同Fe/SSZ-13分子筛的XRD图谱如图4所示,所有样品的XRD图谱都呈现出菱沸石(CHA型分子筛)的结构特征峰,分别位于9.5°,12.8°,15.9°,17.7°,20.5°,25.8°和30.7°[18]。但对于2.5%,5%和10%的样品,在24.1°,33.2°,35.6°处发现α-Fe2O3(PDF#89-0596)的特征衍射峰,而Fe0.5/SSZ-13、Fe1/SSZ-13的样品中并未出现,这可能是由于Fe在低负载量的样品上交换到分子筛位点上或高度分散。从图4中还可以看到,随着Fe负载量的增多,CHA型分子筛的结构特征峰强度逐渐下降,表明大颗粒的Fe2O3物种会造成分子筛结构的破坏。
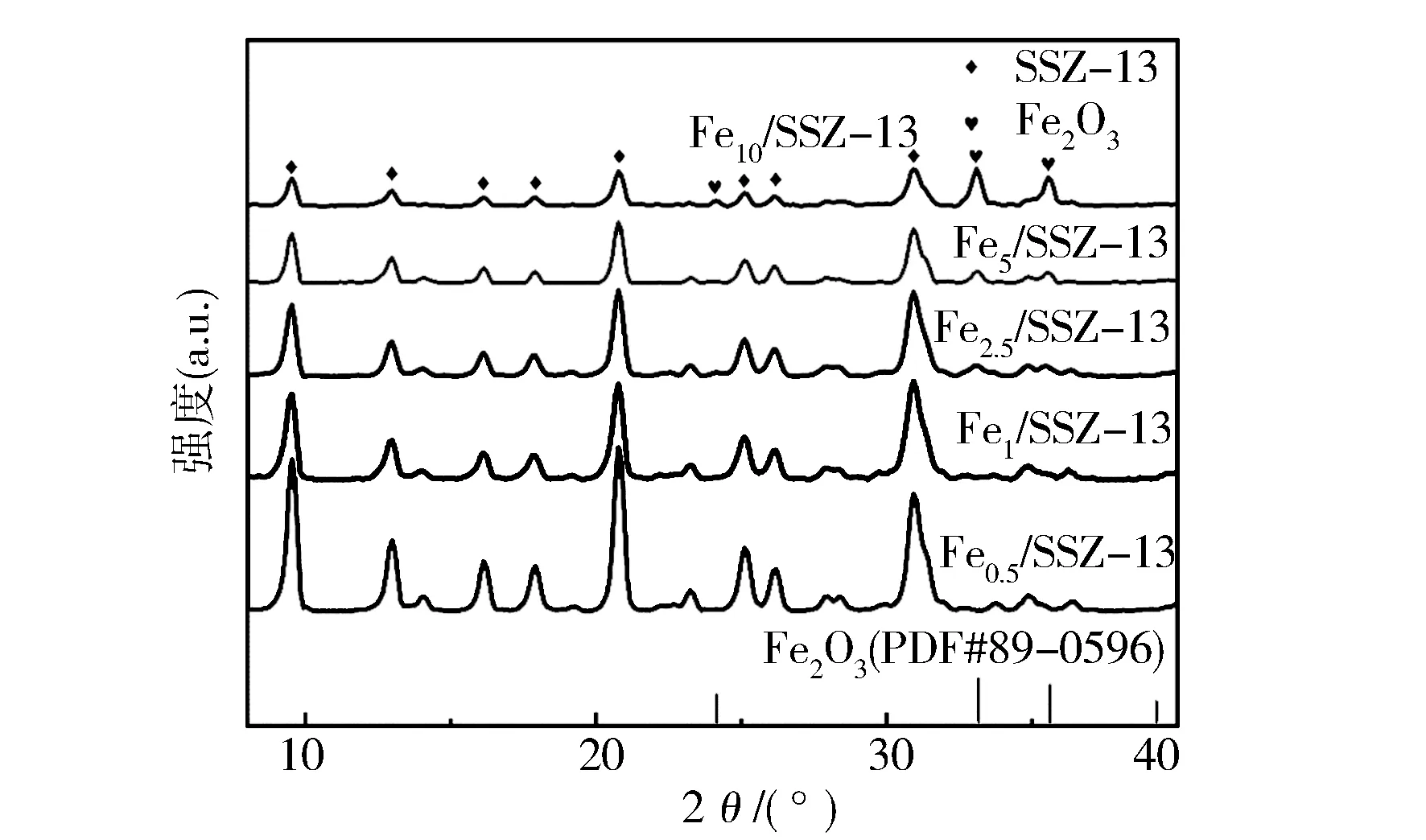
图4 不同Fe/SSZ-13分子筛的XRD图谱
2.2.2 孔道特性
表2示出了不同Fe/SSZ-13分子筛的比表面积、孔容和平均孔径。通过对比可以发现, Fe1/SSZ-13有着最高的比表面积(453.896 m2/g)和孔隙体积(0.269 1 cm3/g),而Fe5/SSZ-13和Fe10/SSZ-13的比表面积和总孔容显著下降,可能是由于形成大颗粒的氧化铁物种造成分子筛孔道的堵塞。不同催化剂的比表面积变化趋势与其催化活性趋势是一致的,说明催化剂的比表面积是甲烷臭氧化反应的重要影响因素之一。图5a中的N2吸附-脱附等温线反映了5种Fe/SSZ-13分子筛的孔道结构特征。根据IUPAC分类,所有样品都展现出典型的Ⅵ型等温线,且出现明显的H3型回滞环,表明催化剂存在介孔结构。从图5b中也可观察到所有样品的孔径主要分布于2 nm以下,但随着Fe负载量的增多,小于2 nm的微孔数量逐渐减少,表明分子筛的孔道结构遭到一定程度的破坏,这与XRD的结果是相符合的。
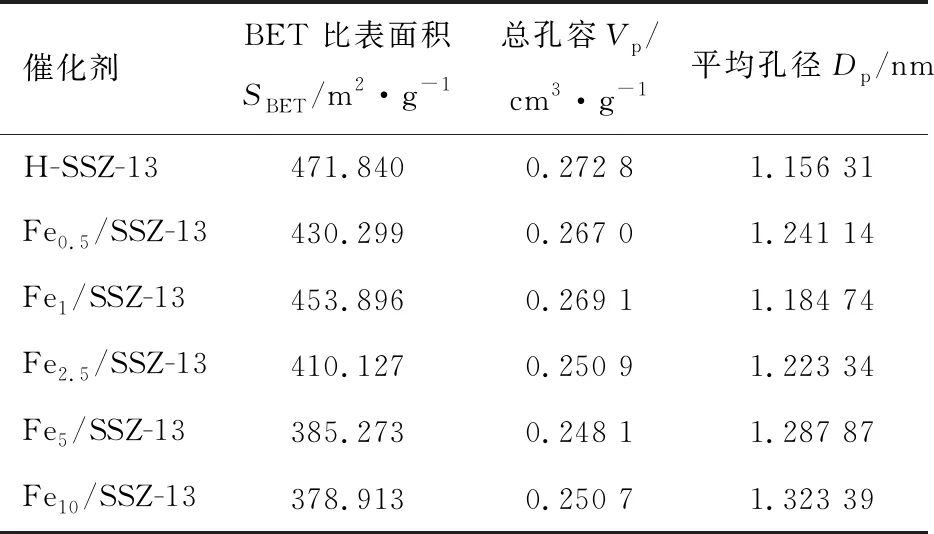
表2 不同Fe/SSZ-13分子筛的物理结构参数
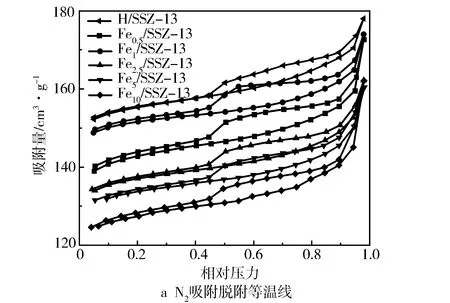
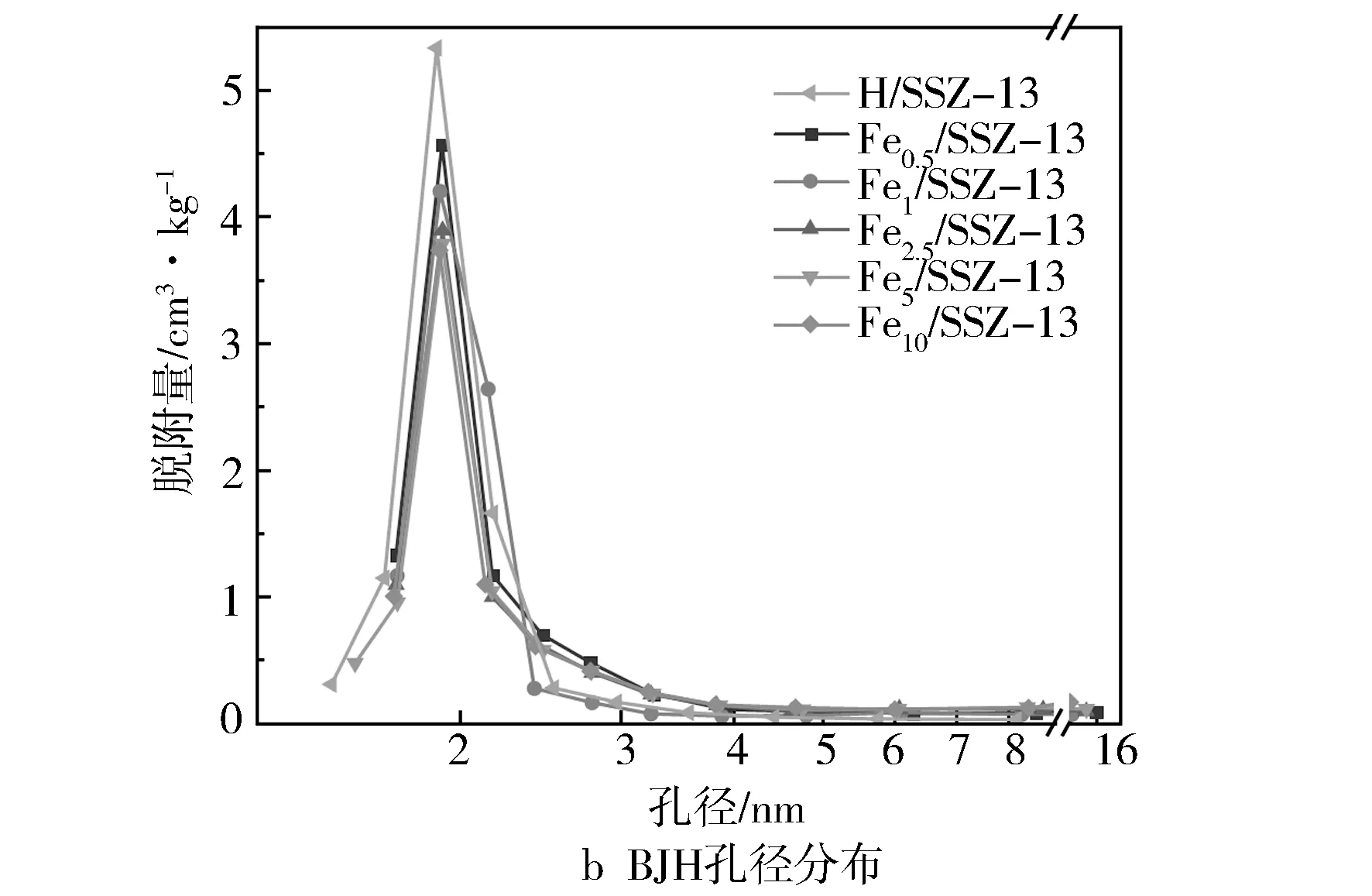
图5 不同Fe负载量分子筛的BET结果
2.2.3 NH3-TPD
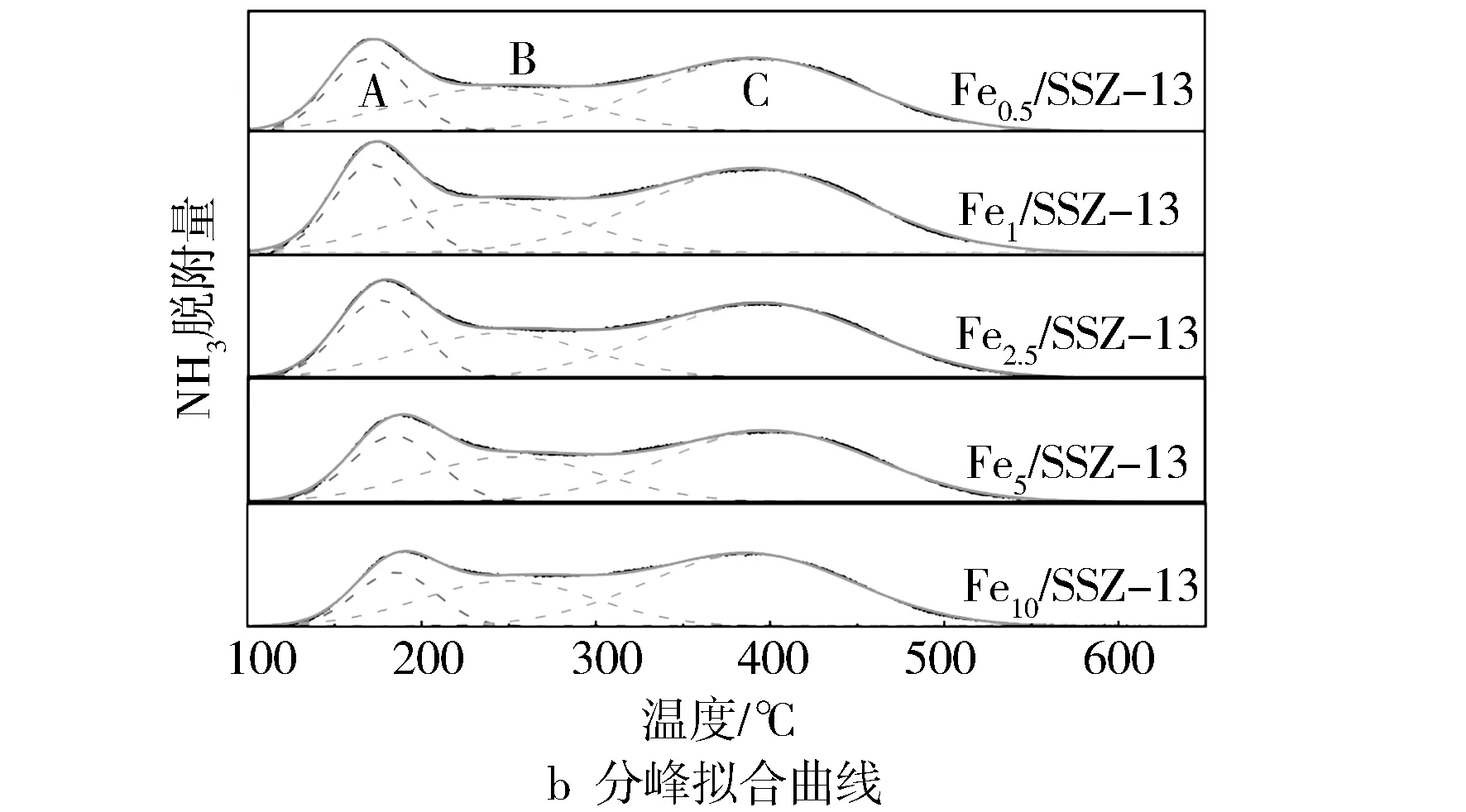
图6 不同Fe/SSZ-13的NH3-TPD图
2.2.4 表面元素价态分析

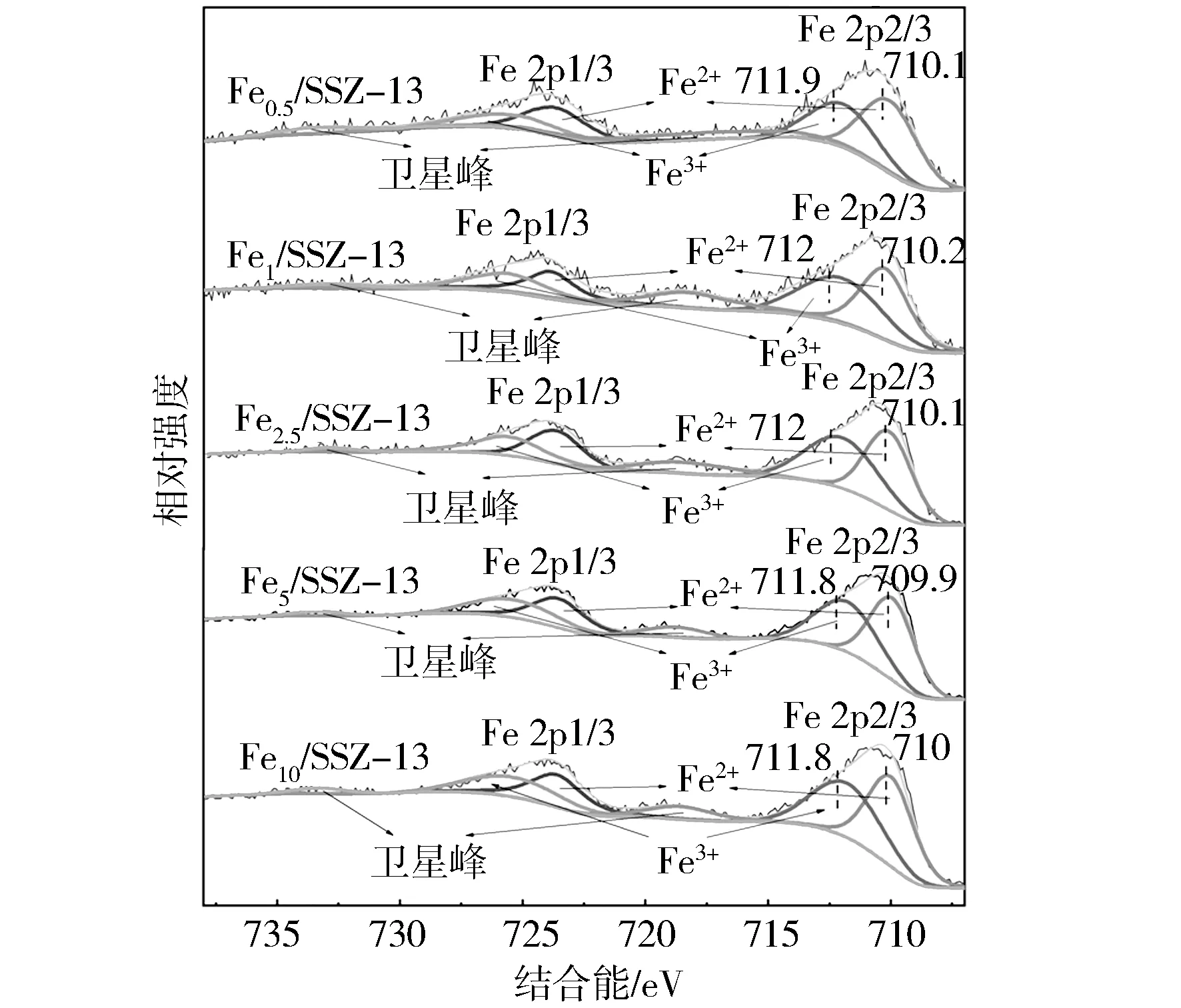
图7 不同Fe/SSZ-13分子筛XPS的Fe 2p图谱
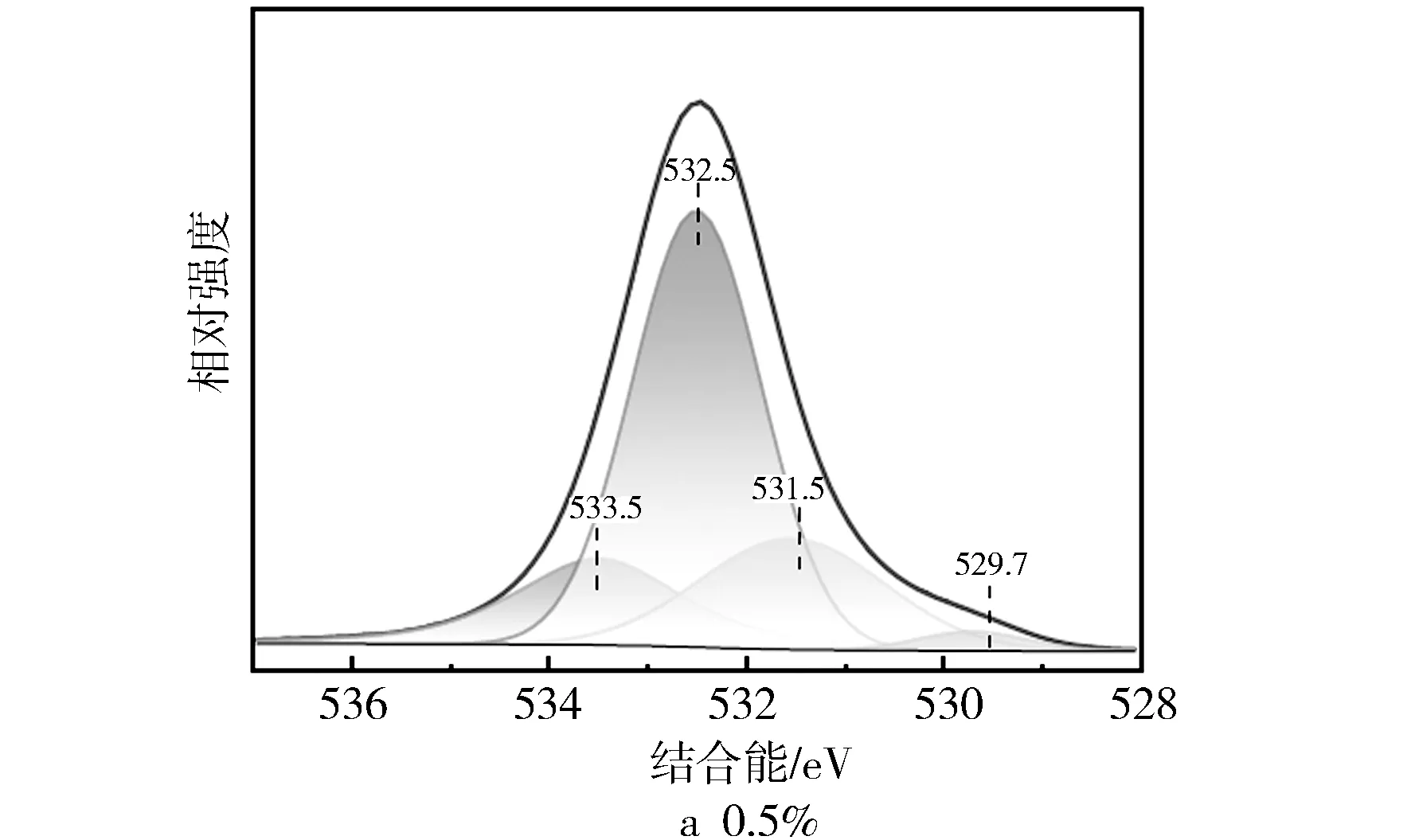
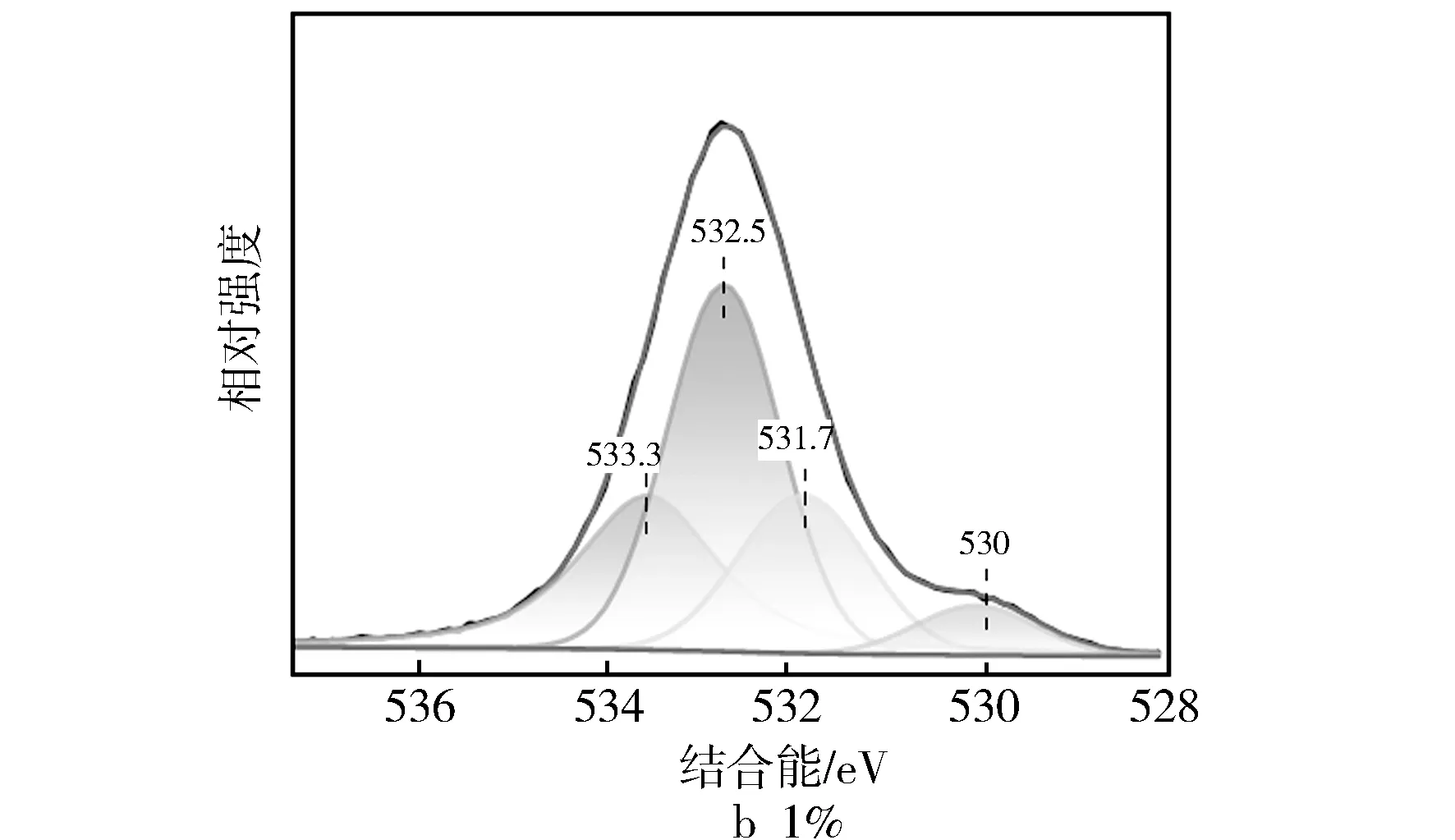
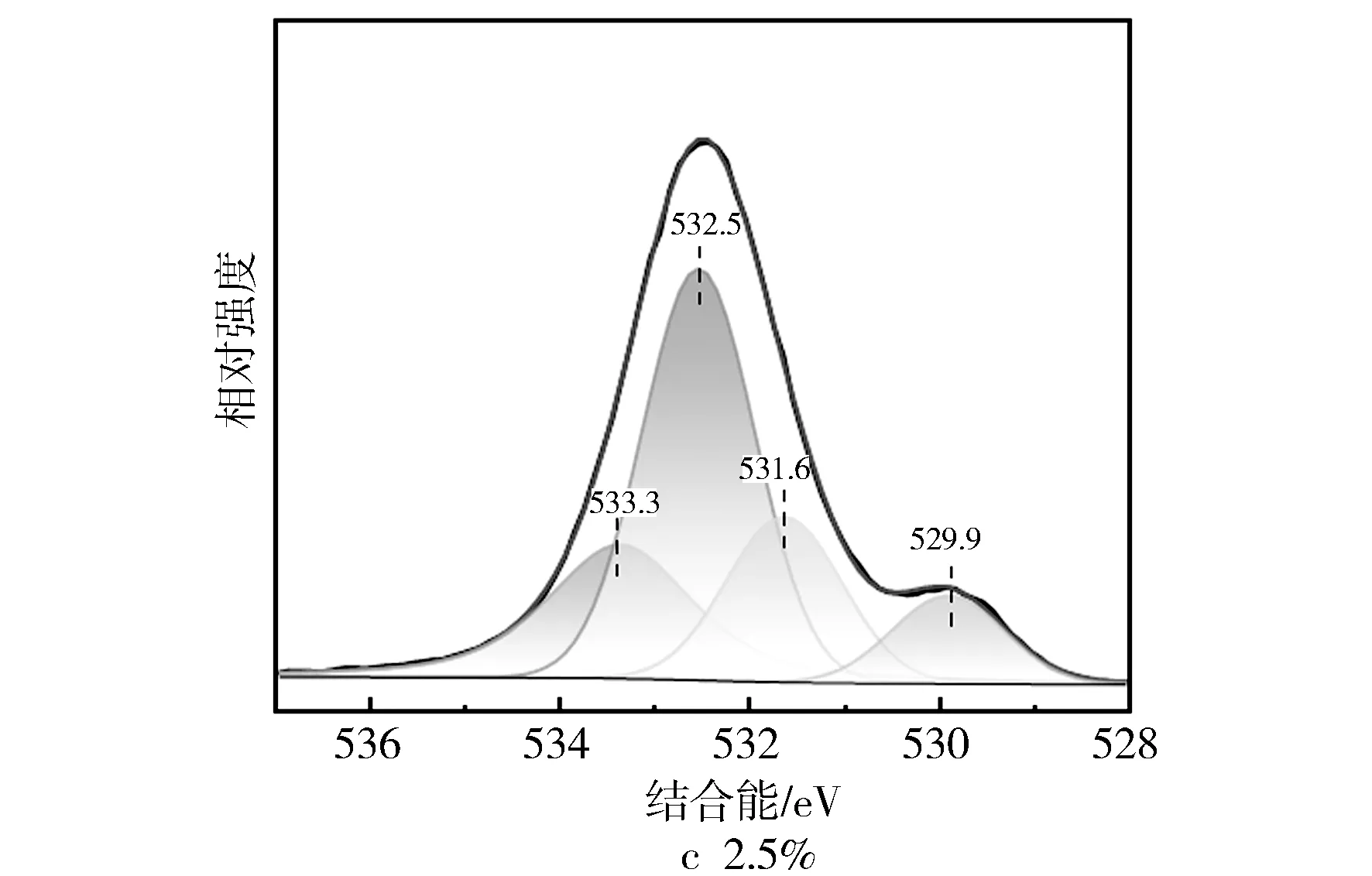

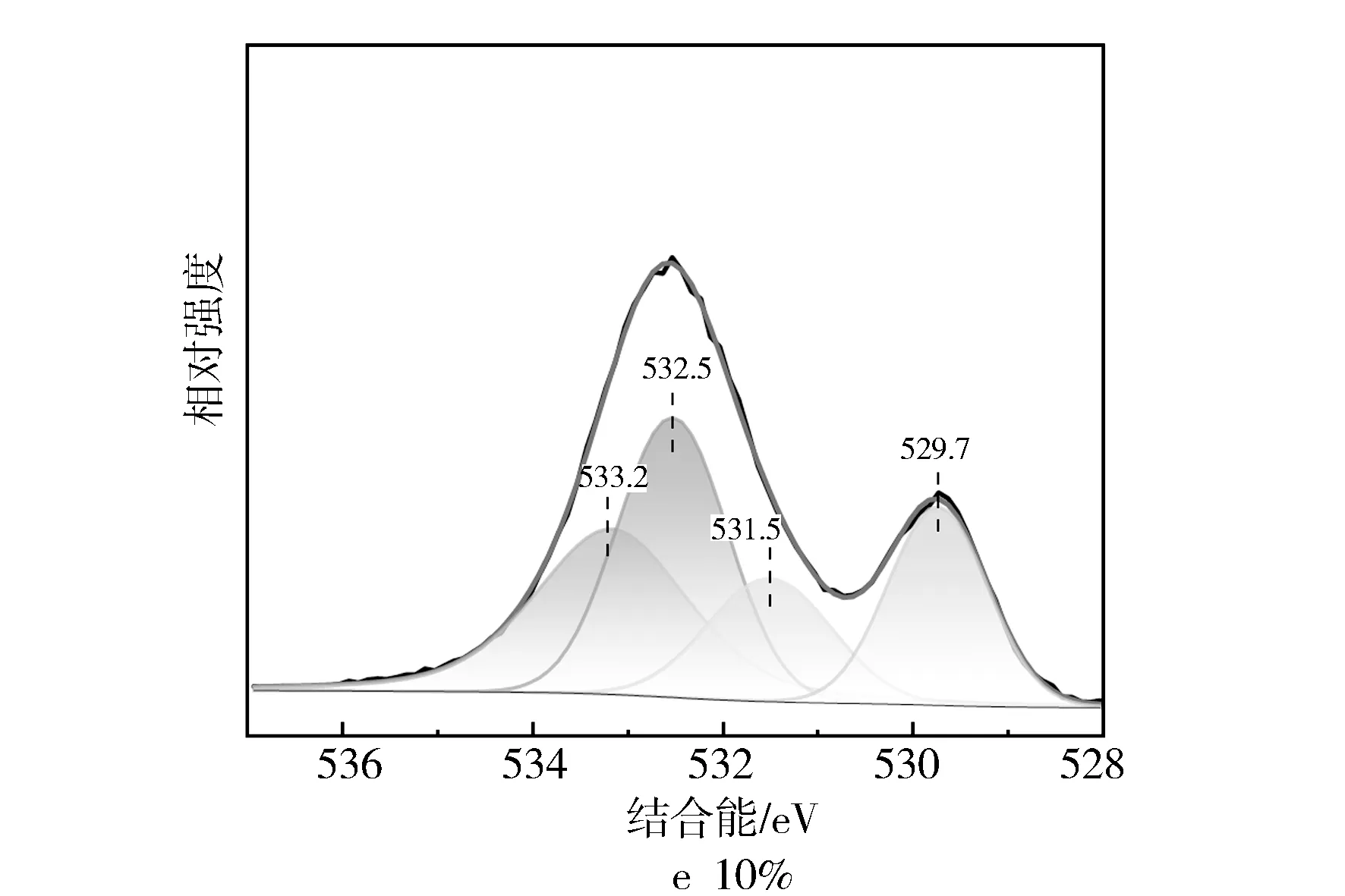
图8 不同Fe/SSZ-13分子筛XPS的O1s图谱
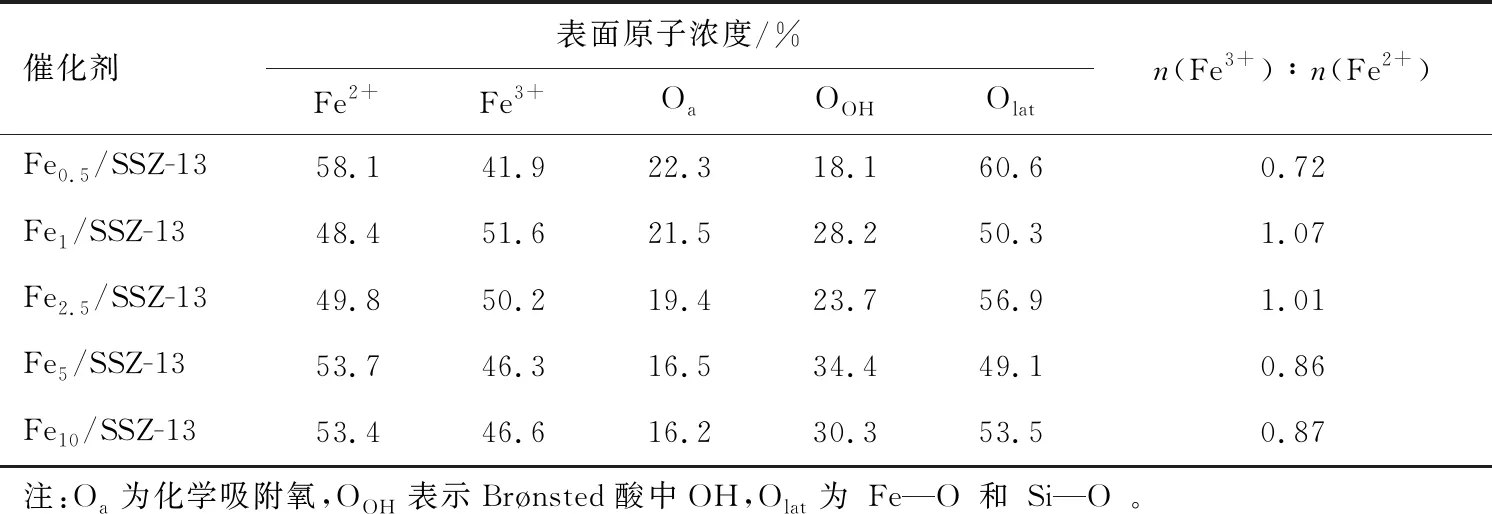
表3 不同Fe/SSZ-13分子筛表面原子组成与浓度
2.2.5 Fe物种的种类

(5)

(6)

(7)
式中:*代表活性位点。
需要指出,在200 ℃所有样品都能完全分解O3,但Fe10/SSZ-13分子筛的性能却下降了45.9%,可以推断Fe2O3颗粒促进了*O与O3反应,致使催化剂表面活性氧浓度降低,进而降低了甲烷的低温转化率。
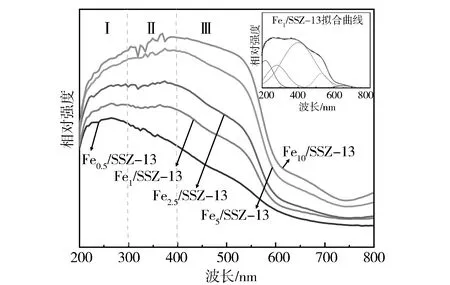
图9 不同Fe/SSZ-13分子筛的UV-Vis图谱
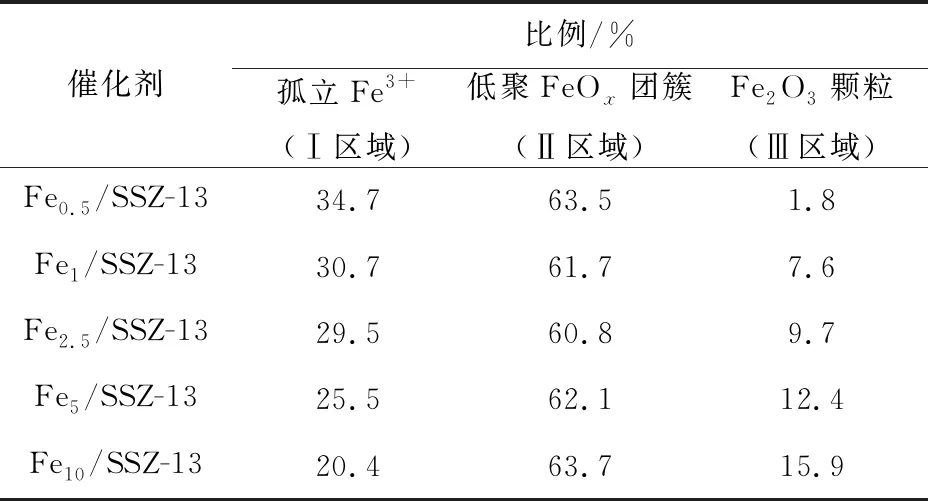
表4 不同Fe/SSZ-13分子筛中Fe物种的相对含量
2.2.6 氧化还原性分析
利用H2-TPR来观察不同Fe物种在催化剂中的氧化还原性,结果如图10所示。所有样品在300~600 ℃存在两个主要还原峰,低温的还原峰对应孤立Fe3+还原到Fe2+以及Fe2O3还原到Fe3O4,高温的还原峰对应Fe3O4到FeO的还原。此外,Fe3O4或者FeO还原到Fe0一般发生在600 ℃以上,稳定的Fe2+则需要800 ℃以上才能被还原[28]。从图10中可以看到,Fe2.5/SSZ-13,Fe5/SSZ-13和Fe10/SSZ-13中第一个峰的还原温度较低,且还原峰强度更大,说明在高负载量样品中Fe3+离子更容易被还原,但这种趋势与其活性并不一致,表明在低温段Fe3+的氧化还原性并不是甲烷催化臭氧化反应的主要因素,但在高温段(>500 ℃)高Fe负载量的催化剂展现出更高的活性。

图10 不同Fe/SSZ-13分子筛的H2-TPR图谱
2.3 甲烷吸附特性与催化臭氧化反应机理

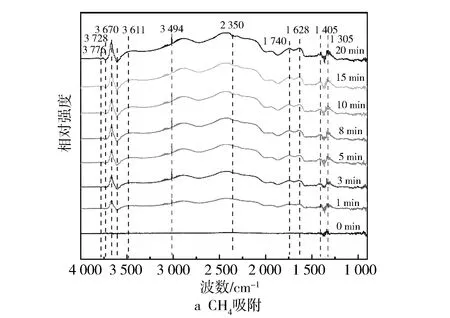
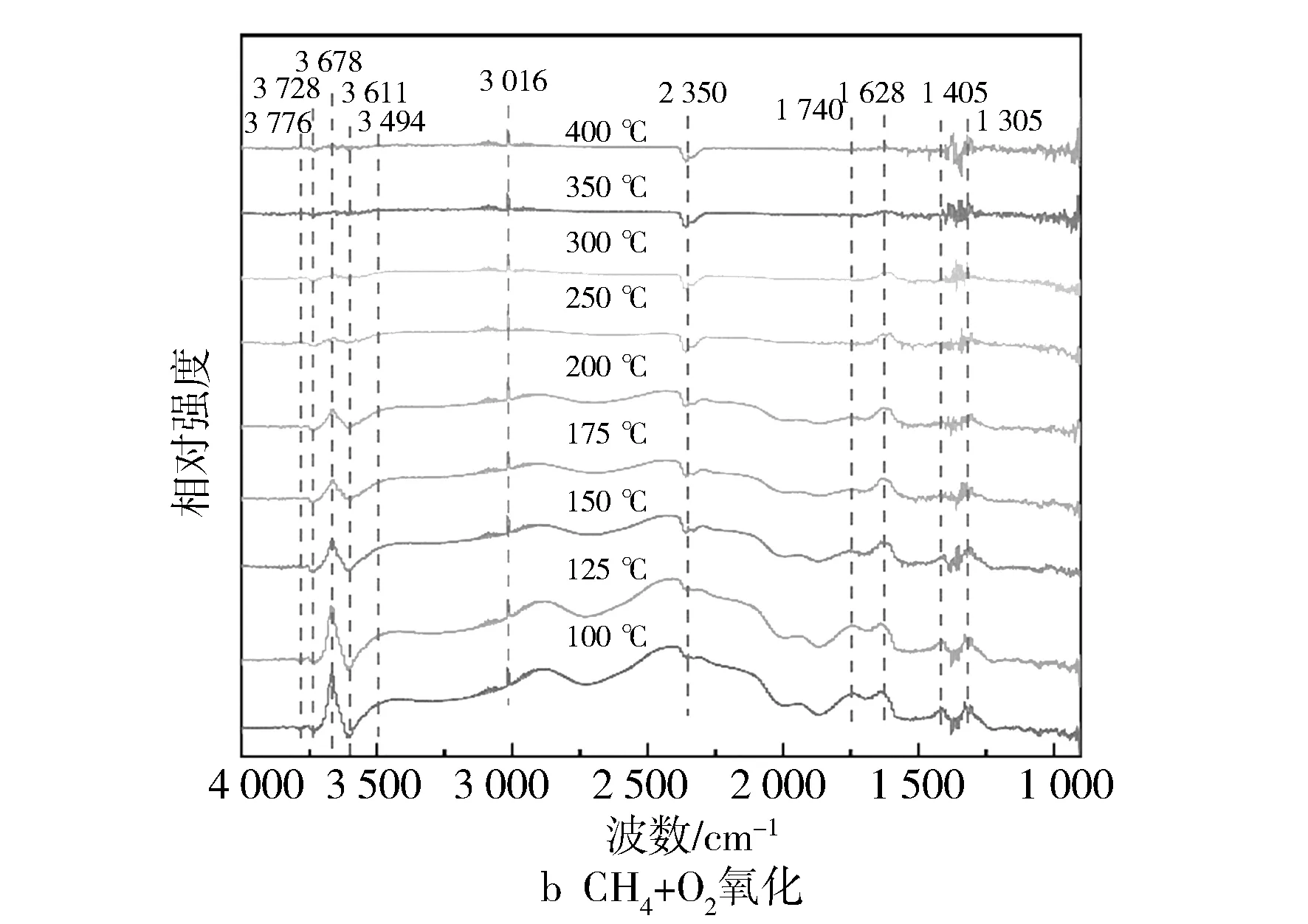
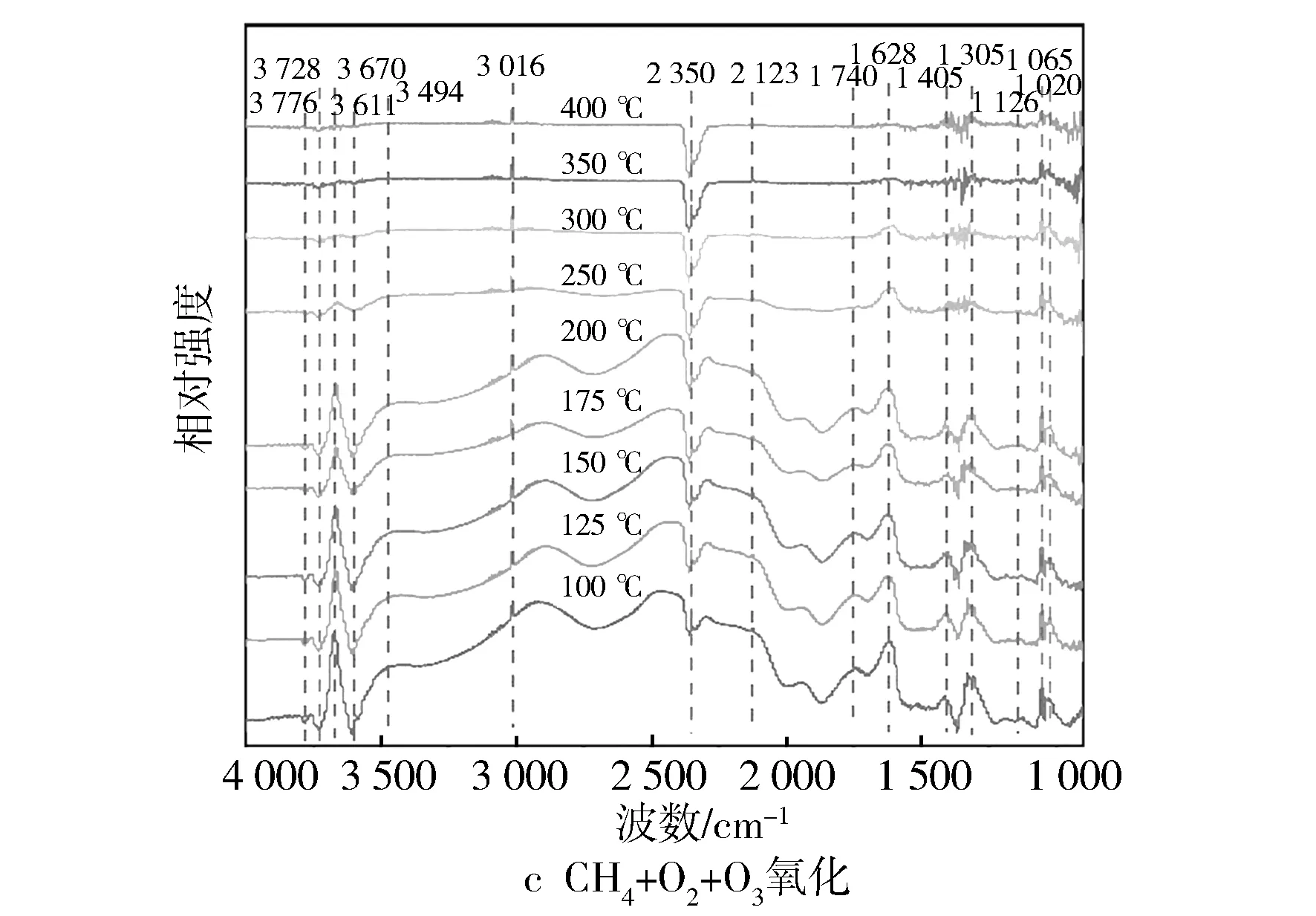
图11 在Fe1/SSZ-13分子筛上甲烷吸附与氧化的原位红外光谱
从图11c中发现,在臭氧的气氛下,在1 065 cm-1和1 020 cm-1处出现吸附态的O3分子,1 126 cm-1处出现超氧化物O2-的特征峰,而这3个峰在未添加臭氧的情况下并未检测到,说明臭氧的吸附和分解提高了催化剂表面活性氧的浓度[34]。与此同时,相对于图11b,图11c中2 800~3 000 cm-1的宽峰以及1 305 cm-1处甲烷的吸附特征峰明显增强,表明臭氧的加入有助于活化活性位点,增强了甲烷在催化剂表面的吸附。另外从反应产物角度来看,中间产物甲酸盐(1 405 cm-1)、碳酸盐(1 628 cm-1)和醛基(1 740 cm-1)以及吸附态CO2(2 350 cm-1)的峰强也得到明显提升,表明在含有臭氧的气氛下,甲烷催化反应速率加快,不同的是反应温度在100~350 ℃区间内2 123 cm-1处出现了微弱的CO吸附峰,意味着臭氧与甲烷存在不完全氧化反应,这与性能测试的结果相一致。
3 结论
a) Fe1/SSZ-13保留了H/SSZ-13分子筛较为完善的孔道结构,提高了催化剂比表面积(453.896 m2/g)和Lewis酸性位点;在原位红外中检测到臭氧的参与可以提高催化剂表面活性氧的数量并且增强了甲烷的吸附和氧化过程;
b) 通过XPS结果可知Fe1/SSZ-13表面Fe原子具有最高的结合能,表明其电子云密度低,有利于电子从CH4转移到Fe3+;该样品表面存在较高浓度的化学吸附氧,意味着存在更多的氧空位,可以促进臭氧在催化剂表面分解为活性氧,加速氧化还原循环;
c) XRD,BET和UV-Vis结果表明,在Fe1/SSZ-13分子筛表面Fe分散均匀且孤立Fe3+占比高,而在高负载量的样品中由于交换位点有限导致Fe2O3颗粒的形成,且可能对甲烷臭氧化反应存在抑制作用。
