不同投饵率对黑鲷及其杂交子二代幼鱼影响差异
2023-04-25孙瑞健仇玉燕杨志强徐大凤肖李霞秦亚丽倪可雯周堂建陈淑吟
孙瑞健,仇玉燕,2,杨志强,徐大凤,肖李霞,秦亚丽,倪可雯,2,周堂建,2,陈淑吟*
(1.江苏省海洋水产研究所,江苏 南通 226007;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;3.江苏省淡水水产研究所,江苏 南京 210017;4.江苏省启东市渔业技术推广站,江苏 启东 226222)
黑鲷(Acanthopagrusschlegelii)是我国南北沿海均有分布的优质鲷科鱼类。利用生长较快的真鲷(Pagrusmajor)与黑鲷杂交获得的新种质,在养殖性能上较其亲本有明显的提升。其中,以黑鲷 (♀)×真鲷(♂)的杂交子一代为亲本培育获得的杂交子二代(暂定名为“杂交鲷”,HF2),相比黑鲷亲本(AS),有较为明显的生长优势[1-2]。
绿色高效的饲料投喂策略是当前鱼类养殖技术研究的重要内容。其中,投饵率指所投饲料量占鱼类体质量的百分数,是投喂策略中影响投喂效果的重要因素之一[3]。适宜的投饵率,不仅有助于鱼类的生长,也有利于养殖环境的营造及养殖效益的提高[4]。确定最适投饵率对鱼类的高效养殖有十分重要的意义[5]。不同养殖鱼种的最适投饵率有较大差异,如300~600 g大杂交鲟(Husodauricus♀×Acipenserschrenckii♂)的适宜投饵率为1.2%~1.6%,而在此基础上降低投饵率至0.8%,其增重率、特定生长率及肠道脂肪酶活性均显著降低[6];5~25 g细鳞鲑(Brachymystaxlenok)幼鱼的最适投饵率为3.0%~4.0%,当继续提高投饵率至5.0%后,其增重率、特定生长率及饲料转化率均显著降低[7];约15 g的红鳍东方鲀(Takifugurubripes)的最适投饵率为4.0%左右,当提高投饵率至8.0%~10%后,其成活率和饲料利用率[8]及糜蛋白酶活力[9]均显著降低;投喂水平为6.0%的1.15 g长吻(Leiocassislongirostris)幼鱼的消化酶活性分别显著高于投喂水平为2.0%和10%[10]。另外,投饵率也会影响养殖鱼种的生长及消化摄食等[11-14],如当投饵率从0.5%升高到2.5%时,18~54 g斑鳜(Sinipercascherzeri)幼鱼的增重率和特定生长率显著升高,而投饵率升至3.0%,其饲料效率显著降低[15];巴西小沙丁鱼(Sardinellabrasiliensis)的全鱼脂肪含量随摄食量的增加而显著增加,蛋白酶活性则显著降低[16];过低或过高的投饵率导致吉富罗非鱼(Oreochromisniloticus)饵料系数显著升高,特定生长率、cck1(饱食信号)基因表达量显著降低[17]。以上研究结果突显了在开展鱼类养殖时必须确定适宜投饵率的重要价值。而有关杂交鲷及黑鲷幼鱼在生长性能等方面的差异表现研究还未见报道。因此,本文通过分析不同投饵率下杂交鲷与黑鲷幼鱼的生长性能、体成分、消化酶活性及生长相关基因表达等差异表现,旨在为新种质建立科学的投喂技术与养殖管理策略,也为海水鱼类的新品种选育及养殖提供参考。
1 材料与方法
1.1 实验鱼来源及规格
实验鱼为江苏省海水增养殖技术及种苗中心繁育的健康幼鱼。杂交鲷幼鱼:体质量为(4.38±0.68)g,体长为(5.00±0.24)cm;黑鲷幼鱼:体质量为(4.83±0.66)g,体长为(5.19±0.26)cm。
1.2 实验设计
实验容器为0.75 m×0.50 m×0.40 m塑料框,水体体积约150 L。每3个塑料桶为1组,即每个实验组设3个重复,两种鱼放养密度均为30尾/桶;投饵率设置为2.5%、4.0%、5.5%及7.0%,即为4个组别;实验周期40 d。采用定制的粗蛋白≥40%的海水鱼配合饲料投喂,每日投喂2次(7:00、18:00),饲料粒径大小根据鱼体规格而调整;前期投喂定制海水鱼1#配合饲料,后期改为投喂定制海水鱼2#配合饲料;每次投喂约40 min后,回收并记录残饵量与死亡鱼尾数。
实验期间水质因子采用在线探头监测,水温22~29℃,pH 7.5~8.2,盐度29~30,氨氮浓度小于0.2 mg·L-1;24 h持续充气,水中溶解氧浓度大于8.0 mg·L-1;每天换水2次,日换水量超过50%。
正式实验前,将实验鱼先暂养适应1周,暂养期间各投喂管理与实验期一致。
1.3 样品采集与指标测定
养殖实验结束后,实验鱼停止投喂24 h,然后从每组3个平行中的桶里随机取10尾鱼进行体长、体质量测量,并开始采样。采样时,从每个桶里随机抽取3尾鱼,快速解剖,取肝脏、胃、肌肉等组织速冻于液氮中,之后转移到-80℃冰箱中冷冻保存。
1.3.1 生长指标测定
投喂实验结束后,根据杂交鲷及黑鲷的体长、末体质量(Final body weight,FBW),计算实验鱼的增重率(Weight gain rate,WGR)、特定生长率(Special growth rate,SGR)及肥满度(Condition fact,CF);解剖后,称取肝脏重、内脏重,计算肝体指数(Hepatosomatic index,HSI)、脏体指数(Viscera somatic index,VSI);65℃烘干每次投喂结束后回收的残饵,并称重,以计算饵料系数(Feed conversion ratio,FCR);清算每个实验组的存活鱼尾数,计算成活率(Survival rate,SR);以体质量样本标准差和样本平均数之比,计算体质量变异系数(Coefficient of variation,CV)。
WGR(%)=100×(Wt-W0)/W0
(1)
SGR(%·d-1)=100×(lnWt-lnW0)/t
(2)
HSI(%)=100×Wh/Wt
(3)
VSI(%)=100×Wv/Wt
(4)
CF(%)=100×Wt/L3
(5)
SR(%)=100×Nt/N0
(6)
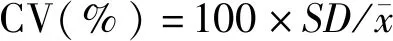
(7)
FCR=Fi/(Wt-W0)
(8)

1.3.2 消化酶活力测定
取胃、肝脏组织测定消化酶活力。胃蛋白酶(Pepsin)、脂肪酶(Lipase,LPS)、α-淀粉酶(α-Amylase,α-AMS)活力均采用南京建成生物工程研究所提供的试剂盒进行测定,测定方法参照说明书。
1.3.3 基因表达量测定
取肝脏组织,用于测定相关基因表达量。使用Trizol法提取杂交鲷及黑鲷肝脏组织总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa,#RR047A)逆转录试剂盒合成cDNA,并置于-20℃保存待用。
根据黑鲷基因组中的相关基因序列,应用Primer 5.0软件设计特异性引物。所有引物均由上海生工生物工程股份有限公司合成,序列见表1。采用SYBR Green荧光嵌合法,利用BIO-RAD CFX ConnectTM荧光定量 PCR 检测系统,进行实时荧光定量PCR扩增反应,反应程序为95℃预变性3 min;循环条件:95℃变性10 s、55℃退火20 s、72℃延伸20 s、75℃最后延伸5 s,共进行40个循环。反应完成后绘制熔解曲线,熔解反应条件为65~95℃、升温速度0.5℃/5 s。选取actin作为内参基因,对各组织样本进行标准化,采用2-ΔΔCt法进行计算基因相对表达量。

表1 实时定量PCR引物Tab.1 Gene-specific real-time quantitative PCR primers
1.4 数据统计与分析
实验数据分析应用Excel 2019和SPSS 22统计软件,采用平均值±标准误(Mean±SE)表示。当差异显著(P<0.05)时,采用Duncan法进行组间差异的多重比较。
2 结果与分析
2.1 杂交鲷及黑鲷的生长性能
杂交鲷及黑鲷的生长性能指标检测结果见表2。随着投饵率的升高,两种实验鱼的FBW、WGR、SGR、CF等均呈现先显著升高后显著降低的趋势(P<0.05),当投饵率为4.0%时,上述指标显著高于其他投喂组(P<0.05)。两种实验鱼的HSI和SR在投饵率低于5.5%时无显著变化(P>0.05),而在投饵率升高至7.0%时,显著降低(P<0.05)。投饵率对两种实验鱼的VSI、CV及FCR无显著影响(P>0.05)。从测试结果得出,对于杂交鲷、黑鲷,4.0%投饵率均可取得最好的养殖效果。两种实验鱼相比,杂交鲷在全部组别中的WGR和SGR均高于黑鲷,且在2.5%、4.0%、5.5%这3组尤为显著(P<0.05)。杂交鲷的FCR也有优于黑鲷的表现,4.0%组和5.5%组杂交鲷的FCR分别较黑鲷低23.3%和37.9%,即杂交鲷的饲料转化率高于黑鲷。

表2 不同投饵率下杂交鲷及黑鲷生长性能的变化差异Tab.2 Differences of growth performance of the hybrid porgy of A.schlegelii♀ × P.major ♂ and A.schlegeliiin different feeding rates
2.2 杂交鲷及黑鲷消化酶的变化差异
由消化酶检测结果(图1)可知,随着投饵率的升高,两种实验鱼的胃蛋白酶活力显著降低(P<0.05),2.5%组的胃蛋白酶活力显著高于7.0%组(P<0.05);脂肪酶活力先降低后保持不变,4.0%组的脂肪酶活力显著低于2.5%(P<0.05),但与其他2组无显著差异(P>0.05);投饵率对两种实验鱼的α-淀粉酶活力无显著影响(P>0.05)。此外,4.0%组和5.5%组杂交鲷的胃蛋白酶活力显著高于黑鲷(P<0.05)。
2.3 杂交鲷及黑鲷ghr和igf1基因表达量的变化差异
不同投饵率对两种实验鱼的肝脏ghr和igf1基因表达水平有不同程度的影响(图2)。随着投饵率的升高,杂交鲷的ghr基因表达量呈先降低后升高的趋势,2.5%组显著高于4.0%组(P<0.05),但与其他2组无显著差异(P>0.05);黑鲷的变化趋势与杂交鲷相似,其中2.5%组显著高于5.5%组(P<0.05)。两种实验鱼的igf1基因表达量呈先升高后降低的趋势,4.0%组显著高于2.5%组和7.0%组(P<0.05),但5.5%组无显著差异(P>0.05)。此外,4.0%组杂交鲷的ghr基因表达量显著低于黑鲷(P<0.05),4.0%组和5.5%组的igf1基因表达量显著高于黑鲷。

注:柱形图上方无字母或相同字母表示差异不显著(P>0.05);不同小写字母表示实验组间有差异性显著(P<0.05);不同大写字母表示实验组内种间有差异性显著(P<0.05)。以下同此。Notes:No letters or the same letters above the column chart indicated that there was no significant difference (P>0.05),but different small letters meant significant differences between the experimental groups (P<0.05),and different capital letters meant significant differences among the species within the experimental groups (P<0.05).The same case in the following figures.
3 讨论
3.1 生长与饲养效果分析
WGR、SGR、CF等指标可以直观反映养殖鱼类的生长效果[18]。FCR是反映饲料利用率的负相关指标[19]。本实验中,随着投饵率的升高,杂交鲷及黑鲷的FBW、WGR、SGR、CF等先显著升高(4.0%组)后显著降低(5.5%~7.0%组),与此相反,FCR先降低后升高,SR在7.0%组显著降低。这说明在适宜的范围内增加投饵率,鱼体的WGR和SGR显著升高,但过高的投饵率反而不利于鱼体的生长。结合养殖实验过程,当投饵率为2.5%时,实验鱼抢食严重,死亡鱼数明显多于投饵率为4.0%组和5.5%组;当投饵率为4.0%时,实验鱼无激烈抢食,无残饵;投饵率为5.5%的实验组残饵量相较7.0%组的少,死亡鱼数略多于4.0%组;当投饵率为7.0%时,实验鱼在每次喂食过后,均存在大量残饵,且死亡鱼数量最多。这表明,在2.5%投饵率下,较低的营养摄入不足以维持鱼体的生长所需,各项生长指标均处在较低的水平;投饵率提高至4.0%后,机体摄入的营养在维持生命活动的同时还可以作为能量积累储存下来,故WGR、SGR、CF等指标均显著升高;再继续提高投饵率后,过大的胃肠负荷影响了食物中营养的充分吸收,抑制了鱼的生长;同时也造成了饲料浪费、水质污染,进而影响了养殖鱼种的存活[20]。不过,可能由于鱼类摄食习性的不同,杂交鲟(A.schrenckii♀ ×A.baeri♂)[21]和罗非鱼(Oreochromismossambicus)[22]的WGR和SGR随投饵率升高呈持续升高的趋势,而大杂交鲟[6]、施氏鲟(A.schrenckii)[23]、巨骨舌鱼(Arapaimagigas)[24]的WGR和SGR先显著升高后保持不变。HSI、VSI可以衡量鱼体能量状态[25]。实验结果表明,低于5.5%的投饵率对两种实验鱼的HSI无显著影响,继续提高投饵率至7.0%后,HSI显著降低。这表明超过一定的限度后,继续提高投饵率,鱼体的营养和能量积累并不会随之增加,甚至还会产生负面的影响。另外,投饵率对两种实验鱼的VSI、CV均无显著影响。综合上述生长指标结果,在每天2次的投喂频率下,杂交鲷和黑鲷幼鱼的生长最适投饵率为其体质量的4.0%。
前期研究中,杂交鲷在每天1~4次的投喂频率下均有优于黑鲷的生长效果[26],而在本实验的4个投饵率组别中,杂交鲷的FBW、WGR、SGR亦有优于黑鲷的表现,其中投饵率为2.5%的杂交鲷的WGR和SGR分别较黑鲷高21%和11%以上,投饵率为4.0%的分别较黑鲷高31%和14%以上,投饵率为5.5%的分别较黑鲷高49%和24%以上,投饵率为7.0%的分别较黑鲷高4.5%和3.0%左右。这些结果进一步说明了,杂交鲷具有比亲本黑鲷更好的生长优势,而FCR的结果则可以反映出杂交鲷的饵料利用率相对更高,具有更好的品种经济优势。
3.2 消化酶结果分析
消化酶显著影响着鱼体吸收和利用营养物质[16]。实验发现,随着投饵率的升高,杂交鲷及黑鲷的胃蛋白酶活力显著降低,脂肪酶活力先在4.0%组显著降低后维持平衡。这可能是因为在一定程度上,鱼类消化酶活力受饱食程度的影响[27]。在投饵率较低时,机体通过升高消化酶活力来充分分解食物中的大分子物质如脂类、蛋白质等,为鱼体快速供能;加大饲料投喂量后,鱼体的消化能力只需维持在正常甚至是较低的水平,就可以满足生长代谢所需。也有研究推测,这可能是因为高投喂水平下鱼体肠胃负担过重,机体的消化吸收能力下降,从而导致消化酶活力降低[28]。对长吻[10]、施氏鲟[23]等幼鱼的研究也得到了类似的结果。不同的是,大杂交鲟[4]、乌苏里拟鲿[14]等的胃蛋白酶活性随着投饵率的升高而升高,推测可能是因为在饲料蛋白质的摄入量增加后,其刺激了蛋白酶的分泌。淀粉酶主要水解食物中的淀粉及糖原等贮存多糖,两种实验鱼的淀粉酶活性较低,且不受投饵率的显著影响,这可能与杂食性鱼类对糖类的利用能力较差有关[29]。由以上结果得出,在每天投喂2次的条件下,4.0%的投饵率完全可以满足实验鱼的生长代谢所需。另外,在4.0%~5.5%的投饵率下,杂交鲷的胃蛋白酶活性显著高于黑鲷,结合两种实验鱼的生长性能及饲料利用率结果,进一步证明了杂交鲷对食物的消化吸收能力更强[28]。
3.3 基因表达水平分析
igf1基因的表达受鱼类营养状况的影响[30]。两种实验鱼的igf1基因表达量均呈先升高后降低的趋势,4.0%组显著高于2.5%组和7.0%组,但与5.5%组无显著差异。结合生长性能的相关检测结果分析,当投饵率为4.0%时,杂交鲷的WGR分别比投饵率为2.5%和7.0%时高出57%、141%,SGR分别高出26%和61%;当投饵率为4.0%时,黑鲷的WGR分别比投饵率为2.5%和7.0%时高出44%和91%,SGR分别高出22%和45%。这说明在过低或过高的投饵率下,igf1基因表达均会受到显著的负面影响,鱼体的生长代谢因而受到抑制。
ghr基因是检验鱼类生长性能和生理状态的重要指标[31]。随着投饵率降低,两种实验鱼的ghr基因表达量呈先降低后升高的趋势。这可能是因为在投喂水平过低或过高时,鱼体均会通过上调生长激素及其受体的表达水平来减小营养不足或过剩给生长带来的影响[32]。此外,随着投饵率的升高,两种实验鱼的ghr与igf1基因表达量的变化趋势相反,其中igf1与SGR呈正相关,ghr与SGR呈负相关,该结果与前期研究结果一致[26],同时也证实了杂交鲷有更优于黑鲷的生长效果。
