高考化学模拟试题参考答案
2023-04-25
1.B 提示:棉花、麻来源于植物,主要成分均是纤维素,为碳水化合物,但蚕丝来源于动物,主要成分是蛋白质,蛋白质不是碳水化合物,A 项错误。食品添加剂加入食品中的目的是为了改善食品品质和色、香、味以及为防腐、保鲜和加工工艺的需要,所以合理使用有助于改善食品品质、丰富食品营养成分,不应降低食品本身营养价值,B 项正确。石油经过减压分馏得到石蜡等馏分,是物理变化,C项错误。维生素C 具有还原性,可以还原活性氧自由基,D 项错误。
2.D 提示:化合物1 分子中甲基上的H 原子不可能完全共平面,A 项错误。化合物1与化合物2互为同分异构体,B 项错误。化合物2分子中含有羧基、羟基和羰基(或酮基),C项错误。化合物2可以与氯化铁溶液发生显色反应,D 项正确。
3.D 提示:无色溶液中一定不含Fe3+和。①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,因为过氧化钠和水反应生成氢氧化钠和氧气,所以无色无味的气体是O2,一定不是NH3,则一定没有,再加入足量的NaOH 溶液后白色沉淀部分溶解,沉淀的成分应该是氢氧化铝和氢氧化镁,则溶液中一定含有Al3+、Mg2+,一定不含。②另取部分溶液,加入稀硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生,则一定含有。综上分析,溶液中一定含有,一定不含不确定是否含有K+和Cl-。
4.C 提示:饱和Na2CO3溶液和饱和NaHCO3溶液的浓度不同,不能比较水解程度,A 项错误。根据反应2Fe2++I2可知,未告知溶液的体积,将等浓度的KI溶液和FeCl3溶液混合,不确定哪个反应物过量,若FeCl3过量,充分反应后滴入KSCN 溶液,溶液变红,则不能探究Fe3+与I-的反应是可逆反应;若KI过量,则可以探究Fe3+与I-的反应是可逆反应,B 项错误。高锰酸钾有强氧化性,向酸性高锰酸钾溶液中加入维生素C,溶液褪色,说明维生素C 有还原性,C 项正确。由得失电子数目守恒可知,2 mL 1 mol·L-1的酸性高锰酸钾溶液完全反应消耗草酸的物质的量为,两种不同浓度的草酸溶液中草酸的物质的量分别为0.002 mol、0.001 mol,均不能使酸性高锰酸钾溶液完全反应,则不能通过观察溶液褪色所需时间探究草酸浓度对反应速率的影响,D 项错误。
5.D 提示:X、Y、Z 为三种短周期主族元素,且原子序数依次增大,且加和为15,Y6X6是一种常见有机溶剂,可判定:X 为H元素,Y 为C元素,Z为O 元素。碳元素的单质如金刚石、石墨等常温下为固态,A 项错误。C与H 形成的化合物种类较多,常温下有气态、液态和固态,O 与H 形成的化合物有H2O 和H2O2,无法比较沸点的大小,B 项错误。由图示信息可知,250 ℃时,减少的质量为462g×(1-80.5%)=90g,n(H2O)=5 mol,即此过程中晶体失去5 个结晶水,故此时晶体的主要成分是Sc2(C2O4)3·H2O,C项错误。850 ℃时,462g×29.8%=138g,138g-2 mol×45g·mol-1=48g,n(O)=3 mol,晶体的化学式为Sc2O3,D项正确。
6.C 提示:第一步阴极反应式为O2+,阴极区溶液的pH 变大,A 项正确。根据图示,第二步中正极反应为Na0.44MnO2,B项正确。第三步中,阴极反应式为,C 项错误。理论上,每消耗1 mol O2,转移4 mol电子,第一步生成4 mol NaOH;根据钠元素守恒,第二步提取 4 mol NaCl,第三步生成2 mol Cl2,D 项正确。
7.D 提示:根据图像分析,随着pH 的增大,溶液的碱性增强,的浓度都逐渐增大,-lg[c(X)]均减小,随着浓度增大,逐渐生成CaCO3沉淀,溶液中Ca2+逐渐减小,-lg[c(X)]逐渐增大,由于碳酸分步电离,第一步电离产生,第二步电离时产生,且以第一步电离为主,则起始时的浓度大于,因此曲线Ⅲ代表-lg[c(Ca2+)]与pH 的关系,曲线Ⅱ为与pH 的关系,曲线Ⅰ为与pH 的关系。由上述分析可知,曲线Ⅰ为与pH 的关系,选项A 正确。由图可知,c点时,此时H2CO3的二级电离常数Ka2=10-10.2,数量级为10-11,选项B 正确。经过a点作一条垂直于pH 轴的直线,曲线Ⅱ在最上面,曲线Ⅲ在最下面,因此a(6.2,5)点的水体中:c(H+)=10-6.2,选项C 正确。Ksp(CaCO3),向水体中加入适量Ca(OH)2固体,减小,c(Ca2+)增大,不能使溶液由b 点变到c点,选项D 错误。
8.(1)FeSO4、Fe2(SO4)3、Al2(SO4)3(2分) (2)Na2ZrF6+Na4SiO4+6H2O[或ZrSiO4+(2分) (3)A、D(2 分) (4)4∶1(2 分)(2 分)(5)静置,取上层清液少许于试管中,滴加KSCN 溶液,溶液不变红,说明Fe3+已沉淀完全(2分) 5.77 (2分)
提示:(1)ZrSiO4与硫酸不反应,Fe3O4和Al2O3分别与硫酸反应生成FeSO4、Fe2(SO4)3、Al2(SO4)3。
(2)反应物ZrSiO4、NaOH 和HF,熔融时得到产物为Na2ZrF6、Na4SiO4和H2O。
(3)“一系列操作”,由Na2ZrF6转化为K2ZrF6,需要引入K+,Na2ZrF6、K2ZrF6均易溶于水,而K2ZrF6不溶于氨水,需要加入氨水使K2ZrF6沉淀。
(5)将悬浊液静置,取上层清液少许于试管中,滴加KSCN 溶液,溶液不变红,说明Fe3+已沉淀完全;溶液中的铝元素恰好完全转化为沉淀的反应为Al(OH)3+OH-,K=10-0.63,则该反应的平衡常数为,由实验测得滤液②的pH=7.60,溶液中c(OH-)=10-6.4,则。
10.(1)-193.8(2分) C2H4(g)+H2(g)(2分)(2)①Cat2(1分) 未达到(2分) ②催化剂的活性降低(1 分) (3)<(2 分) 0.8(2分) (4)先变大后变小(1 分) 反应开始时,C2H2浓度最大,C2H4浓度最小,此时生成乙烯速率快,浓度变大;随着反应进行,C2H2浓度变小,C2H4浓度变大,副反应速率变大,乙烯的浓度又会减小(2分)
提示:(1)反应的焓变ΔH=反应物的总键能-生成物的总键能,由化学方程式和键能数据可知,ΔH1=(812+2×413.4+436-4 × 413.4 - 615) kJ · mol-1=-193.8 kJ·mol-1;C2H2(g)、H2(g)、C2H6(g) 的 燃 烧 热 ΔH分 别 为-1 299.6 kJ·mol-1、-285.8 kJ·mol-1、-1 559.8 kJ·mol-1,则有:③C2H2(g)+-1 299.6 kJ·mol-1;④H2O(l) ΔH4=-285.8 kJ·mol-1;⑤C2H6(g)-1 559.8 kJ·mol-1;③+④×2-⑤得副反应:(-1 299.6-285.8×2+1 559.8) kJ·mol-1=-311.4 kJ·mol-1,副反应- 主反应得:(-311.4 kJ·mol-1)- (-193.8 kJ·mol-1)=-117.6 kJ·mol-1。
(2)①由图可知,温度相同、时间相同时Cat2做催化剂,C2H2的转化率更高,故Cat2的催化效率较高;催化剂改变反应速率,不改变平衡时物质的转化率,由图可知,b点时使用Cat2做催化剂C2H2的转化率高于b点,说明b点未达到平衡。②温度高于300 ℃,升高温度,b→c段C2H2的转化率降低,原因可能是催化剂的活性降低导致。

由图可知,在T0K、20 kPa下C2H2的平衡转化率为90%,则;在TK、20 kPa下CH 的选择性等于024,则;解得x=0.8 mol,y=0.1 mol;平衡时C2H2(g)、C2H6(g)、C2H4(g)、H2(g)的物质的量分别为0.1 mol、0.1 mol、0.8 mol、1.0 mol,总的物质的量为2.0 mol,则T0K 下,主反应的平衡常数Kp=。
(4)推测乙烯的浓度随时间的变化趋势为先变大后变小。反应开始时C2H2浓度最大,C2H4浓度最小,由乙烯的净生成速率方程可知,此时生成乙烯速率快,浓度变大;随着反应进行,C2H2浓度变小,C2H4浓度变大,副反应速率变大,乙烯的浓度又会减小。
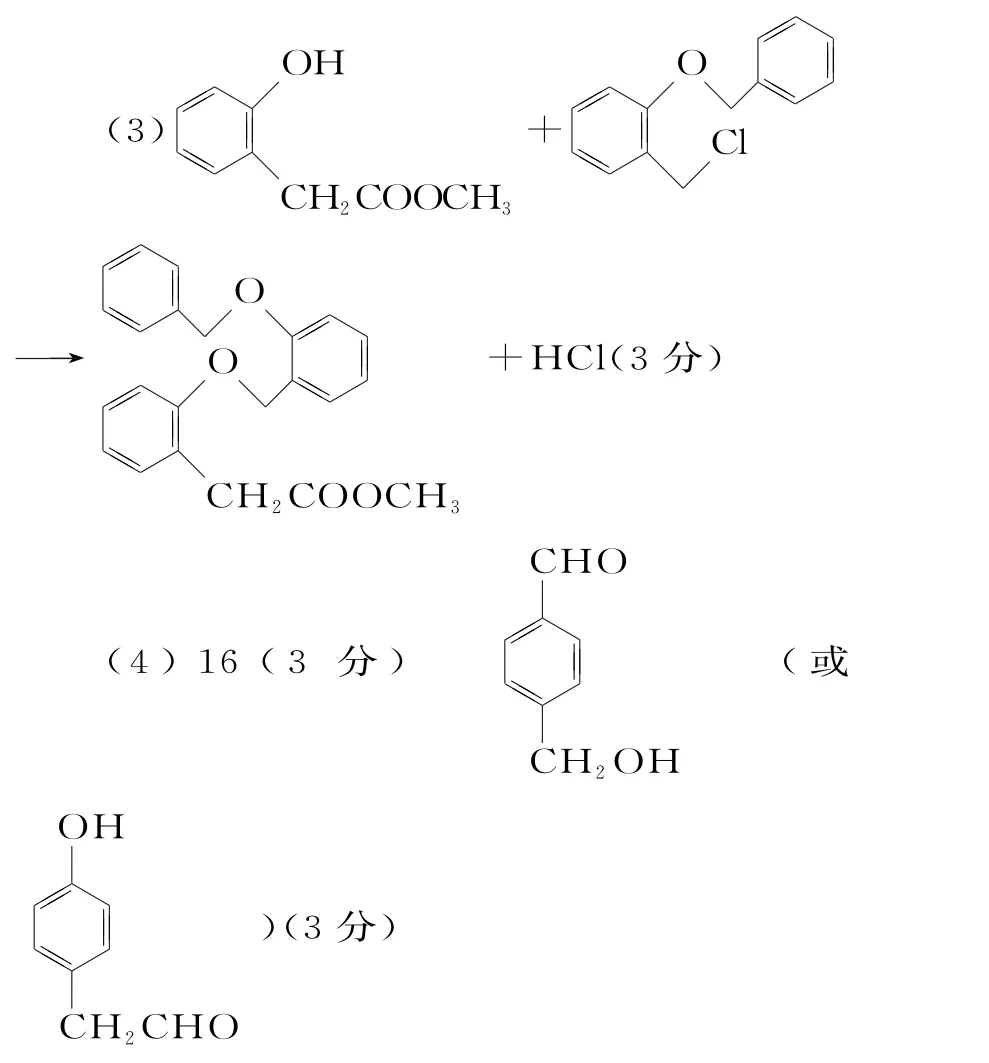
12.(15分)(1)1-氯甲苯(1 分) 醚键、醛基(2分)
取代反应(或酯化反应)(1分)
(2)2(2分)