思维模型在含氮化合物相关计算中的应用
2023-04-25安徽省蒙城第一中学
■安徽省蒙城第一中学 郝 丹
■安徽省合肥市第六中学 马善恒
氮及其化合物是高中化学的重要内容,是元素化合物的重要组成部分,也是高考的热点。氮及其化合物知识的计算考点较多,部分考生在解决这些问题的时候会感到困惑、迷茫,不知从何做起。现结合具体实例进行总结归纳,在含氮物质计算过程中建立思维模型,助力问题解决。
一、氮的氧化物与O2、H2O 反应的计算
氮的氧化物有很多,如N2O、NO、N2O3、NO2、N2O4、N2O5,教材中重点介绍了NO、NO2的性质,如无色的NO 气体在空气中变为红棕色的NO2气体,涉及反应2NO+;以及NO2溶于水,涉及反应。基于该性质的气体体积计算问题的考查是常见题目类型,将两个方程式进行变换得到总反应方程式和4NO2+是解决问题的关键。
例1将装有30 mL NO 和O2混合气体的试管倒立在盛水的水槽中,直到水面不再上升为止,此时试管内剩余气体的体积为16 mL(同温同压下),则原混合气体中NO的体积为( )。
①8 mL ②24 mL ③16 mL ④9 mL
A.①② B.②③
C.①④ D.③④
解析:首先分析剩余气体成分,由总反应知NO 与O2按4∶3的体积比反应,假设剩余气体为O2,则,如果剩余的气体为NO,则16mL=24mL。下),则原混合气体中氧气体积为( )。
①1.2 mL ②2.4 mL ③3 mL ④4 mL
A.①② B.②③
C.①④ D.③④
解析:首先分析剩余气体成分,由总反应知NO2与O2按4∶1 的体积比反应,假设剩余气体为O2,则4 mL,如果剩余的气体为NO,则由3NO2+3=6 mL,那么总反应中参与反应的NO2和O2的总体积为12 mL-6 mL=6 mL,则。
答案:C
思维模型:(1)明确NO、NO2与O2混合气体溶于水的计算,最后剩余气体不会是NO2,要么是NO,要么是O2。
(2)借助氮氧化物与O2、H2O 的总反应方程式即和利用差量法求气体的体积。
如果是NO、NO2和O2三种混合气体通入水中,则先依据+NO 计算生成NO 的体积,然后加上原来气体中NO 的体积,再依据4NO+3O2+计算。
例3将盛有12 mL NO 和36 mL NO2混合气体的烧瓶倒置于水中,通入一定量O2,完全反应后,剩余气体体积为4 mL,则充入O2的体积可能为( )。
A.19 mL B.20 mL C.21 mL D.22 mL
解析:由反应知生成的NO 体积为
答案:A
例2在一定条件下,将12 mL NO2(不考虑N2O4)和O2的混合气体通入足量水中,充分反应后剩余2 mL 气体(同温同压12 mL,加上原来NO 体积得V(NO)=12 mL+12 mL=24 mL,再由4NO+3O2+求算充入O2体积,先假设剩余气体为O2,则NO 反应完,V(O2)=,再假设剩余气体为NO,则反应的NO 体积为24 mL-4 mL=20 mL,所以15 mL。
答案:D
二、喷泉实验产物浓度的计算
喷泉实验是高中化学中一个非常美丽的实验,美丽的实验后溶液浓度的求算也是一大难点,因为这类题目中通常没有可直接利用的数据,导致无从下手。将烧瓶看成一个整体,给烧瓶内气体设定体积是突破口,再依据反应找出溶质物质的量和溶液体积,问题便迎刃而解。
例4用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)( )。
A.0.045 mol·L-1B.1 mol·L-1
C.0.029 mol·L-1D.不能确定
解析:氨气溶于水形成氨水,其溶质为氨气。设烧瓶的容积为VL,则形成溶液的体积为VL,溶质的物质的量为,故所得溶液的物质的量浓度为。
答案:A
例5用如图1所示的装置做喷泉实验,该实验条件下的气体摩尔体积为aL·mol-1,最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )。

图1
解析:由4NO2+O2+2H2O ==4HNO3可知,若液体充满烧瓶,NO2、O2的体积比为4∶1,设混合气体中含有4 L NO2、1 L O2,则烧瓶的体积为5 L,则。
答案:C
思维模型:(1)根据化学反应和条件确定溶质的物质的量和溶液的体积。
三、金属单质与硝酸反应的计算
硝酸重要的化学性质之一便是强氧化性,由金属与硝酸反应而呈现的计算题较多,如果考生根据题目意思写出一步步反应再去解决问题,将会使问题复杂化,准确率低,效率低。基于这样的思考,我们通过例题建立金属与硝酸反应的思维导图,找出氮原子的转化过程,通过图示利用守恒法快速解决问题。
例6足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO 的混合气体2.24 L(标准状况),这些气体与一定体积的O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入50 mL 4 mol·L-1NaOH 溶液,则Cu2+恰好完全沉淀。下列说法正确的是( )。
A.此反应过程中消耗的铜的质量是12.8g
B.混合气体中NO2的体积分数是50%
C.参加反应的HNO3的物质的量是0.4 mol
D.消耗氧气(标准状况)的体积为1.68 L
解析:,则消耗的铜的质量为m=nM=0.1 mol×64g·mol-1=6.4g,故A 项错误。设NO2、NO 物质的量分别为xmol、ymol,结合转移电子守恒得①x+y=0.1,②x+3y=0.1×2,联立两式,解得x=0.05,y=0.05,则混合气体中NO2的体积分数是,故B项正确。Cu 足量,则硝酸完全反应,反应后的溶液中溶质为Cu(NO3)2,Cu(NO3)2和NaOH 反应后的溶液中溶质为NaNO3,根据N 原子守恒知,起酸性作用的n(HNO3)=n(NaNO3)=n(NaOH)=0.2 mol,作氧化剂的,参加反应的酸为生成硝酸铜和氮氧化物的硝酸,则参加反应的n(HNO3)=(0.2+0.1) mol=0.3 mol,故C项错误。该反应中转移电子物质的量=2×n(Cu)=2×0.1 mol=0.2 mol,根据转移电子数相等知,消耗氧气体积=22.4 L·mol-1=1.12 L,故D 项错误。
答案:B
思维模型:HNO3中氮原子的转化过程,巧用两守恒解决问题。

(1)根据Na原子、N 原子和金属原子守恒可求起酸性作用或参加反应的硝酸的量。
(2)根据得失电子守恒:Cu 失电子数=NOx得电子数=O2得电子数,可求NO、NO2、参与反应的Cu以及消耗O2的量。
变式:一定质量的铜与浓硝酸恰好完全反应,生成NO2、N2O4、NO 的混合气体,这些气体与2.24 L O2(标准状况下)混合后通入水中,所有气体被水完全吸收生成硝酸。则参加反应的铜的质量为( )。
A.3.2g B.6.4g
C.12.8gD.条件不足,无法计算
答案:C
如果遇到金属投入到混合酸(如H2SO4和HNO3)或硝酸盐与酸混合物中(如KNO3和H2SO4),将采用金属与的离子反应方程式解决问题。
例7某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol 铁粉,充分反应(已知被还原为NO),最终溶液体积为1 L。下列说法正确的是( )。
C.反应后生成NO 的体积为33.6 L(标准状况下)
D.所得溶液中的溶质只有FeSO4
解析:从比例关系来看,只有H+完全反应。
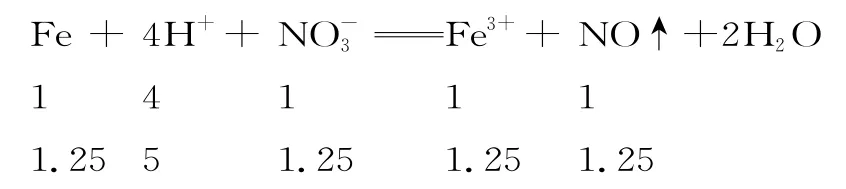
铁粉剩余1.5 mol-1.25 mol=0.25 mol,硝酸根离子剩余4 mol-1.25 mol=2.75 mol,所得溶液中,故A 项正确。n(Fe3+)=1.25 mol,剩余n(Fe)=0.25 mol,从比例关系来看,铁粉完全反应。
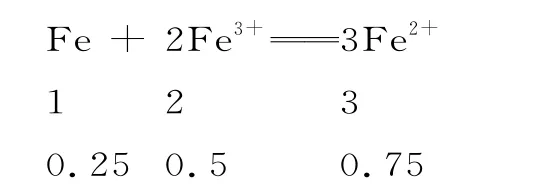
铁离子剩余:1.25 mol-0.5 mol=0.75 mol,生成n(Fe2+)=0.75 mol,所得溶液中c(Fe2+)∶c(Fe3+)=0.75∶0.75=1∶1,故B项错误。反应后生成NO 的体积为V(NO)=n(NO)×Vm=1.25 mol×22.4 L·mol-1=28 L(标准状况下),故C 项错误。反应所得溶液中阳离子为铁离子、亚铁离子和钾离子,阴离子为硫酸根离子和硝酸根离子,故D 项错误。
答案:A
高中化学复习中要注重思维模型的建立,这样解题时可以很快从题目中寻找到重要信息,解决问题的思路更加清晰,从而提高解题效率,而且能通过思维模型的建立解决这一类问题。
