三唑酮及其代谢产物三唑醇在橡胶树植株中的迁移富集行为
2023-04-18卢泓玮邱煜荣张善英任赛豪梁晓宇
卢泓玮, 邱煜荣, 张善英, 任赛豪, 张 宇, 王 萌, 梁晓宇*,
(1.海南大学 植物保护学院,海口 570228;2.海南大学 食品科学与工程学院,海口 570228)
橡胶树Hevea brasiliensis作为一种特种经济作物,其产出的天然橡胶是我国重要的战略物资和工业原料[1]。近年来,橡胶树白粉病大爆发时有发生,导致橡胶树大面积落叶,胶乳产量大幅下降,严重阻碍了我国天然橡胶产业的健康发展。因橡胶树体型高大、冠层茂密,在橡胶树白粉病的化学防治过程中存在施药困难、防治效率低等问题。现阶段通常采用高扬程喷粉机喷施粉剂和热力喷雾机喷送热雾剂两种施药方式进行防治[2],这两种方式对施药时的气象环境有着较高的要求,容易造成防治不及时、药剂靶向沉积附着能力差等问题,在喷施时药剂大量飘散在空中,对周围环境及非靶标生物带来一定影响[3]。因此,明确农药在橡胶树中的迁移富集及代谢行为,探索高效便捷、环境友好的施药方式将成为橡胶树白粉病化学防控的新趋势。
三唑酮 (triadimefon) 是一种三唑类杀菌剂,因其杀菌谱广,且具有良好的内吸性,自上市以来广泛用于防治水果、蔬菜、小麦等农作物上的白粉病、锈病等真菌性病害[4-5]。三唑酮对橡胶树白粉菌有良好的生物活性 ,在20 世纪80 年代开始使用热雾机喷撒三唑酮,以防止橡胶树白粉病爆发[6]。三唑酮在我国已登记使用多年,研究人员根据其在作物上的迁移富集行为并结合实际防治需求,开发出了如种子处理剂、水分散粒剂、烟雾剂、热雾剂等多种剂型[7-8],不仅丰富了防治手段,还大幅提升了防治效果。研究表明,三唑酮的羰基可在小麦、烟草、黄瓜等作物体内被还原成羟基,继而生成三唑醇 (triadimenol)[9-11]。由于三唑醇抑菌活性良好,其也被作为一种单独的药剂在多种作物上登记使用。三唑酮在橡胶树上已应用多年,但有关其在橡胶树植株中的代谢行为尚未见研究报道。
农药在作物中的迁移富集行为是农药学领域的重点研究内容之一,其研究方法主要包括残留分析法、放射性示踪法、生物测定法、荧光示踪法和质谱成像法等[12]。残留分析法可以准确检测植株各组织中农药及其代谢产物的含量,已有大量研究者通过QuEChERS 提取方法与分析仪器结合的方式探索了农药在小麦、水稻和玉米等大宗作物中的迁移富集行为[13-15],并根据这些研究开发出了相应的施药策略,显著提高了农药的靶标利用率[16-17]。当前,开发针对橡胶树的高效施药方式还处于起步阶段,农药在橡胶树等高大乔木中的迁移富集行为尚不明确。因此,本研究选用橡胶白粉病防治中常用的三唑酮作为研究药剂,探明植株通过根部及叶部吸收后药剂的迁移富集及代谢行为,旨在为开发适宜的施药方式提供技术指导,为高效防治橡胶树病害提供理论依据。
1 材料与方法
1.1 仪器、植物与试剂
Trace1300-TSQ 9000 气相色谱-串联质谱联用仪 (美国Thermo Fisher Scientific 公司)、T25 digital ULTRA-TURRAX®均质机 (德国IKA 公司)、BUCHI B-100 旋转蒸发仪 (瑞士BUCHI 公司) 和Milli-Q 超纯水器 (美国Millipore 公司)。
供试植物为“热研73397”组培苗和芽接苗购自海南天然橡胶新型种植材料创新基地。
97%三唑酮 (triadimefon) 标准品和97%三唑醇 (triadimenol) 标准品 (广州佳途科技股份有限公司);20%三唑酮乳油制剂 (triadimefon 20% EC,江苏建农农药化工有限公司)。乙腈和乙酸乙酯(色谱级,西陇科学股份有限公司);无水硫酸镁和氯化钠 (分析纯,国药集团化学试剂有限公司);十八烷基硅烷键合硅胶 (C18) 和石墨化碳黑 (GCB)(上海安谱实验科技股份有限公司)。
1.2 试验方法
1.2.1 样品前处理方法 橡胶树植株根、茎和叶样品处理方法:将植株样品剪碎,准确称取1 g(精确至0.01 g) 至50 mL 离心管中,加入10 mL乙腈均质1 min;加入1 g 氯化钠涡旋1 min 后,于5000 r/min 下离心5 min;取2 mL 上清液至5 mL 离心管中,分别加入200 mg 无水硫酸镁、50 mg C18和50 mg GCB (根样品中不加GCB),涡旋振荡1 min,于5000 r/min 下离心2 min;取净化后的上清液1 mL,旋转蒸发后用1 mL 乙酸乙酯定容,过0.22 μm 滤膜,待气相色谱-串联质谱(GC-MS/MS) 检测。
营养液样品处理方法:取营养液样品1 mL 置于10 mL 离心管中,加入4 mL 乙酸乙酯后涡旋2 min,加入1 g 氯化钠后继续涡旋1 min,于3000 r/min 下离心5 min。取1 mL 上清液过0.22 μm 滤膜,待GC-MS/MS 检测。
1.2.2 检测条件 色谱:TG-5ILMS 型毛细管色谱柱 (30 m × 0.25 mm × 0.25 μm);载气为氦气;恒流模式;柱流量1 mL/min;进样口温度250 ℃;进样体积1 μL;不分流进样;程序升温:初始温度为150 ℃,保持1 min,以40 ℃/min 升至230 ℃,保持1 min,以5 ℃/min 升至250 ℃,保持 1 min,再以30 ℃升至280 ℃,保持2 min。
质谱:电子轰击离子源 (EI) 电压70 eV;离子源温度300 ℃;传输线温度280 ℃;溶剂延迟时间3 min;质谱多反应监测 (MRM) 模式扫描;碰撞气为氩气。表1 为MRM 模式下,三唑酮及三唑醇的GC-MS/MS 参数。

表1 三唑酮和三唑醇的GC-MS/MS 参数Table 1 GC-MS/MS parameters of triadimefon and triadimenol
1.2.3 标准溶液配制及标准曲线绘制 分别准确称取0.01 g (精确至0.0001 g) 三唑酮和三唑醇的标准品,用乙酸乙酯溶解并定容于10 mL 容量瓶中,配制成质量浓度为1000 mg/L 的标准品溶液,使用时用乙酸乙酯稀释成标准工作溶液。所有标准工作溶液均于 -20 ℃保存,备用。用未处理的橡胶树植株按1.2.1 节提取方法得到的空白基质配制标准溶液,以目标物峰面积对质量浓度绘制标准曲线。
1.2.4 添加回收试验 分别准确称取0.05 g 三唑酮和三唑醇标准品,用乙腈溶解并共同定容于10 mL容量瓶中,配制成质量浓度为5000 mg/L 三唑酮和三唑醇混合标准品溶液,使用时进行相应稀释。取未经药剂处理的橡胶树植株根、茎和叶各1 g,分别加入0.1、1、500 mg/L 的三唑酮和三唑醇标准工作液100 μL,使其添加水平分别为0.01、0.1 和50 mg/kg;取未含药的空白营养液5 mL,分别加入0.5、5、2500 mg/L 的三唑酮和三唑醇标准工作液100 μL,使其添加水平与上述相同。按照
1.2.1 节的提取方法进行样品前处理后采用GC-MS/MS 检测,计算添加回收率和相对标准偏差 (RSD)。
1.2.5 水培条件下植株根部施药 将高约40~50 cm 的橡胶树组培苗从沙床转移至霍格兰营养液(营养液A、B、C 液的体积比为1∶1∶1,使用时混合,稀释100 倍后使用) 中培育,待幼苗出现生长点后,修剪叶片以增强植株均一性,继续培育约21 d 后将幼苗置于含有1、5、10、15、20 mg/kg三唑酮的霍格兰营养液中进行水培暴露试验。以有药无苗组作为对照。每个处理设置3 个重复。处理组和对照组均置于培养箱 (光周期L/D = 16 h/8 h,光照强度10 000 lx,温度25~28 ℃) 中培养,期间每日称重补充消耗的营养液。分别在暴露6、12、24、48、72、96、120、144、168、240 和360 h 时采集样品,用纯水反复冲洗根表面的残留药剂,经滤纸吸干后,置于-20 ℃冰箱保存待测。
1.2.6 土培条件下植株叶部施药 挑选长势相对均一、有上、中、下层叶片的橡胶树芽接苗,将配制的160 mg/L 三唑酮乳油用毛笔均匀地涂抹在芽接苗中层叶片正面。涂抹处理时用铝箔纸遮挡未处理部分,每处理3 个重复。在涂药后0 (涂药后2 h)、1、3、5、7、10 和15 d 分别取标记位、标记上位及标记下位的叶片,置于 -20 ℃冰箱保存待测。
1.3 数据处理与统计分析
三唑酮及其代谢产物三唑醇在橡胶树植株体内的迁移能力用转运因子 (translocation factors,TFs) 表示,根到茎的转运因子 (TF茎/根) 和茎到叶的转运因子 (TF叶/茎) 分别按(1)和(2)式计算。
橡胶树植株从营养液中吸收富集农药的能力用生物富集因子 (bioconcentration factors,BCFs)表示,根部生物富集因子 (root bioconcentration factors,RCF)、茎部生物富集因子 (stem bioconcentration factors,SCF) 和叶部生物富集因子 (leaf bioconcentration factors,LCF) 分别按(3)~(5)式计算。
(1)~(5)式中:C营养液为营养液中三唑酮和三唑醇质量浓度总和,mg/L;C根、C茎、C叶分别为植株根、茎和叶中三唑酮和三唑醇含量总和,mg/kg。
采用Excel 2019 进行数据处理,并用Origin 2022 软件作图。
2 结果与分析
2.1 分析方法确证
在0.001~5 mg/L 范围内,三唑酮和三唑醇在营养液的质量浓度及其在植株根、茎、叶中的含量与其峰面积间呈良好的线性关系,决定系数(R2) 均大于0.99 (表2)。

表2 三唑酮和三唑醇在营养液和橡胶树植株根、茎、叶中的线性方程与决定系数Table 2 Linear equations and coefficients ofdetermination of triadimefon and triadimenol in nutrientsolution and root, stem and leaf of rubber tree plants
在0.01、0.1 和50 mg/kg 3 个添加水平下的添加回收试验结果 (表3) 表明,三唑酮和三唑醇在营养液和橡胶树植株根、茎、叶中的回收率介于86%~107%之间,RSD 介于2.8%~11%之间,表明建立的方法适用于检测营养液和橡胶树植株中的三唑酮和三唑醇含量。采用添加回收试验中的最低添加水平作为定量限,三唑酮和三唑醇在营养液和橡胶树植株根、茎、叶中的方法定量限均为0.01 mg/kg。

表3 三唑酮和三唑醇在营养液和橡胶树植株根、茎、叶中的添加回收率和相对标准偏差Table 3 Recovery and relative standard deviations of triadimefon and triadimenol in nutrient solution and root,stem and leaf of rubber tree plants (n = 5)
2.2 根部施药条件下三唑酮及其代谢产物三唑醇的迁移富集行为
2.2.1 三唑酮及其代谢产物三唑醇在营养液和植株各部的含量变化 水培条件下植株对农药的暴露试验是研究农药在植株中内吸、传导和富集行为的有效方法之一[13-15]。本研究测定了水培条件下根部施用三唑酮后营养液和橡胶树植株中的药剂含量。当三唑酮水培添加质量浓度为10 mg/L时,植株营养液中大量的三唑酮代谢成三唑醇,168 h 时二者质量浓度达到一致,240 h 起营养液中三唑醇的含量大于三唑酮 (图1a)。由图1b 可以看出,施药6 h 后植株根部三唑酮含量迅速上升至33.67 mg/kg,三唑醇含量为3.06 mg/kg,72 h后根部对外源添加的药剂基本达到吸收平衡,168 h 时三唑酮与三唑醇含量相当,之后三唑醇含量均大于三唑酮。由图1c 看出,施药72 h 后茎部三唑醇含量即超过三唑酮,并随暴露时间的增加含量差不断增大。药剂从根部转运至叶部需要一定时间,48 h之前未检出2 种药剂,在120 h 时叶片检测出少量三唑酮,随着暴露时间增长其含量无明显增加;叶部三唑醇含量随着暴露时间增加而显著升高,360 h 时达到6.50 mg/kg (表4)。

图1 药剂在营养液 (a) 和橡胶树植株根部 (b)、茎部 (c) 中的含量变化 (n = 3)Fig.1 Concentration of pesticides in nutrient solution (a) and the roots (b) and stems (c) of rubber tree plants (n = 3)

表4 三唑酮和三唑醇在橡胶树植株叶片中的含量(mg/kg,n = 3)Table 4 Content of triadimefon and triadimenol in rubber tree leaves (mg/kg,n = 3)
另外,随着三唑酮处理浓度的升高,植株根部三唑酮含量占比也相应增加。当处理质量浓度为1 mg/L 时,三唑酮在根部的占比约为11.69%;当处理质量浓度为20 mg/L 时,占比约为39.85%(图2a)。随着暴露时间的增长,三唑醇在植株组织中的占比逐渐升高。这一现象在根部尤为明显,7 d 时三唑醇在根部的平均占比为73.89%,15 d 时约为91.54%。三唑醇含量占比在植株各组织间表现为叶部 > 茎部 > 根部,且叶部含量占比始终高于90%,表明了三唑酮在橡胶树植株中迁移和代谢同时进行,且三唑酮可快速代谢为三唑醇。
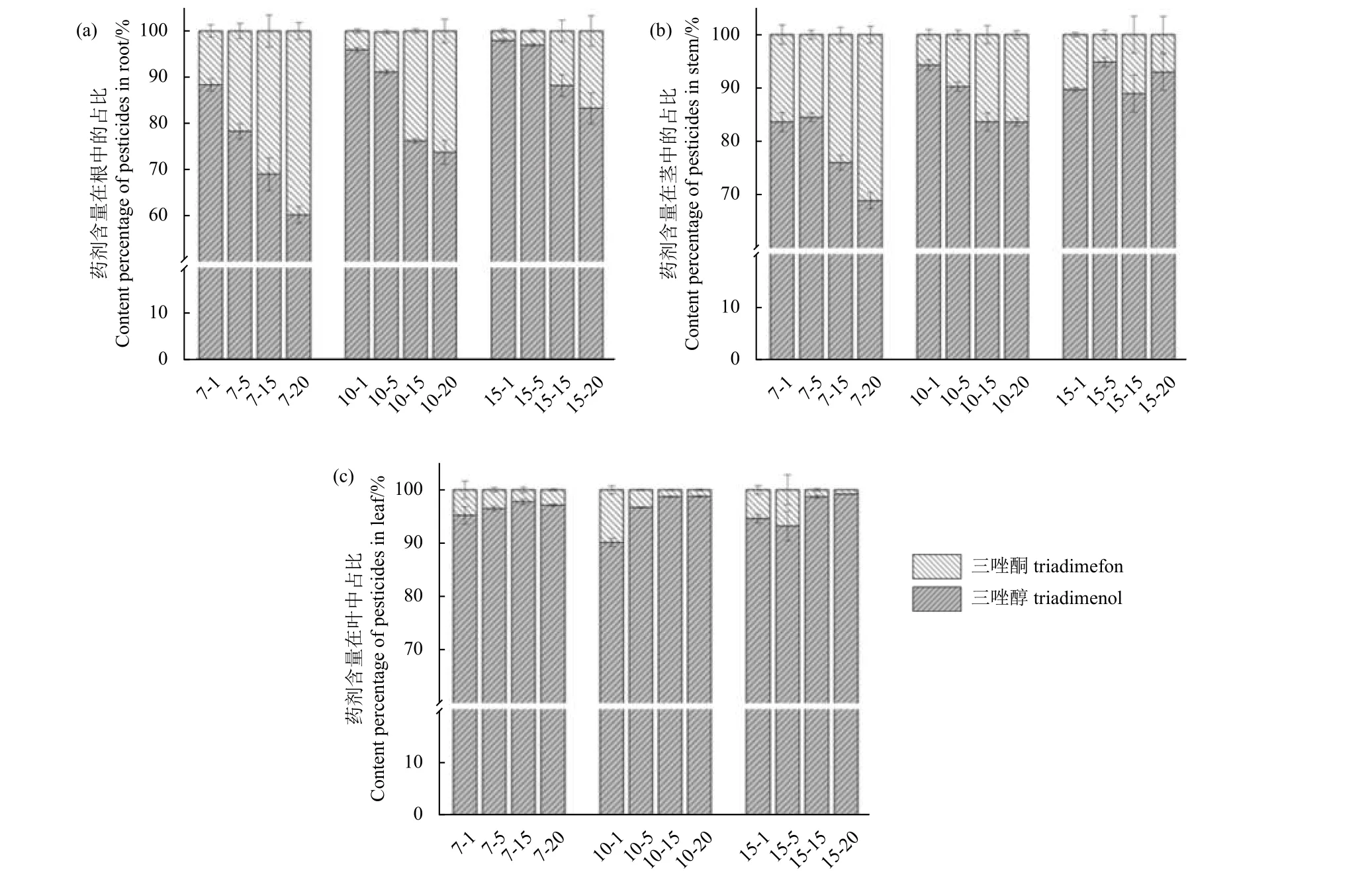
图2 两种农药的含量在橡胶树植株根 (a)、茎 (b) 和叶(c)中的占比 (n = 3)Fig.2 Proportion of the two pesticides in the root (a), stem (b) and leaf (c) of rubber tree plants (n = 3)
2.2.2 三唑酮及其代谢产物三唑醇在橡胶树植株中的转运系数和富集系数 农药在植株不同部位的迁移富集能力可由TFs 和BCFs 来表征[14]。不同添加浓度下植株对药剂的迁移富集行为相似,均表现为根部含量大于茎部和叶部含量,且茎部和叶部转运系数均小于1 (辅助材料附表1、2)。当添加质量浓度为10 mg/L 时,随暴露时间的增加,三唑酮及其代谢产物三唑醇在橡胶树植株中的TF 和RCF 值不断增大 (表5)。TF叶/茎> TF茎/根,说明三唑酮和三唑醇从茎部转运到叶部易于从根部转运至茎部,且茎部和叶部转运系数均小于1,表明2 种药剂不易于从橡胶树植株根部转运到叶部。在施药6 h 时两种药剂的根部富集系数即大于1,120 h 时茎部富集系数大于1,240 h 时叶部富集系数才大于1,且相同时间下RCF > SCF > LCF,表明根部最易于富集2 种药剂,茎部其次,叶部富集能力最弱。
2.3 叶部施药条件下三唑酮及其代谢产物三唑醇的迁移富集行为
在橡胶树病害防治应用中,三唑酮多以喷雾或热雾施药方式进行叶部施药。本研究测定了土培条件下叶部施用三唑酮后橡胶树植株叶片中的药剂含量 (图3)。随施药时间增加,三唑酮含量逐渐降低,三唑醇则呈现先上升后下降趋势。施药2 h 时叶片三唑酮起始含量为10.10 mg/kg,有少量三唑醇生成;1 d 时三唑酮含量迅速降至4.54 mg/kg,三唑醇则迅速升至3.93 mg/kg;3 d时三唑醇含量超过三唑酮,达最大值6.08 mg/kg。另外,本研究同时检测了施药叶片上方和下方枝条叶片中药剂含量,发现仅有少量药剂迁移到这两部分叶片中,三唑酮和三唑醇的检出量均低于0.08 mg/kg,说明在对橡胶树植株叶部施药时,三唑酮及其代谢产物三唑醇在植株不同部位的叶片间迁移能力较差。
3 结论与讨论
目前尚未有橡胶树植株中的农药残留分析方法报道,本研究基于QuEChERS 法,采用GCMS/MS 首次建立了三唑酮和三唑醇在橡胶植株根、茎、叶中的残留分析方法,方法定量限均为0.01 mg/kg,与传统的固相萃取法相比,简化了样品前处理步骤,提高了分析效率,可为今后研究其他农药在橡胶树植株中的迁移富集行为提供技术参考。
三唑酮代谢为三唑醇这一现象在作物和土壤中均有报道[18-19]。Li 等发现了三唑酮在黄瓜、番茄中降解的同时大量代谢生成三唑醇[11]。本研究发现在橡胶树植株营养液中三唑酮大量代谢为三唑醇,这可能与橡胶树植株根系微生物或根系分泌物发挥作用有关[20]。橡胶树植株根和茎中的三唑酮含量随着三唑酮处理浓度增大而显著增加,但这一趋势在叶部并不明显,药剂始终以三唑醇为主,说明橡胶树植株在吸收三唑酮的同时可快速将其代谢成三唑醇。因此在探究植株对三唑酮的吸收转运规律时有必要结合其主要代谢产物三唑醇进行研究。
农药在植物中的迁移富集能力与药剂的理化性质密切有关[21],有研究表明辛醇/水分配系数在0.57~3.7 的农药能够被玉米植株根系吸收并向上转运[22]。橡胶树植株对外源药剂的富集随着暴露时间的增加而整体升高,在药剂吸收过程中TF茎/根和TF叶/茎始终小于1,且RCF 远大于SCF 和LCF,说明三唑酮和三唑醇很难在橡胶树植株中向上迁移,易被根部富集。这与水稻对三唑酮的吸收转运规律一致,三唑酮易在水稻根部富集,不易转运至水稻茎叶中[23]。而Yu 等在研究小麦对三唑酮的吸收转运则发现其易向上转运,吸收稳定后茎叶转运系数均大于1[15],说明药剂在不同植株中的迁移富集能力不同,这可能与不同作物的自身特性相关。因此,针对在不同作物上的农药迁移富集及代谢行为的研究尤为重要。
在叶部施药的条件下,三唑酮在不同植株中的迁移行为有较大差异,如将三唑酮喷施用辣椒植株茎叶部时,仅有少量药剂迁移到植株其他未施药部位[24];Buchenauer 等通过放射性技术发现三唑酮施用于大麦中部叶片4 d 后,其顶层叶片的放射性强度为69.1%,施药叶片则降至30.1%[25]。本研究通过橡胶树植株叶部施药条件下三唑酮及其代谢产物三唑醇的迁移富集行为,发现2 种药剂在橡胶树不同枝条叶片之间的迁移能力较差。另外,橡胶树植株叶片可将三唑酮快速代谢成三唑醇,而三唑醇对白粉病也具有良好的防治效果,因此推测施用三唑酮防治橡胶树白粉病时,真正发挥作用的药剂很可能是其代谢产物三唑醇。
综上所述,在常规背负式喷雾装置施药模式下防治橡胶树白粉病时,三唑酮向上传递困难,叶片之间难迁移,有效利用率低,同时易造成药剂浪费、环境污染等问题。本研究发现茎部易富集三唑酮和三唑醇,且茎、叶部中药剂含量均随着处理浓度的升高而增大,因此可尝试采用自流式注射或高压注射的方式进行橡胶树茎部处理,探究三唑酮的迁移行为及防治白粉病效果。另外,纳米技术通过在药剂与剂型本身水平上进行加工修饰,对于提升药剂的内吸传导能力具有较大潜力[26],未来可通过开发合适三唑酮的纳米剂型以增强药剂递送至橡胶树叶部靶点的能力。最后,在防治过程中三唑酮在橡胶树植株叶片中消解迅速,继而导致农药使用量大幅增加,未来可开发合适三唑酮的缓释剂型,来延长持效期。总的来说,研究药剂在橡胶树上的迁移富集行为,可助力施药策略的开发应用,为今后橡胶树病虫害的高效防治提供方法指导,有助于我国天然橡胶产业健康发展。