三唑酮降解菌SM3的降解特性及其应用研究
2023-05-30赵素霞史森磊林凤翔岳星雨施艳红
赵素霞,史森磊,胡 芃,王 莹,林凤翔,岳星雨,施艳红
三唑酮降解菌SM3的降解特性及其应用研究
赵素霞,史森磊,胡 芃,王 莹,林凤翔,岳星雨,施艳红*
(安徽农业大学资源与环境学院,合肥 230036)
以课题组前期筛选到的1株三唑酮高效降解菌SM3为研究对象,对其降解特性、酶学性质及应用潜力进行了初步研究。结果表明:在纯培养条件下,温度30 ℃、pH 7.0、接菌量5%、盐浓度10 g·L-1及葡萄糖含量1%为高效降解菌株SM3最适培养条件;通过对降解酶定位发现,降解三唑酮关键酶为胞内酶,且酶促降解最适pH为7.0,最适温度为30 ℃;室内模拟三唑酮污染土壤分别设置了0.4、2和5 mg·kg-13个浓度,同时添加菌剂,于1、5、10、15、20和25 d后取样测定土壤中的三唑酮含量。25 d后,3个浓度污染土壤中三唑酮降解率分别达到99.7%,79.1%和58.1%,降解过程符合一级动力学方程。结果可为三唑类杀菌剂三唑酮的生物降解和环境治理提供优良的菌株资源。
三唑酮;降解菌;酶学性质;一级动力学
三唑酮(Triadimefon)杀菌剂由于其广谱活性高、杀菌速度快,作用持续时间长被广泛应用于农业生产中。但随着不合理施药量和施药次数,大量残留的三唑酮会进入水体和土壤环境,对水体和土壤环境造成污染[1]。有研究者在九龙江、太湖和白洋湖水体中均检测到三唑酮,其中最高检出浓度为12 μg·L-1[2-5];Han等[6]也在坚果种植土壤检出三唑酮,最高检出浓度为193.7 μg·kg-1。残留在水体和土壤环境中的三唑酮通过生物富集的方式对生物体产生毒性,进而影响人类的健康。根据以往研究发现,三唑酮对哺乳胚胎产生毒性,导致胚胎畸形[7-10];还可诱导啮齿动物的肿瘤发生[11];在成年青鳉鱼中,三唑酮增强了与肿瘤发生相关的细胞色素P450酶活性[12],被归类为“可能的人类致癌物”。且环境中的三唑酮主要通过水解和光解进行降解,降解过程受外部环境影响较大,降解效果不理想,不能解决其带来的环境污染问题,因此需要找到合理有效的方法去除或减少三唑酮在环境中的残留。
微生物修复因具有成本低、效率高、无二次污染、易操作等优点,近年来已成为环境污染治理的研究热点。目前已有较多文献报道分离筛选出对农药有降解作用的菌株,并对其降解特性及相关机理进行研究[13-15]。菌株降解农药主要是酶促反应过程,且降解目标污染物的种类不同,降解酶在微生物细胞中分布的位置也会不同[16-17]。且随着微生物研究的日趋深入,降解农药的微生物种类不断被发现,降解效果稳定提高,一些微生物已被应用于土壤污染修复中[18-19]。国内外对农药的微生物降解进行了较为广泛的研究,降解农药的类型多集中在除草剂、杀虫剂,杀菌剂的微生物降解报道较少[20],鲜见关于三唑酮微生物降解的报道。
本研究以课题组前期筛选到的1株三唑酮高效降解菌SM3为对象,在实验室模拟条件下研究各种环境因子对三唑酮降解特性的影响,并在此基础上对菌株SM3降解酶的进行定位和酶学性质研究,进而将菌株SM3应用于修复三唑酮污染土壤中,分析三唑酮在土壤中的降解动态,确定其对三唑酮的降解效果,为进一步利用微生物降解三唑酮污染的环境提供了理论基础和依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 课题组保藏的前期分离筛选获得的一株三唑酮高效降解菌株,经鉴定为嗜麦芽窄食单胞菌(),命名为SM3。
1.1.2 土壤来源 采自安徽农业大学农萃园0~15 cm的新鲜表层土壤,过2 mm筛,去除石子、草根等杂质备用。
1.1.3 主要仪器及试剂 仪器:Agilent 1260高效液相色谱仪(北京京科瑞达科技有限公司);HC-3018高速离心机(安徽中科中佳科学仪器有限公司); Waters ACQUITY UPLCTM超高液相色谱-串联质谱仪(沃特世科技有限公司);JYD-1200超声波细胞破碎仪(上海之信仪器有限公司)。
试剂:三唑酮标准品(纯度>98.7%)购于 Cayman Chemical Company;甲酸(色谱级)、乙腈(色谱级)购于Fisher Scientific。
1.1.4 培养基的配制 无机盐培养基(g·L-1):硝酸铵 1.0,磷酸二氢钾 0.5,磷酸氢二钾 1.5,氯化钠 1.0,七水合硫酸镁0.2,调节pH 7.2±0.1;LB培养基(g·L-1):酵母粉5,胰蛋白胨10,氯化钠10,调节pH 7.2±0.1;若配制固体培养基,加入2%琼脂粉。所有器皿与培养基均于120 ℃下高压灭菌20 min。
1.2 方法
1.2.1 菌悬液的制备 将冷冻保藏的菌种在生化培养箱中活化6 h,移取菌液LB固体培养基中培养24 h后,挑取表面的单菌落接入LB液体培养基中,置于摇床振荡培养至对数生长期,菌液离心后取沉淀洗涤涡旋,重复离心3次制成菌悬液,待降解实验时使用。
1.2.2 菌株SM3的降解特性 初始培养条件为:将5%菌悬液接入无机盐培养基(三唑酮浓度10 mg·L-1、葡萄糖含量为0.5%、盐浓度为10 g·L-1、pH为7.0)中,置于30 °C,转速170 r·min-1条件下振荡培养72 h,取样测定三唑酮残留量,并计算三唑酮降解率。以未接种菌悬液的样品作为空白对照,每组处理设置3个重复。依次改变以下单一条件,研究不同单因素对菌株SM3降解的影响。
(1)培养温度(℃):10、20、30、40和50;
(2)初始pH:4.0、5.0、6.0、7.0、8.0、9.0和10.0;
(3)接菌量(%):1、3、5、7和10;
(4)盐浓度(g·L-1):0、10、20、30、40和50;
(5)葡萄糖含量(%):0、1、1.5、2和2.5。
1.2.3 菌株SM3粗酶液的制备 参考降解菌不同细胞组分分离方法[21],将菌液离心取上清液盐析过夜,溶液再次离心收集沉淀,用缓冲溶液溶解,透析至无SO42-,收集透析液即为胞外酶;用传统的渗透休克法[22]将下层菌体溶于蔗糖溶液中,振荡后置于低渗溶液中冰浴,释放周质蛋白,离心取上清液即为细胞周质酶;将下层菌体和缓冲液按1∶3(g·mL-1)的比例制成菌悬液,于冰浴中超声破碎,离心取上清液即为胞内酶。
1.2.4 菌株SM3降解酶定位 将3种粗酶液分别加入三唑酮浓度为10 mg·L-1无机盐培养基中振荡培养,每组设置3个平行,并以不加酶液为空白对照组,每隔一定的培养时间进行取样,测定降解酶在细胞中的分布情况。
1.2.5 降解酶酶学性质研究 (1)粗酶液添加量对酶活的影响:分别取粗酶液0.25~1.5 mL,加入无机盐培养基中(三唑酮浓度10 mg·L-1),使最终测定酶活体系为5 mL,测定不同粗酶液添加量对酶活的影响,以未添加酶液的处理作为对照。本实验条件下,1 mL酶液1 h降解1 mg三唑酮定义为1个酶活力单位(U)。
(2)最适pH:在pH 4.0~10.0 下测定酶活力,其中酶解温度是30 ℃、三唑酮浓度为10 mg·L-1,以最高酶活力为 100%,计算相对酶活力,确定粗酶液的最适pH值。
(3)最适温度:在温度10~50 ℃下测定酶活力,其中三唑酮浓度为10 mg·L-1、pH 7.0,以最高酶活力为 100%,计算相对酶活力,确定粗酶液的最适温度;
(4)金属离子对酶活的影响:在粗酶液中加入金属离子Fe2+、Ca2+、Mg2+、Mn2+、Cu2+、Zn2+,使各反应体系中金属离子的浓度分别为1.0、5.0 和10.0 mmol·L-1,以未加金属离子体系的酶活力为100%,计算相对酶活力,确定金属离子及其浓度对粗酶液酶活力的影响。
(5)降解酶动力学常数的测定:配制4~50 mg·L-1之间8个三唑酮浓度,在pH 7.0,温度30 ℃条件下将粗酶液与三唑酮反应,计算三唑酮降解速度。根据测定结果,采用Lin-eweaver-Burk法作图,并计算出粗酶液对三唑酮降解的米氏常数m和最大反应速率max。
1.2.6 菌株SM3在污染土壤中的应用 向土壤中添加三唑酮溶液,使土壤中三唑酮的终浓度分别达到0.4、2 和5 mg·kg-1。设置3组处理,分别为处理组、对照组和空白土壤。处理组按5%接菌量向土壤中加入新鲜SM3菌悬液(600≈1),对照组加入同等体积的无菌生理盐水,空白土壤为没有添加任何三唑酮和降解菌的处理,每个处理组3个重复。整个培养周期定期称重加水,保持含水量为最大田间持水量的60%左右,于1、5、10、15、20和 25 d取样测定土壤中三唑酮的含量。
2 结果与分析
2.1 菌株SM3的降解特性
2.1.1 温度对菌株SM3降解三唑酮的影响 菌株SM3在10~30 ℃范围内对三唑酮的降解如图1(a)所示,菌株SM3对三唑酮的降解随温度的升高而增大,30 ℃时,菌株SM3对三唑酮的降解效果最好,降解率最高达到66.0%。当温度超过30 ℃时,菌株SM3对三唑酮的降解随温度升高而降低,50 ℃时,降解率仅达到25.6%,由此可见三唑酮降解的最适温度为30 ℃。温度在30~35 ℃之间,降解菌对目标污染物的降解效果较好,且温度过低或过高均影响降解菌的生长速率,对降解过程的酶活性也有影响[23-24]。
2.1.2 pH对菌株SM3降解三唑酮的影响 菌株SM3在pH 4.0~10.0范围内对三唑酮的降解如图1(b)所示,pH值在5.0~8.0范围内,菌株SM3对三唑酮的降解保持较高的活性,降解率都在55.0%以上,其中当pH为7.0时,对三唑酮的降解效果最好,降解率最高为68.9%。而当pH为4.0和10.0时,菌株SM3对三唑酮的降解率分别为34.1%和30.8%,由此可以看出三唑酮降解的最适pH为7.0。大多数降解菌在接近中性的条件下(pH 6.5~7.5)降解活性较好[25-26],因为强酸或强碱的环境会影响降解菌的酶活性,转运过程和营养溶解度[27],很大程度抑制降解菌的活性。
2.1.3 接菌量对菌株SM3降解三唑酮的影响 接菌量在1%~10%范围内,菌株SM3对三唑酮的降解如时图1(c)所示,当接菌量<5%,菌株SM3对三唑酮的降解随着接菌量的增多而增大,当接菌量为5%时,菌株SM3对三唑酮降解活性最大,降解率最高达到68.0%,而当接菌量>5%时,菌株SM3对三唑酮的降解有所下降,可能是因为接菌量过多,导致培养基的营养消耗过快不足以支持菌株生长,菌株开始衰亡,由此可见最适接菌量为5%。不同的接菌量影响目标物污染物的降解,接菌量较少导致菌株滞后期延长,对目标污染物降解时间延长,当接种过高时,营养消耗过快不足以支持菌株生长,菌株衰亡[28]。
2.1.4 盐浓度对菌株SM3降解三唑酮的影响 NaCl浓度在0~50 g·L-1范围内,菌株SM3对三唑酮的降解如图1(d),当NaCl浓度在0~20 g·L-1范围内,菌株SM3对三唑酮的降解保持较高的活性,其中NaCl浓度为10 g·L-1时,对三唑酮的降解能力最强,降解率最高达到69.6%。当NaCl浓度大于10 g·L-1时,菌株对三唑酮的降解活性逐渐下降,其中NaCl浓度为50 g·L-1时,对三唑酮的降解率仅36.0%,因此菌株SM3在NaCl浓度为10 g·L-1时,对三唑酮的降解效果最好。合适的盐度是菌株正常生长的条件之一,高盐度会使细胞渗透压及生物酶活性发生改变,而渗透压的改变会直接影响到菌株的生长,甚至导致菌株的死亡[29]。
2.1.5 葡萄糖含量对菌株SM3降解三唑酮的影响
初始葡萄糖含量在0%~2.5%范围内,菌株SM3对三唑酮的降解如图1(e)所示,初始葡萄糖含量在0%~1%,菌株SM3对三唑酮的降解随葡萄糖含量的增加而增大,当葡萄糖含量为1%,对三唑酮的降解效果最好,降解率最高为70.9%;而当初始葡萄糖含量>1%时,菌株SM3对三唑酮的降解逐渐降低,可能是菌株SM3优先利用了葡萄糖而对三唑酮的降解反而降低。综上,初始葡萄糖含量为1%时,菌株SM3对三唑酮的降解效果最好。碳源可以提供微生物生命活动所需的能量,而葡萄糖作为微生物生长可利用的碳源,其合适的含量能促进微生物的生长和代谢,提高微生物对目标污染物降解的能力[30]。
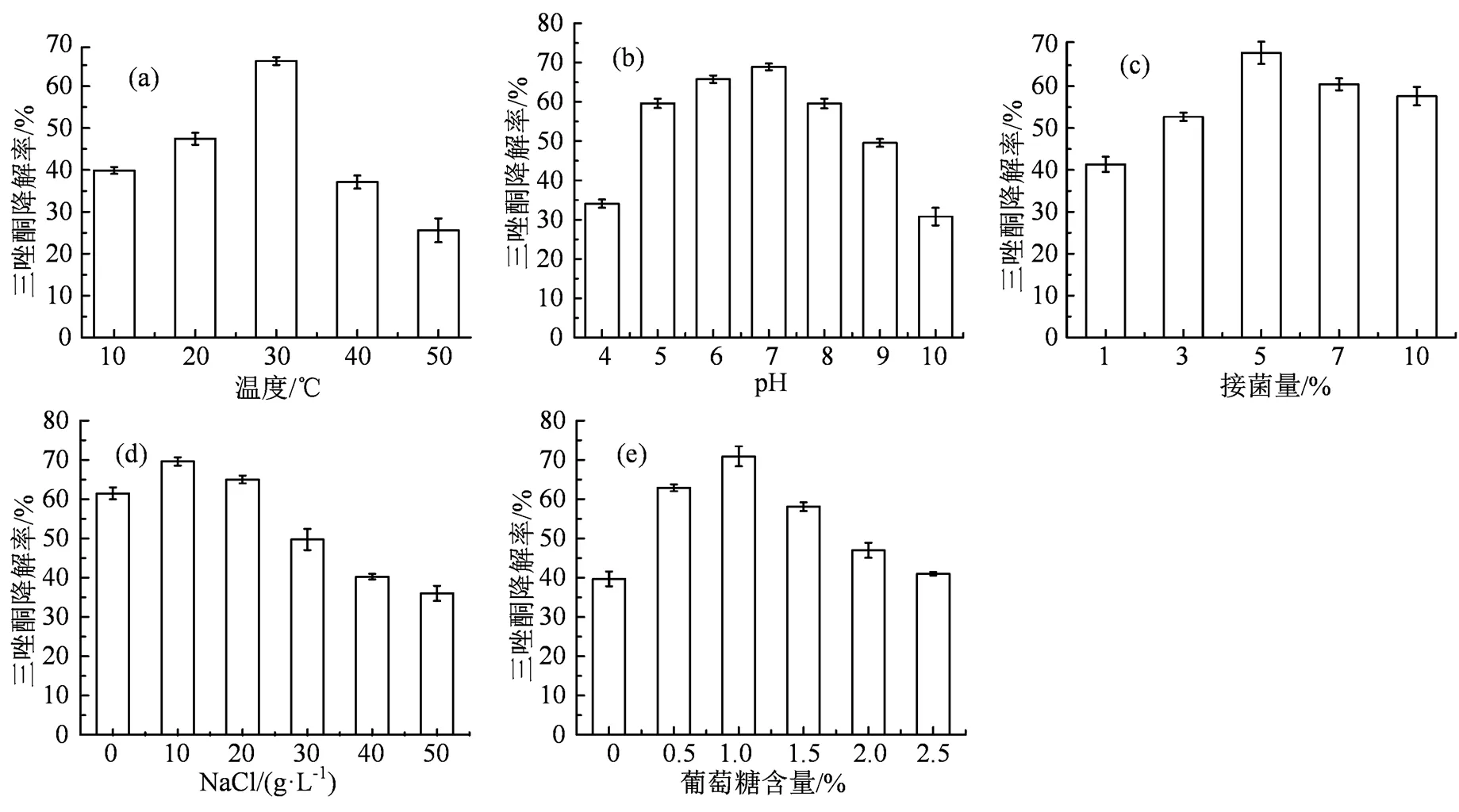
图1 培养温度(a)、初始pH(b)、接菌量(c)、盐浓度(d)及葡萄糖含量(e)对菌株SM3降解三唑酮的影响
Figure 1 The influence of culture temperature (a), initial pH (b), inoculum amount (c) , salt concentration (d)and glucose content (e) on the degradation of triadimefon by strain SM3
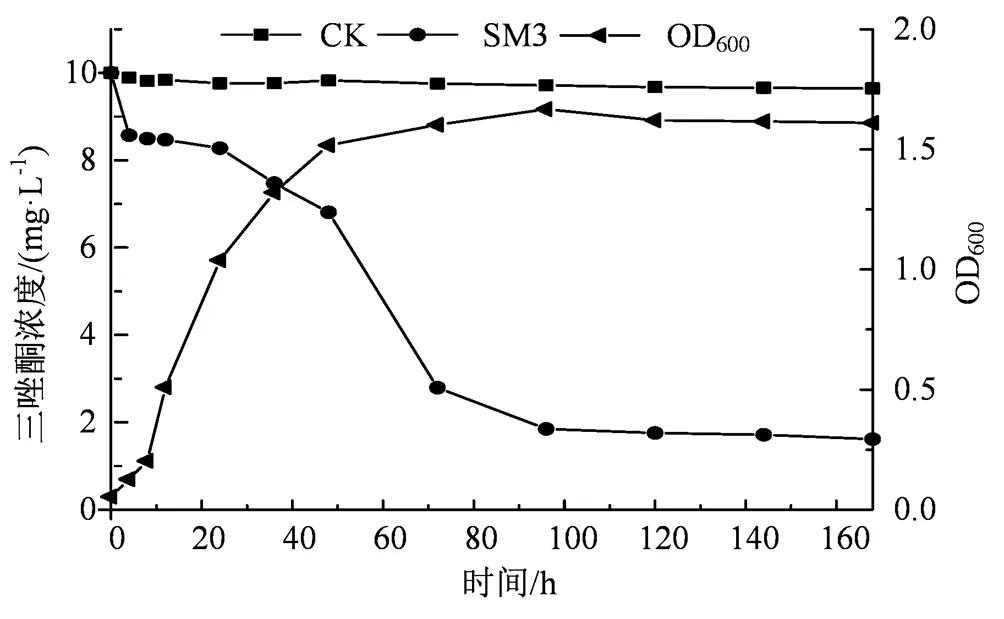
图2 菌株SM3对三唑酮的降解
Figure 2 Degradation of triadimefon by strain SM3 under optimum conditions
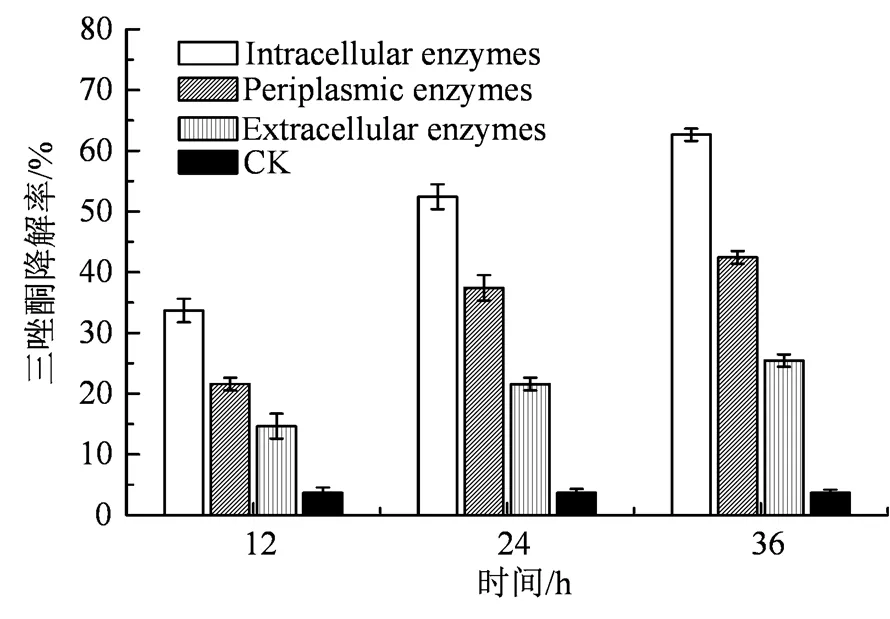
图3 菌株SM3不同细胞组分对三唑酮的降解
Figure 3 Degradation of triadimefon by different cell components of strain SM3
2.1.6 最适条件下菌株SM3对三唑酮降解效果
单因素实验确定最适降解条件为温度30℃、pH 7.0、接菌量5%、盐浓度10g·L-1及葡萄糖含量1%,在此条件下菌株SM3对三唑酮降解测定结果如图2所示,在0~12 h左右,降解菌对三唑酮的降解速度较为缓慢,说明刚接入培养基的降解菌在含有三唑酮的环境中需要一定的适应时间;在24~96 h范围内降解菌开始表现出对三唑酮的降解作用,72 h时对三唑酮的降解率可达71.4%;96~168 h范围时,对三唑酮的降解趋于平缓,可能培养基的营养消耗过多不足以支持菌株生长,菌株开始衰亡。
2.2 菌株SM-3降解酶定位
分别测定菌株SM3不同组分,胞外酶、胞内酶和细胞周质酶对三唑酮降解能力。结果如图3所示,结果表明上清液中提取的胞外粗酶液36 h对三唑酮的降解率为25.46%;利用超声波细胞粉碎机处理破碎菌体,离心所得胞内粗酶液的酶活性较强,其对三唑酮降解率可达62.64%;细胞周质酶活性略微减少,三唑酮降解率为42.44%,由此推断出降解菌产生降解三唑酮的关键酶是胞内酶。
2.3 菌株SM3降解酶的酶学性质研究
2.3.1 酶浓度对降解酶活性的影响 粗酶液添加量的不同(即酶浓度不同)对三唑酮降解酶活力的影响不同,结果如图4(a)所示。在0~0.75 mL范围内时,降解酶活力随着粗酶液添加量即酶浓度的增大而增加,但增加趋势逐渐趋于平缓;而在0.75~1.50 mL范围内时,降解酶活力基本稳定有略下降趋势,可能因为底物分子与酶的结合已趋饱和,因受到底物浓度的限制,再增加酶浓度对酶活的提高也不明显,因此0.75 mL为最适粗酶液添加量。
2.3.2 降解酶最适pH 菌株SM3降解酶的最适反应pH如图4(b)所示。在pH 4.0~10.0 范围内,随着pH的升高,酶活性呈先上升后下降趋势。在 pH 4.0~7.0 范围内,pH 值越高,降解酶的酶活就越高:在 pH 7.0~10.0 范围内,pH 值越高,降解酶的酶活就越低;当pH为7.0时,酶活性最高,因此该酶的最适反应pH为7.0。降解酶的活性受pH的影响较大,一般pH值在5.5~7.5范围内,降解酶的活性较高[31-32]。pH值过大或过小都会使酶发生变性,破坏酶的结构,影响了酶的稳定性,导致酶活性下降[33]。

(a) 粗酶液添加总量; (b) 最适pH; (c) 最适温度; (d)不同离子及浓度; (e) 三唑酮降解酶的Linewear-Burk曲线。
Figure 4 Enzymatic properties of degrading enzymes
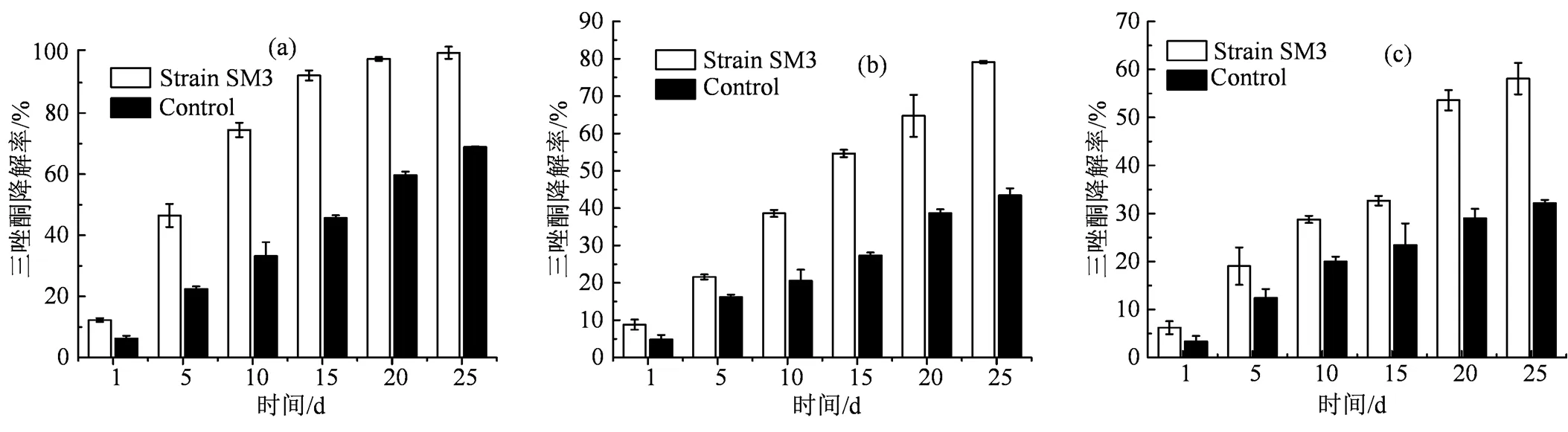
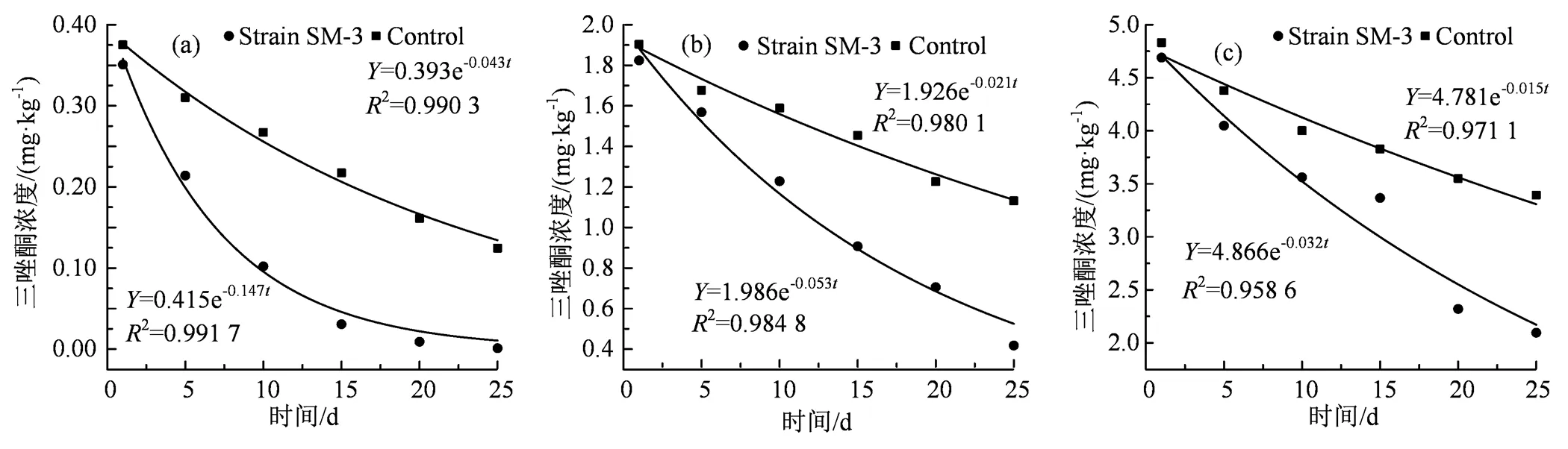
(a) 三唑酮初始浓度为0.4 mg·kg-1;(b)三唑酮初始浓度为2 mg·kg-1;(c)三唑酮初始浓度为5 mg·kg-1。
Figure 5 Effects of strain SM3 on the degradation of triadimefon in soil.
2.3.3降解酶最适温度菌株SM3降解酶的最适反应温度图4(c)所示。当温度为30 ℃时,该降解酶表现出最强的降解活性,即该胞内酶对三唑酮的最适降解温度为30 ℃。当温度<30 ℃时,该胞内酶的酶活随着温度的升高而增大。当温度>30 ℃,随着温度升高,该酶液的对三唑酮的降解活性逐渐降低,甚至当温度为50 ℃时,相对酶活仅有10.7%。综上,该酶的最适酶促反应温度为30 ℃。酶促反应的反应温度升高可以增加分子运动速率,提高酶与底物的接触频率从而加快酶促反应速率;但温度过高也容易使蛋白质不稳定,导致酶的空间结构被破坏,增加酶变性失活的概率[34-35]。
2.3.4 金属离子对降解酶酶活的影响 由图4(d)可以看出,不同金属离子随着浓度的升高对三唑酮降解酶的酶活有不同的影响,Ca2+、Mg2+和Mn2+都对降解酶的酶活有着促进作用,且随着浓度的升高对酶活的促进作用也在加强,3种金属离子对三唑酮降解酶的酶活影响无明显差别。Fe2+、Cu2+和Zn2+这3种金属离子对降解酶的酶活起抑制作用,3种离子对降解酶的酶活抑制作用稍有不同,其中Cu2+对降解酶的活性抑制作用最强,Cu2+浓度为10 mmol·L-1时,降解酶的酶活仅有55.32%,同一浓度下,Zn2+抑制作用稍弱,降解酶的酶活为69.49%,而Fe2+浓度在10 mmol·L-1时,降解酶的酶活还在75%以上,对降解酶的酶活抑制作用相对来说较弱。由此可推测,金属离子可能对酶的空间结构、活性位点具有一定的影响,导致其活性发生改变[36-37]。
2.3.5 三唑酮降解酶的动力学常数由图4(e)可以看出,用由 Lineweaver-Burk作图法绘制的三唑酮降解酶的米氏方程为=49.845+0.738 7,相关系数2= 0.998 2,根据方程可计算得到三唑酮降解酶的米氏常数m=67.477 mmol·mL-1,最大反应速率max=1.3537 mmol·h-1,这两个动力学常数是反映了此降解酶在以三唑酮为反应底物时的酶学性质,是区别于其他底物的主要特征性常数。
(a) 三唑酮初始浓度为0.4 mg·kg-1;(b)三唑酮初始浓度为2 mg·kg-1;(c) 三唑酮初始浓度为5 mg·kg-1。
Figure 6 Degradation kinetics of triadimefon in soi
2.4 菌株SM3在污染土壤中的应用
2.4.1 菌株SM3对土壤中三唑酮的降解效果 菌株SM3对土壤中不同浓度三唑酮的降解效果如图5所示。由图5可以看出,当三唑酮浓度分别为0.4、2.0和5.0 mg·kg-1,不同浓度三唑酮降解率随着时间的增大而增大。25 d后,未添加菌株SM3的土壤中三唑酮的降解率分别达到68.9%、43.4%和32.1%,可能是因为土壤中本身含有的土著微生物,对降解三唑酮起到促进作用;而添加菌株SM3土壤中三唑酮的降解速率明显加快,25 d时三唑酮降解率分别达到99.7%、79.1%和58.1%。表明菌株SM3可以提高土壤中三唑酮的降解效果,加快降解速率,且三唑酮的添加量越少,其在土壤中越易被降解,残留期越短,因此在农业生产用药时,应尽量做到合理施药,因需施药,不滥用农药。
2.4.2 菌株SM3对土壤中三唑酮的降解动力学 对土壤中三唑酮的降解曲线进行动力学拟合,结果表明不同浓度三唑酮的降解都符合一级降解动力学,降解动态见图6。设定三唑酮的初始浓度分别为0.4、2.0和5.0 mg·kg-1,然而在拌药平衡过程中的损失以及残留的形成,未加菌组24 h后的实测浓度分别为0.38、1.90和4.83 mg·kg-1,降解半衰期分别为16.12、33.01和46.21 d;加菌组24 h后的实测浓度分别为0.35、1.82和4.69 mg·kg-1,降解半衰期分别为4.72、13.08和21.67 d,与未加菌组相比,三唑酮的降解半衰期分别缩短了70.72%、60.38%和53.11%。结果说明菌株SM3对土壤中三唑酮的降解有促进作用,且土壤中三唑酮的浓度越低,其降解速率越快。
3 结论
本研究利用单因素实验,测定不同条件对菌株SM3降解三唑酮的影响。结果表明,对三唑酮降解的最优条件为:温度为30 ℃、pH值为7.0、接菌量为5%、盐浓度为10 g·L-1和初始葡萄糖含量为1%,此条件下72 h三唑酮的降解率可达71.4%。
对可降解三唑酮的菌株SM3的降解酶进行定位分析,发现其胞内酶、细胞周知酶和胞外酶36 h对三唑酮的降解率分别可达到62.64%、42.44%和25.46%,由此推断菌株SM3降解三唑酮关键酶为胞内酶。该酶的最佳作用条件为:粗酶液添加量为0.75 mL、pH值为7,温度为30 ℃。金属离子Ca2+、Mg2+和Mn2+对其酶活有促进作用,而Fe2+、Cu2+和Zn2+对酶活起不同程度的抑制作用,其中Cu2+对降解酶的活性抑制作用最强。以三唑酮为底物,得到米氏常数为m=67.477 mmol·mL-1,最大反应速率max=1.353 7 mmol·h-1为进一步研究三唑酮降解酶的酶学性质提供了理论依据。
通过室内模拟土壤修复实验,初步探究了菌株SM3对土壤中三唑酮降解的作用。当土壤中三唑酮的浓度分别为0.4、2 和5 mg·kg-1时,添加菌株SM3处理的降解半衰期分别为4.72、13.08 和21.67 d,与未添加菌株SM3的处理相比,三唑酮的降解半衰期分别缩短了70.72%、60.38%和53.11%;且添加菌株SM3处理25 d后降解率分别为99.7%、79.1%和58.1%,而未添加菌株SM3处理的降解率仅达到为68.9%、43.4%和32.1%,说明添加菌株SM3可明显促进三唑酮的降解,缩短其在土壤中的降解半衰期,提高其降解速率,对三唑酮污染土壤的生物修复效果显著。
[1] HOU L, JIN X W, LIU N, et al. Triadimefon in aquatic environments: occurrence, fate, toxicity, and ecological risk[J]. Environ Sci Eur, 2022, 34: 12.
[2] 游明华, 孙广大, 陈猛, 等. 环境水样中9种三唑类农药的固相萃取-气相色谱-质谱分析[J]. 色谱, 2008, 26(6): 704-708.
[3] 刘娜, 金小伟, 薛荔栋, 等. 太湖流域药物和个人护理品污染调查与生态风险评估[J]. 中国环境科学, 2017, 37(9): 3515-3522.
[4] LIU Y H, LI S L, NI Z L, et al. Pesticides in persimmons, jujubes and soil from China: residue levels, risk assessment and relationship between fruits and soils[J]. Sci Total Environ, 2016, 542(Pt A): 620-628.
[5] FU Y, YANG T, ZHAO J, et al. Determination of eight pesticides in Lycium barbarum by LC-MS/MS and dietary risk assessment[J]. Food Chem, 2017, 218: 192-198.
[6] HAN Y X, MO R H, YUAN X Y, et al. Pesticide residues in nut-planted soils of China and their relationship between nut/soil[J]. Chemosphere, 2017, 180: 42-47.
[7] MENEGOLA E, BROCCIA M L, DI RENZO F, et al. In vitro teratogenic potential of two antifungal triazoles: triadimefon and triadimenol[J]. In Vitro Cell Dev Biol Anim, 2000, 36(2): 88-95.
[8] MENEGOLA E, BROCCIA M L, DI RENZO F, et al. Craniofacial and axial skeletal defects induced by the fungicide triadimefon in the mouse[J]. Birth Defects Res Part B Dev Reproductive Toxicol, 2005, 74(2): 185-195.
[9] DI RENZO F, BROCCIA M L, GIAVINI E, et al. Stage-dependent abnormalities induced by the fungicide triadimefon in the mouse[J]. Reproductive Toxicol, 2011, 31(2): 194-199.
[10] DI RENZO F, BROCCIA M L, GIAVINI E, et al. Antifungal triazole derivative triadimefon induces ectopic maxillary cartilage by altering the morphogenesis of the first branchial arch[J]. Birth Defects Res Part B Dev Reproductive Toxicol, 2007, 80(1): 2-11.
[11] ALLEN J W, WOLF D C, GEORGE M H, et al. Toxicity profiles in mice treated with hepatotumorigenic and non-hepatotumorigenic triazole conazole fungicides: Propiconazole, triadimefon, and myclobutanil[J]. Toxicol Pathol, 2006, 34(7): 853-862.
[12] LI W, ZHA J M, LI Z L, et al. Effects of exposure to acetochlor on the expression of thyroid hormone related genes in larval and adult rare minnow (Gobiocypris rarus)[J]. Aquat Toxicol Amsterdam Neth, 2009, 94(2): 87-93.
[13] SEHNEM N T, SOUZA-CRUZ P, PERALBA M D C R, et al. Biodegradation of tebuconazole by bacteria isolated from contaminated soils[J]. J Environ Sci Heal Part B Pestic Food Contam Agric Wastes, 2010, 45(1): 67-72.
[14] SARKAR S, SEENIVASAN S, ASIR R P S. Biodegradation of propargite by Pseudomonas putida, isolated from tea rhizosphere[J]. J Hazard Mater, 2010, 174(1/2/3): 295-298.
[15] CHEN J, XU L, GIESY J P, et al. Biodegradation of paclobutrazol by a microbial consortium isolated from industrially contaminated sediment[J]. Toxicol Environ Chem, 2010, 92(8): 1487-1494.
[16] FANG L C, XU L Y, ZHANG N, et al. Enantioselective degradation of the organophosphorus insecticide isocarbophos in Cupriavidus nantongensis X1T: Characteristics, enantioselective regulation, degradation pathways, and toxicity assessment[J]. J Hazard Mater, 2021, 417: 126024.
[17] SHI T Z, FANG L C, QIN H, et al. Minute-speed biodegradation of organophosphorus insecticides by Cupriavidus nantongensis X1T[J]. J Agric Food Chem, 2019, 67(49): 13558-13567.
[18] 王海兰, 臧海莲, 成毅, 等. 氯嘧磺隆降解菌的筛选及对污染土壤的生物修复[J]. 中国环境科学, 2018, 38(4): 1473-1480.
[19] PAN D D, XU Y, NI Y X, et al. The efficient persistence and migration of Cupriavidus gilardii T1 contribute to the removal of MCPA in laboratory and field soils[J]. Environ Pollut, 2022, 304: 119220.
[20] SHI Y H, YE Z, HU P, et al. Removal of prothioconazole using screened microorganisms and identification of biodegradation products via UPLC-QqTOF-MS[J]. Ecotoxicol Environ Saf, 2020, 206: 111203.
[21] 兰亚红, 谢明, 陈福良, 等. 施氏假单胞菌JHY01菌株毒死蜱降解酶的定位及其提取条件的优化[J]. 中国生物防治, 2008, 24(4): 349-353.
[22] 夏金兰, 王晶, 张倩, 等. 嗜酸氧化亚铁硫杆菌ATCC23270周质蛋白的选择性提取及差异表达[J]. 中南大学学报(自然科学版), 2009, 40(4): 845-850.
[23] ZHANG Y, DU G C, FAN X R, et al. Effects and statistical optimization of fermentation conditions on growth and poly (vinyl alcohol)-degrading enzyme production ofGY1[J]. Biocatal Biotransformation, 2008, 26(5): 430-436.
[24] PINYAKONG O, TIANGDA K, IWATA K, et al. Isolation of novel phenanthrene-degrading bacteria from seawater and the influence of its physical factors on the degradation of phenanthrene[J]. Scienceasia, 2012, 38: 36-43.
[25] GHOSAL D, GHOSH S, DUTTA T K, et al. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons (PAHs): a review[J]. Front Microbiol, 2016, 7: 1369.
[26] ELSHIKH M S, ALARJANI K M, HUESSIEN D S, et al. Enhanced Biodegradation of Chlorpyrifos by Bacillus cereus CP6 and Klebsiella pneumoniae CP19 from municipal waste water[J]. Environ Res, 2022, 205: 112438.
[27] WONG J, LAI K, WAN C, et al. Isolation and optimization of PAH-degradative bacteria from contaminated soil for PAHs bioremediation[J]. Water Air Soil Pollut, 2002, 139: 1-13.
[28] YANG X, LI F, NING H Y, et al. Screening of pig-derived Zearalenone-degrading bacteria through the Zearalenone challenge model, and their degradation characteristics[J]. Toxins, 2022, 14(3): 224.
[29] 张宝宝, 余天飞, 艾加敏, 等. 3株石油降解菌鉴定与降解特性研究[J]. 延安大学学报(自然科学版), 2021, 40(1): 32-37.
[30] 陆长鸣, 李想, 徐明恺, 等. 一株高效广谱莠去津降解菌SB5的生长和降解特性[J]. 应用生态学报, 2022, 33(1): 229-238.
[31] 宋茂鹏, 马现永, 邓盾, 等. 假单胞菌胞外酶降解黄曲霉毒素B1的酶学性质[J]. 微生物学通报, 2021, 48(1): 46-56.
[32] 宋佳, 范寰, 闫雪, 等. 赭曲霉毒素A降解酶Af-OTd的酶学性质分析[J]. 中国食品学报, 2022, 22(1): 31-38.
[33] 付静, 杨媚, 李理, 等. 雅致放射毛霉3.2778羧肽酶性质及其活性中心结构的研究[J]. 中国酿造, 2010, 29(3): 30-33.
[34] SHI T Z, FANG L C, QIN H, et al. Rapid biodegradation of the organophosphorus insecticide chlorpyrifos by Cupriavidus nantongensis X1T[J]. Int J Environ Res Public Health, 2019, 16(23): 4593.
[35] 万文结, 刘月, 薛芷筠, 等. 纤维素降解菌Arthrobacter oryzae HW-17的纤维素降解特性及纤维素酶学性质[J]. 环境科学学报, 2017, 37(10): 3679-3686.
[36] 佟瑶, 叶锦韶, 尹华, 等. 金属离子对三苯基锡酶促降解的影响[J]. 环境科学, 2011, 32(3): 779-783.
[37] 柯野, 谢天涵, 梅颖诗, 等. 羽毛降解菌Deinococcus actinosclerus RM的分离、鉴定及其产生的蛋白酶酶学性质[J]. 福建农林大学学报(自然科学版), 2022, 51(1): 98-103.
Study on the degradation characteristics and application of triadimefon-degrading strain SM3
ZHAO Suxia, SHI Senlei, HU Peng, WANG Ying, LIN Fengxiang, YUE Xingyu, SHI Yanhong
(School of Resources and Environment, Anhui Agricultural University, Hefei 230036)
In this paper, a triadimefon-degrading strain SM3, which was screened by the research group in the early stage, was taken as the research object, and its degradation characteristics, enzymatic properties and application potential were preliminarily studied. The results showed that: under pure culture conditions, the temperature of 30 ℃, pH 7.0, inoculum volume of 5%, salt concentration of 10 g·L-1and glucose content of 1% were the optimal culture conditions for the efficient degrading strain SM3. The key enzymes of triadimefon are intracellular enzymes, and the optimum pH for enzymatic degradation is 7.0 and the optimum temperature is 30 ℃; indoor simulated triadimefon-contaminated soils were set at 0.4, 2 and and 5 mg·kg-1, respectively. After 1, 5, 10, 15, 20 and 25 days, samples were taken to determine the content of triadimefon in the soil. After 25 days, the degradation rates of triadimefon in the contaminated soil with three concentrations reached 99.7%, 79.1% and 58.1%, respectively, and the degradation process conformed to the first-order kinetic equation. This study provides an excellent strain resource for the biodegradation and environmental management of triazole fungicides triadimefon.
triadimefon; degrading bacteria; degradation enzymatic properties; first order kinetic
X592
A
1672-352X (2023)02-0275-08
2022-05-01
国家自然科学基金(31972981)和校级大学生创新创业项目(X202210364226)共同资助。
赵素霞,硕士研究生。E-mail:zsx2467595818@163.com
通信作者:施艳红,博士,教授,博士生导师。E-mail:shiyh@ahau.edu.cn
10.13610/j.cnki.1672-352x.20230509.003
2023-05-09 13:57:50
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230509.1017.006.html
