百里香内生真菌塞缪尔斯木霉Trichoderma samuelsii 2-63 菌株的鉴定及其抗真菌活性
2023-04-18王军节
马 莉, 屈 欢*,, 郭 震, 王军节, 张 琇
(1.北方民族大学 生物科学与工程学院,银川 750021;2.北方民族大学 植物性农产品贮藏与加工重点实验室,银川 750021;3.宁夏特殊生境微生物资源开发与利用重点实验室,银川 750021)
据世界粮农组织统计,全球每年约有25%的作物受到病害的影响[1],这是造成农作物产量和品质降低的主要原因之一[2-3]。在病害中,其中70%~80%的病害是由植物病原真菌所导致的[4]。在我国,一些植物病原真菌病害如苹果腐烂病和番茄灰霉病等,一直以来是制约农作物优质高产的重要因素之一,导致损失惨重[5]。一直以来,化学抗菌剂在拮抗植物病原真菌和促进农业的增产中起着不可或缺的作用。但是,长期使用化学抗菌剂因引发食品安全、环境污染及诱导植物产生抗药性等问题而逐渐受到限制[6-8]。因此,人们将目光转向新型、安全、环保的生物源农药。
微生物杀菌剂作为生物源农药的重要组成部分,因具有高效、低毒、选择性强、残留时间短等特点,在农业病害防治中发挥重要作用[8]。木霉属Trichodermaspp.是植物真菌病害防治中研究最广泛的真菌之一[9-11],目前该属已知物种已达340种[12]。木霉具有广谱的拮抗活性,对病原菌具有重要的生防作用,其生防机制主要有竞争作用、重寄生作用、植物生长促进剂和诱导植物抗性等[13-14],不同作用机制之间可能还有互相协同作用[15]。一些木霉菌在植物病害防控的过程中通过产生次生代谢物发挥作用,目前该属报道的代谢物已超过200 种,不同种产生的代谢物数量和种类有所差异,其中研究最多的是具有挥发性的“椰子芳香”化合物6-戊基-2H-吡喃-2-酮 (6-PP)[16]。6-PP 是木霉产生的吡喃酮类代谢物,最初是在绿色木霉T.viride的发酵液中被检测到,之后陆续在哈茨木霉T.harzianum和康宁木霉T.koningii中被检测到[17]。6-PP 除其特殊的“椰子香味”外,还表现出较好的抑菌活性,如可以抑制丝核菌等病原菌的生长[18]。
分离自中国西藏自治区米林县腐枝的塞缪尔斯木霉T.samuelsii,作为木霉属的一种,在中国于2019 年被首次报道[19]。本实验室前期从中国宁夏回族自治区六盘山附近的百里香植物中分离到1 株木霉真菌,经分子生物学和性状观察发现其与已报道的塞缪尔斯木霉极为相似,所不同的是其在SNA 培养基上没有椰子香味[19]。因此,本研究对该菌株进行了系统的生物学性状和抑菌活性研究,采用气相色谱-质谱联用仪 (GC-MS) 探究了其抑菌活性成分,并采用高效液相色谱(HPLC)技术探索了其主要抑菌化合物的产生条件,以期为基于木霉菌的微生物抑菌剂的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
百里香内生真菌2-63 菌株:来源于六盘山地区生长的百里香植株茎部,现保存于中国微生物保藏中心 (保藏号:M2020642)。
供试病原菌菌株:马铃薯早疫病菌Alternaria solani、番茄灰霉病菌Botrytis cinerea、马铃薯干腐病菌Fusarium sulphureum、西瓜枯萎病菌Fusarium oxysporum、苹果腐烂病菌Valsa mali、枸杞根腐病菌Fusarium solani、小麦赤霉病菌Fusarium graminearum和枸杞黑霉病菌Alternaia alternata。其中,枸杞根腐病菌、西瓜枯萎病菌和枸杞黑霉病菌为宁夏特殊生境微生物资源开发与利用重点实验室分离并鉴定,其余病菌均为西北农林科技大学植物保护学院馈赠。乙酸乙酯、甲醇、乙腈等试剂均为市售色谱纯或分析纯。
1.2 供试培养基
马铃薯葡萄糖琼脂培养基 (PDA):马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1000 mL。马铃薯葡萄糖培养基 (PDB):马铃薯200 g,葡萄糖20 g,蒸馏水1000 mL。玉米粉琼脂培养基(CMD):玉米粉30 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1000 mL。人工合成低营养琼脂培养基(SNA):KH2PO41.0 g,KCl 0.5 g,KNO31.0 g,MgSO40.5 g,葡萄糖0.2 g,琼脂粉15 g,蒸馏水1000 mL。大米培养基:大米60 g,蒸馏水90 mL,pH 值自然。大麦培养基:大麦80 g,蒸馏水120 mL,浸泡过夜。
1.3 百里香内生真菌2-63 菌株的生物学鉴定
1.3.1 菌落特征及菌丝、孢子形态观察 分别将2-63 菌株接种于PDA、CMD 和SNA 培养基上,于25 ℃恒温黑暗培养,逐日观察菌株在3 种培养基上菌落的大小、颜色、表面、边缘及生长速度等培养特征;以培养72 h 时的菌落平均直径计算日生长速率;分别挑取菌丝置于载玻片上,采用正置荧光显微镜观察菌丝和孢子形态等性状。
1.3.2 菌株鉴定 将2-63 菌株接种在PDA 培养基上,于28 ℃下培养5 d,在超净工作台中刮取收集菌丝,用UNIQ-10 真菌基因组DNA 提取试剂盒提取DNA,对其ITS、TEF1和RPB2区域进行扩增。ITS扩增引物为ITS1 (5′-TCCGTAG GTGAACCTGCGG-3′) 和ITS4 (5′-TCCTCCG CTTATTGATATGC-3′),TEF1扩增引物为EF1-728F (5′-CATCGAAGTTCGAAGG-3′) 和Tef1LLErev(5′-AACTTGCAGGCAATGG-3′),RPB2扩增引物为:RPB2_210up (5′-TGGGWGA YCARAARAAGG-3′) 和RPB2_1450low (5′-CATRATGACSGAATCTT CCTGG-3′),PCR 扩增产物检测合格后送至上海美吉生物技术有限公司进行测序,将测序结果在NCBI 数据库里上传分别获取登记号MN944534、OP414767 和OP414768。测序结果在GenBank 数据库中进行BLAST 比对,获取参考序列及相关分类信息[20],利用BioEdit、Mega-X 软件和Neighbor-Joining (NJ) 法构建系统发育树进行物种鉴定,各分支置信度进行1000 次重复分析。
1.4 百里香内生真菌2-63 菌株的抑菌活性测定
1.4.1 菌株对常见植物病原菌的拮抗作用 采用平板对峙法[21]测定。将植物病原菌菌饼 (4 mm)接种于PDA 平板中央,在距离植物病原菌两侧30 mm 处对称接种2-63 菌株,每处理3 次重复,以只接种植物病原菌的处理为对照,于28 ℃恒温培养,96 h 后测量菌落的生长直径,按公式 (1) 计算抑制率 (I)。
其中:Dc为对照菌落直径,Dt为处理菌落直径。
1.4.2 菌株发酵液和发酵液粗提物抑菌活性测定
采用菌丝生长速率法测定[22]。将 2-63 菌饼(4 mm)接种于250 mL 含有130 mL PDB 培养基的三角瓶中,每瓶接种6 块,每个阶段接种7 瓶,于28 ℃、170 r/min 摇床中恒温培养,观察 2-63菌株发酵液的特征。分别于96、108 和180 h时取出7 瓶发酵液,移取50 mL 过0.45 μm 的水系微孔滤膜,按体积比1:9 的比例与PDA 培养基混合,制备成发酵原液带毒培养基。每个阶段剩余的发酵液合并后,采用冷冻干燥机低温冷冻浓缩至原体积的1/4,用等体积的乙酸乙酯萃取3 次。合并萃取液,无水硫酸钠干燥后,旋转蒸发得浸膏 (黏稠状小颗粒),用丙酮溶解并定容至5 mL,与420 mL PDA 培养基混匀,倒入直径为9 cm 的培养皿,制备成发酵液粗提物带毒培养基。在这两种带毒培养基上接种植物病原菌,对照组为只接种植物病原菌的平板,每个处理3 次重复,于28 ℃恒温培养,4 d 后测量菌落的生长直径,按公式 (1) 计算抑制率。
1.4.3 菌株挥发性有机化合物 (VOCs) 的抑菌活性
参照Wonglom 等[23]的熏蒸法并作适当修改。在9 cm 的灭菌培养皿盖和底分别倒入PDA 培养基,将 2-63 菌饼(4 mm) 接种于培养皿盖中央,植物病原菌接种于培养皿底中央,将培养皿盖与底合上后用石蜡密封,以不接种2-63 的培养皿为对照,每处理3 次重复,于28 ℃恒温培养,4 d后测定菌落的生长直径,按公式 (1) 计算抑制率。
1.5 百里香内生真菌2-63 菌株抑菌活性成分分析
根据1.4 节的结果,2-63 菌株抑菌的活性成分主要为其产生的VOCs。结合在平板上的培养和液体发酵的情况,分析2-63 菌株在不同培养条件下VOCs 的成分组成。
1.5.1 菌株在平板培养条件下产生的VOCs分析 根据1.3.1 节的结果,2-63 菌株在SNA 培养基上不产生VOCs,而在PDA 和CMD 培养基上产生VOCs,因而利用GC-MS 分别分析 2-63 菌株在PDA 和CMD 培养基中的产香情况。
1) 样品前处理:将2-63 菌饼(4 mm)分别接种于PDA 和CMD 培养基中央,于28 ℃恒温培养,于培养的第1~18 天连续取样,采用顶空固相微萃取技术 (HS-SPME) 采集VOCs,采样过程如图1 所示。采用GC-MS 分析,运用NIST17 数据库对出峰结果进行检索分析。
图1 T.samuelsii 2-63 菌株 VOCs 的取样过程Fig.1 Procedure of VOCs produced by T.samuelsii 2-63 strain
2) 色谱条件:HP-5MS 色谱柱 (30 m × 250 μm,0.25 μm),进样口温度250 ℃,AUX-2 温度 (接口温度) 270 ℃,载气为高纯氦气,柱流速1 mL/min,恒定流速,不分流进样,压力52.76 kPa,隔壁吹扫流量3 mL/min。
3) 质谱条件:离子方式为电子轰击电离(EI),电离电压70 eV,离子源温度230 ℃,传输线温度105 ℃,四级杆温度150 ℃,m/z扫描范围50~550 amu,扫描方式为全扫描,溶剂延迟1 min。
4) 程序升温过程:初始50 ℃,保持0 min,以10 ℃/min 升温至160 ℃,保持2 min,运行13 min,再以10 ℃/min 升温至200 ℃,共运行17 min。
1.5.2 菌株在固体发酵培养条件下产6-PP 的分析
1.5.2.1 待测样品的制备 将2-63 菌饼(4 mm)接种于PDA 平板上,于28 ℃恒温培养,4 d 后取活化好的菌饼3 块接种于装有130 mL 的PDB 液体培养基的250 mL 锥形瓶中,于28 ℃、150 r/min恒温摇床中培养3 d,获得种子发酵液;将分别装有大麦培养基、大米培养基和麦麸培养基的500 mL 三角瓶分别于121 ℃进行灭菌30 min,冷却后分别接种200 μL 的种子发酵液,于28 ℃恒温培养;根据前期试验结果,在发酵培养后8、16 和20 d,分别取发酵培养基3 瓶,用乙酸乙酯进行固-液萃取3 次。合并萃取液,无水硫酸钠干燥后旋转蒸发除去溶剂,得到液体粗提物。分别取3 种粗提物少许,用少量乙酸乙酯溶解,以6-PP 标准品为对照,进行薄层色谱(TLC)检测分析。粗提物用色谱甲醇稀释50 倍,过0.22 μm 有机系微孔滤膜,待HPLC 分析。
1.5.2.2 HPLC 分析 色谱柱为ZORBAX SBC18柱 (250 mm × 4.6 mm,5 μm),流动相为100%乙腈,检测波长254 nm,柱温35 ℃,流速1 mL/min,进样量10 μL。准确称取6-PP 标准品5 mg,用色谱纯甲醇溶解并定容至10 mL,过0.22 μm 有机系微孔滤膜,即得0.5 mg/mL 的6-PP 标准品溶液,再用甲醇梯度稀释成0.4、0.3、0.2、0.1 mg/mL 的系列6-PP 标准品工作溶液,按上述条件测定,以6-PP 的质量浓度为横坐标,以其对应的峰面积为纵坐标绘制标准曲线,求出待测样品的含量。
1.5.3 菌株在浅层培养条件下产6-PP 的分析 标准曲线绘制同1.5.2 节。通过前期液体发酵抑菌试验结果发现,2-63 菌株在PDB 液体培养基中不产生VOCs,推测可能是因为PDB 液体摇瓶培养,菌饼悬浮于液体中氧气供应不足而影响了VOCs的产生,故采用浅层培养分析2-63 菌株产物及产生6-PP 的情况。在100 mL 的三角瓶中装入15 mL的PDB 培养基,于121 ℃灭菌20 min,冷却后接种 2-63 菌饼 (4 mm) 3 块,菌丝面朝上,于28 ℃恒温培养,分别于培养后3、6、9、12、15 和18 d取发酵液。每个阶段3 次重复。过0.22 μm 水系滤膜,待HPLC 分析,条件同1.5.2 节。
1.6 数据处理
运用Microsoft Excel 2017 进行数据整理,采用SPSS 19.0 进行数据统计分析,在P< 0.05 水平上采用Duncan’s 新复极差法进行显著性差异分析,利用GraphPad Prism 5.0、Origin 等软件制作图表。
2 结果分析
2.1 百里香内生真菌2-63 菌株的生物学性状
2.1.1 菌落特征及菌丝、孢子形态观察 2-63 菌株在所有培养基上均能生长。在PDA 培养基上(图2-A) 菌落生长较快,菌丝棉絮状白色,呈辐射状向外生长;于25 ℃下培养48 h 后菌丝产生椰子芳香气味;培养72 h 菌落半径为64 mm;培养8 d 后产生绿色光滑的分生孢子;培养15 d 后边缘菌丝出现白色小脓疱。
在CMD 培养基上 (图2-B) 菌丝生长较快,但培养初期菌丝白色絮状稀薄;于25 ℃下培养72 h 菌落半径71 mm;培养6 d 菌丝产生椰子芳香气味;培养7 d 后边缘菌丝出现白色粉状斑点,有绿色、光滑的分生孢子产生;培养13 d 后,培养基边缘菌丝出现白色脓疱。
在SNA 培养基上 (图2 C-F)菌落生长缓慢,菌丝白色极稀薄;于25 ℃下培养72 h 菌落半径37 mm;菌丝不产生椰子气味;培养7 d 后培养基表面出现绿色斑点,有绿色、光滑的分生孢子产生;分生孢子梗绿色,大小为20~38.3 μm,多分枝;分生孢子梗上多瓶梗,先端单生或簇生分生孢子;孢子呈绿色,光滑,椭圆形至球形,大小为3~5 μm。

图2 2-63 菌株在不同培养基上培养的性状及显微结构特征Fig.2 Culture and microstructure characteristics of 2-63 strain
2.1.2 菌种鉴定 采用真菌提取试剂盒提取2-63 菌株的DNA,测序后获得序列在GenBank 上用BLAST 进行同源性比对,挑选同源性≥98%的同属近缘种,构建系统发育树。因通过BLAST 检索获取与2-63 相似度高的序列,能够同时获取ITS、TEF1和RPB2序列的菌株很少,因此将ITS序列构建一个系统发育树,将TEF1和RPB2序列联合构建系统发育树,再结合2-63 菌株的生物学性状确定其归属。ITS序列比对发现2-63 菌株与木霉属亲缘关系最近 (图3),TEF1和RPB2序列比对发现2-63 菌株与T.samuelsii聚于同一个分支 (图4),所以将内生菌株2-63 鉴定为塞缪尔斯木霉Trichoderma samuelsii,与庄文颖课题组[19]在相同培养条件下分离得到的菌株菌丝生长和产孢特性等非常相似,与其不同的是,本研究中该菌株在人工合成低营养琼脂培养基 (SNA) 上培养不产生椰子芳香气味。

图3 2-63 菌株基于ITS 基因序列的NJ 系统发育树Fig.3 Neighbor-joining phylogenetic tree of 2-63 strain based on ITS gene sequences
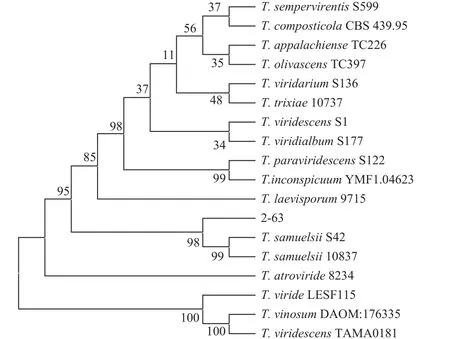
图4 2-63 菌株基于TEF1 和RPB2 基因序列的NJ系统发育树Fig.4 Neighbor-joining phylogenetic tree of 2-63 strain based on TEF1 and RPB2 gene sequences
2.2 T.samuelsii 2-63 菌株的抑菌活性
2.2.1T.samuelsii2-63 菌株对常见植物病原菌的拮抗作用 采用平板对峙法[21]测定了T.samuelsii2-63 菌株对8 种植物病原菌的拮抗活性,结果如图5-A 所示,该菌株对供试的8 种植物病原真菌均具有较强的拮抗活性,对菌丝生长的抑制率均达到70.0%以上。与对照组相比,该菌株对小麦赤霉病菌和枸杞黑霉病菌菌丝生长的抑制率最高,分别为85.7%和87.1%,抑制作用在前2 d 较弱,第3 d 后增强。图5-B 清楚的展示了处理组较对照组而言,植物病原菌的菌丝生长受到了T.samuelsii2-63 菌株明显的限制。

图5 T.samuelsii 2-63 菌株对植物病原菌的抑制率Fig.5 Antifungal activity of T.samuelsii 2-63 strain against plant pathogens
2.2.2 PDB 液体发酵后T.samuelsii2-63 菌株的抑菌活性 图6 为不同发酵时间的T.samuelsii2-63菌株发酵原液的抑菌活性结果。从中可以看出,不同时间的发酵液对供试的7 种植物病原菌均具有一定的抑菌活性,但整体上抑菌率都低于30.0%。

图6 T.samuelsii 2-63 菌株不同培养时间发酵原液对植物病原菌的抑菌活性Fig.6 Antifungal activity of fermentation broth of T.samuelsii 2-63 strain against plant pathogens at different culture times
图7 为T.samuelsii2-63 菌株发酵液粗提物的抑菌活性结果。从中可以看出,粗提物整体上抑菌活性都较低,只对番茄灰霉病菌有一定的抑菌效果,50.0%左右。
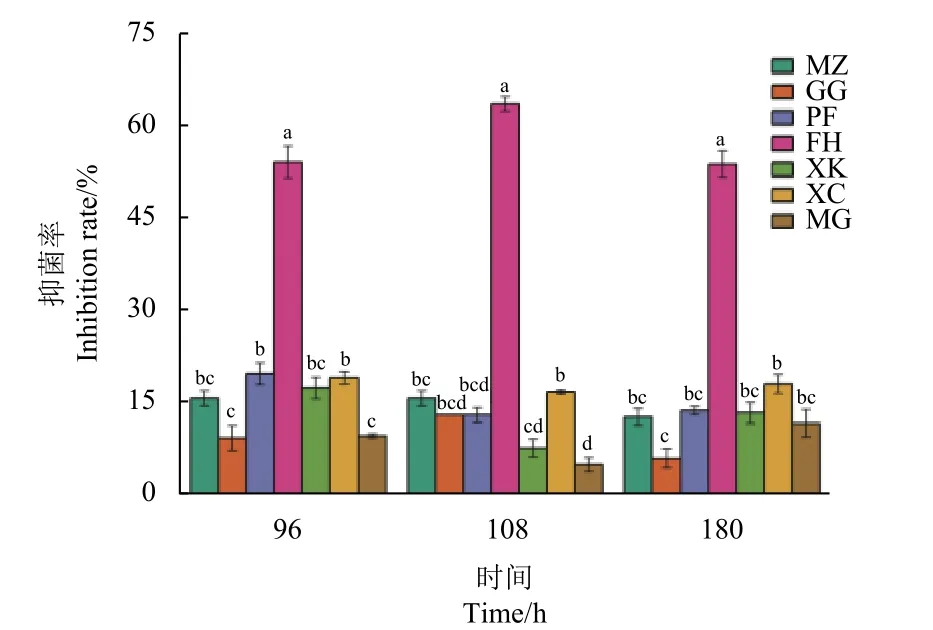
图7 T. samuelsii 2-63 菌株不同培养时间发酵液粗提物对植物病原菌的抑菌活性Fig.7 Antifungal activity of crude extracts of fermentation broth of T.samuelsii 2-63 strain at different culture time against plant pathogens
2.2.3T.samuelsii2-63 菌株挥发性有机化合物VOCs 的抑菌活性 为确定T.samuelsii2-63 菌株释放的VOCs 对供试植物病原真菌生长的影响,采用熏蒸法[23]测定了VOCs 对病原真菌的抑制率,结果如图8 所示,与对照组相比,VOCs 对供试植物病原菌均表现出不同程度的抑制作用,抑制率为31.0%~68.5%。其中,对枸杞黑霉病菌和番茄灰霉病菌表现出较好的抑制活性,抑制率分别为68.5%和63.3%,表明VOCs 可能是该菌株发挥抑菌作用的关键成分。

图8 T. samuelsii 2-63 菌株产生的VOCs 对植物病原菌的抑制活性Fig.8 Antifungal activity of volatile compounds from T.samuelsii 2-63 strain against plant pathogens
2.3 T.samuelsii 2-63 菌株抑菌活性成分的分析
2.3.1T.samuelsii2-63 菌株在平板培养条件下产生VOCs 的分析T.samuelsii2-63 菌株在PDA和CMD 培养基上均能产生椰子芳香气味,因此本研究中将T.samuelsii2-63 菌株分别接种在PDA和CMD 培养基上连续培养1~18 d,利用GC-MS分析VOCs 的变化过程,结果如图9 所示,从图9-A 和9-B 可以看出,随着培养时间的增加,T.samuelsii2-63 菌株产生的VOCs 中有一个化合物含量也随之增加,经过NIST17 数据库检索为6-戊基-2H-吡喃-2 酮 (6-PP),结合前面的抑菌活性,6-PP 是VOCs 中的关键抗真菌化合物;从图9-E可以看出,在PDA 和CMD 培养基上培养9~18 d,6-PP 在PDA 培养基上产量达到基本稳定的最高水平,在CMD 培养基上达到一个稍微有波动的较高水平,色谱图上最大峰面积分别为96.0%和90.0%。但在CMD 培养基上,6-PP 产量从第18 天开始急剧下降。
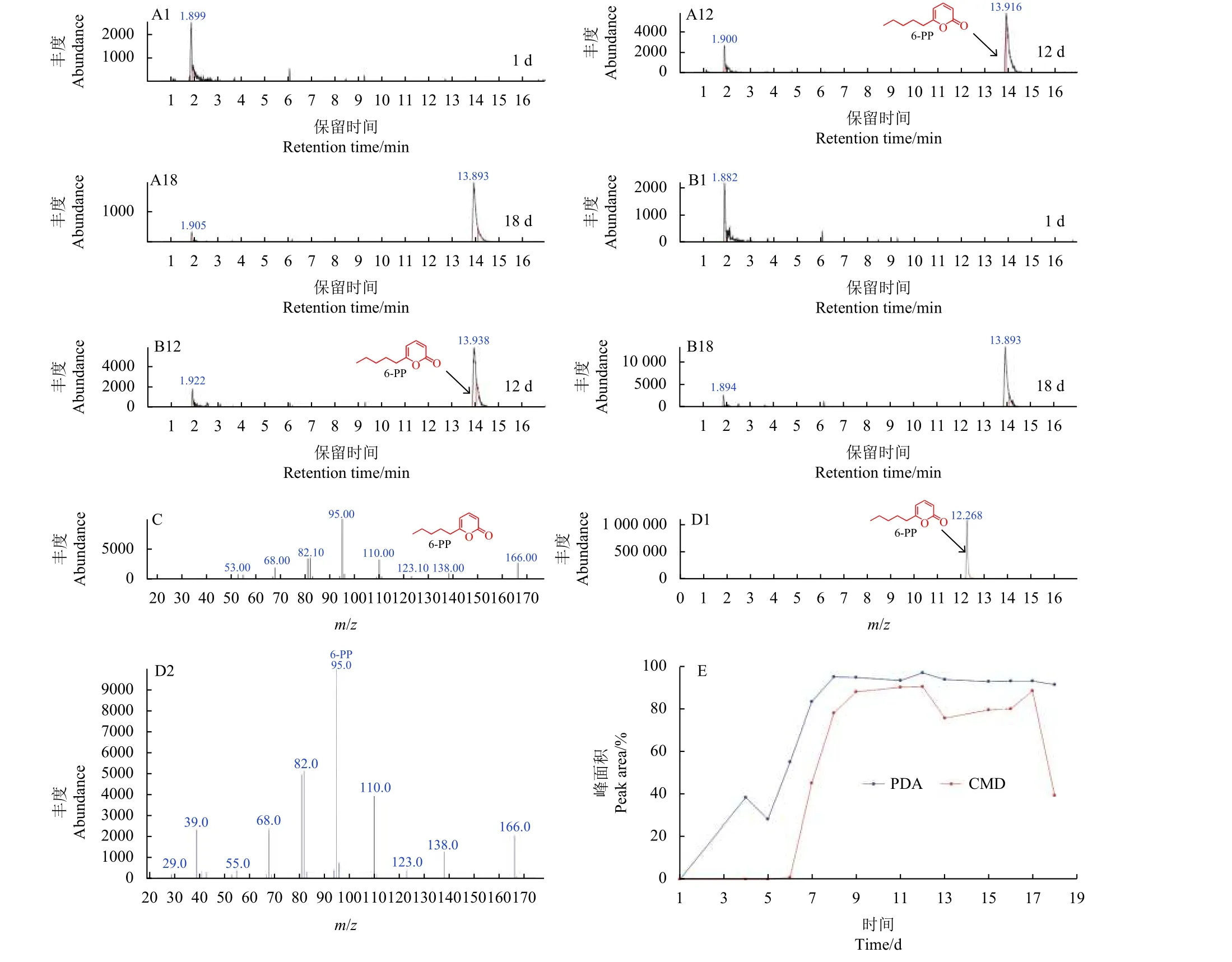
图9 T.samuelsii 2-63 菌株在下同培养基上产生的VOCs 及其化合物6-PPFig.9 VOCs and the compound 6-PP produced by T.samuelsii 2-63 strain on different media
2.3.2T.samuelsii2-63 菌株在固体发酵培养条件下产生6-PP 的分析T.samuelsii2-63 菌株利用大麦、大米及麦麸培养基固体发酵后,TLC 分析其粗提物中6-PP 的含量,如图10 所示,除麦麸发酵后不产生6-PP 外,大麦和大米发酵后均可产生6-PP,因此选择大米和大麦培养基发酵后的粗提物进行HPLC 分析。

图10 T.samuelsii 2-63 菌株利用不同固体培养基发酵后产生6-PP 的情况Fig.10 The production of 6-PP by T.samuelsii 2-63 strain after fermentation using different solid media
6-PP 的标准曲线方程为:Y= 6694.8X+84.179,R2= 0.9941。将T.samuelsii2-63 菌株在大米和大麦培养基上产生的6-PP 结合TLC 结果,将得到的峰面积带入上述标准方程,求得VOCs中6-PP 的质量浓度如图11 所示,总体上随着培养时间的增加,大米和大麦两种培养基上产6-PP的质量浓度都呈现先增加后减少的趋势,在培养第16 d 其质量浓度均达到最高,其中大米培养基上6-PP 为38.6 mg/mL,大麦培养基上为4.0 mg/mL。综合上述结果,大米培养基更有利于T.samuelsii2-63 菌株产椰子香味物质6-PP,可作为固体大量发酵的培养基。

图11 T.samuelsii 2-63 菌株在大米和大麦培养基上产6-PP 的浓度随时间的变化Fig.11 The variation of 6-PP concentration produced by T.samuelsii 2-63 stain in rice and barley media with time
2.3.3T.samuelsii2-63 菌株在浅层培养条件下产6-PP 的分析T.samuelsii2-63 菌株在PDB 培养基上浅层培养1~18 d,产生6-PP 的浓度参照
1.5.2 节的标准曲线计算,结果如表1 所示。从中可以看出,在培养的前15 d,随着培养时间的增加产生6-PP 的浓度也呈现增加趋势,并于第15 d达到最高值,为0.1 mg/mL,之后逐渐下降,到18 d时只有第15 d 时的20.0%。
3 讨论与结论
从宁夏固原地区生长的百里香植株茎组织中分离得到内生真菌2-63 菌株,将其分别接种在PDA、CMD 和SNA 培养基上,发现其在PDA 和CMD 培养基上生长较快,且产生椰子香气味,在SNA 培养基上生长较慢,不产生椰子香气味,培养至第7 d 产生绿色、光滑的分生孢子,孢子呈椭圆形至球形,大小为3~5 μm,分生孢子生于瓶梗的顶端,单生或着簇生。根据形态学和ITS、TEF1及RPB2基因序列的系统发育树分析,将2-63 菌株鉴定为塞缪尔斯木霉Trichoderma samuelsii。根据系统发育树 (图3 和图4),塞缪尔斯木霉与Trichoderma hispanicum和Trichoderma junci的系统发育关系密切。但在形态学上,与T.samuelsii相比,T.hispanicum的瓶梗较短,分生孢子较大,T.junci在CMD 培养基上,不产生椰子气味[19]。木霉菌因其环境适应性强,广泛分布于土壤、枯枝等[24]。据报道,木霉菌虽分布广泛,但呈现出地理或气候分布偏爱,比如我国西南部是木霉菌多样性最高的地区,但哈茨木霉是我国华东地区的优势种等[25-26]。而塞缪尔斯木霉在中国首次于西藏地区发现,之后就是本文中发现于宁夏六盘山地区百里香植株中,从总体地域分布来看,塞缪尔斯木霉主要分布于地理环境较为贫瘠的地域。内生菌在与植物长期共处中,可形成互利共生的关系[27],同时结合塞缪尔斯木霉的分布环境,百里香作为西北地区特色多年生半灌木植物,推测塞缪尔斯木霉在百里香茎中存在,可能与其共同适应西北特殊生境,协助百里香抗逆境、抗胁迫以及抗病害能力有关。
近些年来,部分木霉菌株已成功应用于植物病原真菌的防治,例如哈茨木霉用于防治镰刀菌属、链格孢菌属等多种植物病原真菌[28-29]。本研究中,通过平板对抗法测定了T.samuelsii2-63 菌株对供试植物病原菌的拮抗活性。结果 (图5) 表明,T.samuelsii2-63 菌株可抑制菌丝生长,其中对小麦赤霉病菌和枸杞黑霉病菌的抑菌效果最好,其抑制率分别为85.7%和87.1%,抑制作用在前2 d 较弱,在第3 d 后较强。生物学特性观察表明,T.samuelsii2-63 菌株在培养的第2 d 可以检测到椰子芳香气味,推测椰子芳香气味成分可能和抑菌有关,为了验证这一假设,采用挥发性抗真菌试验评价了VOCs 对供试植物病原真菌生长的影响。由图8 可以看出,T.samuelsii2-63 菌株产生的VOCs 具有较强的抗真菌活性,对番茄灰霉病菌和枸杞黑霉病菌均有较好的抑制作用,抑制率分别为63.3%和68.5%,表明VOCs 是T.samuelsii2-63 菌株的关键抗真菌化合物。
有研究表明,一些木霉物种会产生具有“椰子香味”的化合物6-PP,具有抑菌活性。该化合物首次在绿色木霉的培养液中被检测到,后来在康宁木霉和哈茨木霉中陆续被发现[17]。本研究中,根据图9 中的GC-MS 分析,结合前面的抑菌试验结果,确认6-PP 是T.samuelsii2-63 菌株产生的 VOCs 中的主要成分,也是T.samuelsii2-63菌株的关键抗真菌化合物,表明6-PP 不仅具有“椰子香味”,还能抑制番茄灰霉病菌等病原菌的生长,与文献报道的6-PP 对植物病原真菌的抑制活性一致[30]。
