Y型双液原电池与电解池的“巧用”
2023-04-16戴跃华
戴跃华
(江苏省镇江第一中学)
笔者和同事对苏教版选择性必修1的《原电池的工作原理》中的活动探究实验——铜锌双液原电池实验进行了改进,并写了一篇文章《铜锌双液原电池演示实验创新设计的实践和思考》,改进后的实验不仅简化了实验仪器、减少了试剂用量而且增大了电流强度。我们从上述实验中得到启发,用改进后的铜锌双液原电池作为学生电源,将电极材料和电解液巧妙组合起来,就能构成一套多功能电解实验装置,设计成微型电解实验,做到电解实验的微量化、绿色化、可视化。
1.一体化Y型玻璃管原电池的具体制作过程
1.1 实验仪器及药品
(1)实验仪器:Y型玻璃管1支、铜电极1根、锌电极1根、导线、烧杯、玻璃棒等辅助材料若干、PVC白板1块
(2)实验试剂:狮头牌琼脂粉1袋、1.0 mol·L-1CuSO4溶液、0.5 mol·L-1ZnSO4溶液、KCl固体、大红色素1袋、蒸馏水
1.2 实验装置图
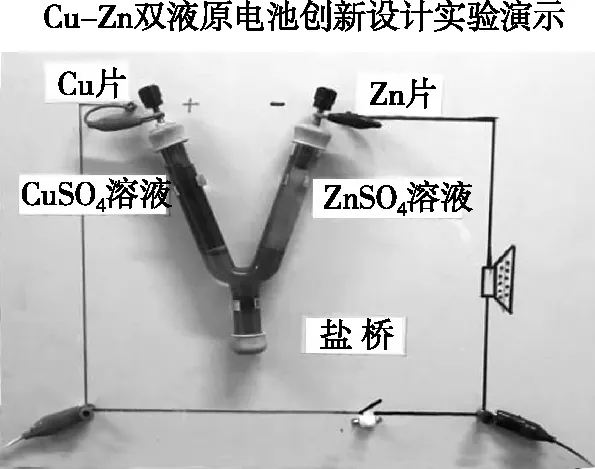
图1 灌装好的一体化Y型玻璃管原电池
1.3 实验步骤
1.3.1 盐桥的制备
笔者通过分析资料,调整了加料顺序和药品的用量。具体操作如下:称取约0.8 g琼脂粉溶于100 mL开水中,搅拌使之完全溶解后加入约24 g KCl固体,完全溶解后趁热倒入已预热的Y型玻璃管,液面只要超过Y型玻璃管的岔口即可。待溶液冷却后,凝胶就形成了,至此盐桥也就做好了。

图2

图3

图4 盐桥的制备过程
1.3.2 溶液的灌装和电极的加入
往正极区支管里注入1.0 mol·L-1CuSO4溶液,至离管口2 cm左右,并加入铜电极;往负极区支管里加入0.5 mol·L-1ZnSO4溶液,至离管口2 cm左右,并加入锌电极。
1.3.3 实验仪器的固定和电路的连接
通过导线,在PVC白板的后面将正极和负极串联好,装上开关,形成一个闭合回路;在白板的下角分别安装导线柱,方便连接导线夹。
至此,一个完整的铜锌双液原电池制作完成,制作简单、携带方便、操作简化。随即,我们对制作的双液原电池进行电化学测量,电流在25 mA左右、电压在1.2 V左右(如图5、图6),这个电流强度和电压完全在人体安全承受范围之内,所以我们利用这个原电池,将其组装,作为安全的学生电源,结合课本实例解决中学实验中电解应用的实验。

图5 电流强度

图6 电压强度
2.具体应用实例
2.1 检验盐桥中阴阳离子的迁移方向
2.1.1 实验仪器及药品
(1)实验仪器:自制Y型玻璃管原电池、购买的针头和针筒、导线若干
(2)实验试剂:四苯硼钠稀溶液(可以检测微量的K+)
2.1.2 实验装置

图7 K+遇到四苯硼钠产生白色沉淀

图8 Zn-Cu双液原电池的工作原理
2.1.3 实验步骤
(1)按照图1连接好装置,接通电路。
(2)随即在正极附近滴入数滴四苯硼钠稀溶液,正极附近很快出现大量的白色沉淀(图7)。说明正极附近有钾离子出现,钾离子遇到四苯硼钠产生白色沉淀。
(3)证明盐桥中的钾离子迁移到正极,另外的氯离子迁移到负极,形成定向迁移,产生电流。
设计意图:利用四苯硼钠稀溶液与钾离子发生反应,在正极附近产生白色沉淀,证明饱和氯化钾盐桥中的阴阳离子发生迁移,进而说明电解质溶液中阴阳离子会发生定向迁移,从而产生电流。
(4)通过现象分析微观原因,作为原电池,电解质溶液中的阳离子——K+定向迁移到正极,阴离子——Cl-定向迁移到负极,从而产生连续不断的电流,为后续我们自制的双液原电池作为学生电源提供理论基础。

2.2 电解饱和食盐水
2.2.1 实验仪器及药品
(1)实验仪器:自制Y型玻璃管原电池、大头针、铂丝、铁钉、玻璃培养皿、导线若干
(2)实验试剂:饱和食盐水、淀粉碘化钾试纸、pH试纸
2.2.2 实验装置

图9 电解装置图

图10 电极材料及检测的试纸

图11 电解之后试纸的变化
2.2.3 实验步骤
(1)按照图9所示,用红色导线将铂丝与原电池正极相连,作阳极;用黑色导线将铁钉与原电池负极相连,作阴极。下面实验接法相同。
(2)将铂丝紧靠淀粉碘化钾试纸,铁钉紧靠pH试纸。
(3)向事先准备好的玻璃培养皿中加入1滴饱和食盐水,然后进行电解。电解30 s后,接电源正极即阳极附近淀粉碘化钾试纸出现蓝色;接电源负极即阴极附近pH试纸出现蓝色(图11)。
设计意图:利用阳极附近淀粉碘化钾试纸出现蓝色,证明阳极附近产生了氯气;利用阴极附近pH试纸出现蓝色,说明阴极附近溶液显碱性,证明阴极附近产生了氢氧化钠。


【透过现象回归课本】这部分的电解饱和食盐水的实验属于课本必做实验,需要用到学生电源接交流电,存在安全隐患。另外由于交流电产生的电流大,反应速率较快,产生的氯气无法很好地控制,且产生氯气的浓度比较大,会污染环境。所以根据以上改进实验,不仅可以很好地控制氯气的产生速率和氯气的浓度,还便于学生安全操作,浓度更小,更不易造成环境污染。本次实验最重要的一个亮点之处,还可以根据阳极和阴极的现象,分别得出阳极区阴离子的放电顺序是Cl-先于水中OH-;阴极区阳离子的放电顺序是水中H+先于Na+。这样由实验现象来证明放电顺序,明显好于死记硬背,也容易提高学生的参与意识和学习兴趣。
课本中在氯碱工业上提出,由于阳极产生的氯气与阴极产生的氢气会发生剧烈的反应而发生爆炸,另外氯气与氢氧化钠溶液反应会生成次氯酸钠,从而降低氯气和氢氧化钠溶液的浓度,所以需要安装阳离子交换膜,将两极进行隔开。本部分改进实验可以规避这个问题,只需要很少的量就可以得到明显的现象,并且由于浓度较小,并不会发生爆炸。为此,我们根据试题的需要,添加讨论和设计离子交换膜的问题,同时这也是高考的方向。
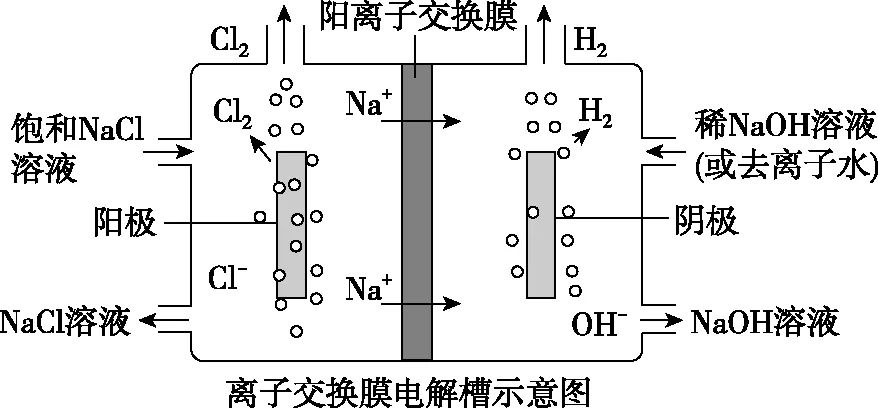
图12
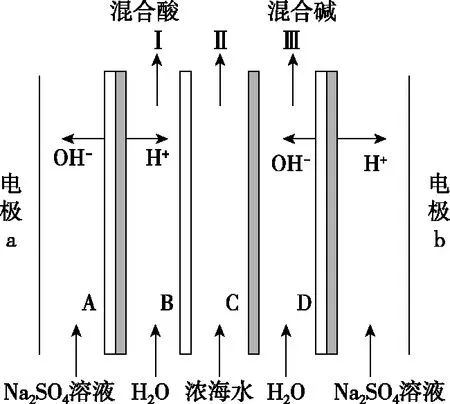
图13
让学生分组讨论图12,得出阴离子交换膜并不能解决上述这些问题,所以需要添加阳离子交换膜,并总结出阳离子交换膜的优点:①平衡电荷,形成闭合回路;②防止Cl2和H2混合而引起爆炸;③避免Cl2与NaOH溶液反应生成NaClO,影响Cl2和NaOH溶液的产量。
图13是2020年某地的模考题,通过双膜,来模拟以浓海水为原料直接制备酸碱。根据氢离子和氢氧根离子的迁移方向,判断出a为阳极、b为阴极。B区产生混合酸,所以海水中氯离子迁移到B区,从而判断出B区的离子交换膜是阴离子交换膜。同理,D区产生混合碱,海水中阳离子需要迁移到D区与氢氧根离子结合形成混合碱,进而判断出C区的离子交换膜是阳离子交换膜。这样Ⅱ口出来的就是淡水了。
2.3 电解硫酸铜溶液
2.3.1 实验仪器及药品
(1)实验仪器:自制Y型玻璃管原电池、铂丝、铁钉、玻璃培养皿、导线若干
(2)实验试剂:CuSO4溶液、pH试纸
2.3.2 实验装置

图14 电解前电极的情况

图15 电解后电极的情况
2.3.3 实验步骤
(1)与图9接法相同。
(2)将包裹pH试纸的铂丝、铁钉同时放入装有硫酸铜溶液的玻璃培养皿中。
(3)电解片刻后,阳极铂丝上无变化,pH试纸变红;阴极铁钉上出现红色固体(图14、图15)。
设计意图:利用阳极附近pH试纸出现红色,说明阳极附近显酸性,证明阳极附近产生了硫酸;利用阴极附近出现红色固体,证明阴极附近产生铜。


2.4 电解氯化铜溶液
2.4.1 实验仪器及药品
(1)实验仪器:自制Y型玻璃管原电池、铂丝、铁钉、玻璃培养皿、导线若干
(2)实验试剂:CuCl2溶液、pH试纸、淀粉碘化钾试纸
2.4.2 实验装置

图16 电解后铁钉电极上的情况
2.4.3 实验步骤
(1)与图9接法相同。
(2)将铂丝紧靠淀粉碘化钾试纸,铁钉紧靠pH试纸。
(3)向事先准备好的玻璃培养皿中加入几滴氯化铜溶液,然后进行电解(图16)。
(4)电解片刻后,接电源正极即阳极附近淀粉碘化钾试纸出现蓝色;接电源负极即阴极铁钉上出现红色固体,pH试纸无变化。
设计意图:利用阳极附近淀粉碘化钾试纸出现蓝色,说明阳极附近产生氯气;利用阴极附近出现红色固体,证明阴极附近产生铜。


通过以上实验,还可以得出阳极上阴离子的放电顺序:Cl->OH-;阴极上阳离子的放电顺序:Cu2+>H+。
【透过现象看本质】通过实验2.3和实验2.4,不仅可以判断出放电顺序,还可以完成粗铜精炼和电镀实验,在铁钉的表面镀一层保护层。根据实验现象,可以判断出粗铜和精铜应该放在什么极,加深学生对粗铜精炼的电极判断以及电极反应。另外,还可以利用电解原理,让学生设计一个简单的电镀实验——电镀金属,这样寓教于乐,可以激发学生浓厚的学习兴趣。
2.5 电解硫酸钠溶液
2.5.1 实验仪器及药品
(1)实验仪器:自制Y型玻璃管原电池、铂丝、铁钉、玻璃培养皿、导线若干
(2)实验试剂:硫酸钠溶液、pH试纸
2.5.2 实验步骤
(1)与图9接法相同。
(2)将铂丝、铁钉紧靠pH试纸。
(3)向事先准备好的玻璃培养皿中加入几滴硫酸钠溶液,然后进行电解。
(4)电解片刻后,接电源正极即阳极附近pH试纸变红;接电源负极即阴极附近pH试纸变蓝。
设计意图:利用阳极附近pH试纸变红色,证明阳极附近生成酸;利用阴极附近pH试纸变蓝色,证明阴极附近生成碱。


【透过现象看本质】本部分实验,用的是惰性电极铂丝作阳极,铁钉作阴极,分别发生氧化反应和还原反应,可以判断出氢离子和钠离子、氢氧根离子和硫酸根离子的放电顺序。还可以继续改变电极材料,比如将两极改为铁,根据实验现象判断出活泼金属作为阳极材料时,活泼金属会先于电解质溶液中的阴离子反应,这个内容在平时的教学中,学生是经常犯错的。对此,在本部分实验之后可以让学生分组讨论,设计证明活泼金属对电极反应的影响,这样可以加深学生对这部分知识的巩固和强化,做到发现问题、提出问题、解决问题,这样便可以解决考试中会遇到的问题。
3.实验反思
(1)在所学知识的基础上改进和开发学生实验,培养学生动手能力和创新能力,通过与Y型管的结合,可以将学生实验可操作化,仪器简约化,实验现象清晰化。
(2)在选择电解饱和食盐水的电极材料时,考虑过用2B铅笔的铅笔芯代替惰性电极作阳极。由于铅笔芯是石墨和黏土按照一定比例混合而成的,所含黏土的比例较高,导电效果较差,所以在试验过程中并没有达到预期效果——无法观察到阳极区的淀粉碘化钾试纸变蓝。
(3)笔者在网上购买到纯石墨电极作为阳极,观察到淀粉碘化钾试纸很快变蓝,效果明显,但是观察到另外一个反常的情况——阴极上pH试纸出现蓝色的时间不仅变长,而且蓝色效果也略微变差。
(4)笔者也试过用铜电极代替惰性电极,但是两电极都没有看到预期的蓝色。
(5)铂丝作阳极时,笔者也想过用pH试纸先变红后褪色来检验氯气的生成,但是看不到红色。
本次改进实验,是通过Y型管构成双液原电池,进而作为学生电源。学生互相讨论实验方案,并自己动手构建更加简单可行的双液原电池,并分组进行电解实验。一方面,锻炼了学生的动手能力,提高学生的学习兴趣。另一方面,在每个实验的后面,配套几道练习题,便真正做到了通过微型实验锻炼学生动手能力,同时通过练习巩固本实验所要达到的效果。

