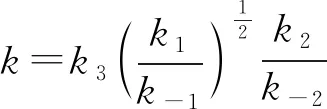化学反应的快与慢
——高考化学中的速率方程和阿累尼乌斯公式
2023-04-16赵鑫光
赵鑫光
(长春吉大附中实验学校)
化学反应原理综合题是高考化学的必考题型,该题目的设问多变,难度较大,内容覆盖面广、综合性强。命题背景与生产生活联系紧密,考查内容较为新颖,能够很好地体现出化学学科的价值。试题经常给出陌生公式及陌生图像作为信息,能够较好的考查学生综合能力和化学学科核心素养。本文较为深入地探讨化学反应速率的相关知识,介绍速率方程和阿累尼乌斯公式的基本内容并配以例题,以期对高三学生的总复习有所帮助。
一、基元反应和非基元反应
化学反应从反应历程角度可以分为基元反应和复杂反应,复杂反应也叫非基元反应。
1.基元反应
基元反应就是能代表反应机理,由反应物微粒(可以是分子、原子、离子或自由基)在碰撞中相互作用直接转化得到产物的化学反应,例如:

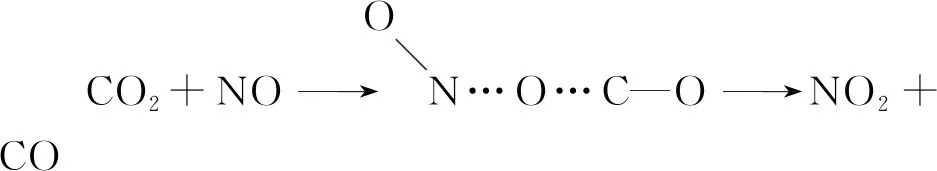
2.非基元反应




式中M表示只参加反应物微粒碰撞而不参加反应的其他分子,如器壁,它只起转移能量的作用。
3.反应分子数
在基元步骤中,发生反应所需的最少分子数目称为反应分子数。根据反应分子数可将反应分为单分子反应、双分子反应和三分子反应三种,如:



反应分子数不可能为零或负数、分数,只能为正整数,且只有上面三种数值,从理论上分析,四分子或四分子以上的反应几乎是不可能存在的。
二、速率方程和速率常数(质量作用定律)
1.速率方程
大量实验表明,在一定温度下,增大反应物的浓度能够增加化学反应速率。那么化学反应速率与反应物浓度之间存在着何种定量关系呢?人们在总结大量实验结果的基础上,提出了质量作用定律:在恒温条件下,基元反应的速率与各种反应物浓度以反应分子数为幂的乘积成正比。

质量作用定律的数学表达式为:v=k·ca(A)·cb(B)称为该反应的速率方程。
若该反应为可逆反应,则其正逆反应的速率方程分别为
v正=k正·ca(A)·cb(B);
v逆=k逆·cg(G)·ch(H)

(1)v正=k正·c(N2O4),v逆=k逆·c2(NO2)(c代表物质的量浓度)
(2)v正=k正·p(N2O4),v逆=k逆·p2(NO2)(p代表压强)
(3)v正=k正·x(N2O4),v逆=k逆·x2(NO2)(x代表物质的量分数)


对于该复杂反应来说,决定总反应速率的是基元反应中反应速率最慢的一步,则该反应的速率方程为:v=k·c(A2),而不是v=k·c2(A)·c(B)。
2.速率常数
在上面的速率方程中,k称为速率常数,其意义是当各反应物浓度均为1 mol/L时的反应速率。
对于速率常数k,应注意以下几点:
①速率常数k取决于反应的本质。当其他条件相同时快反应通常有较大的速率常数,k小的反应在相同的条件下反应速率较慢。
②速率常数k与浓度、压强无关。
③k随温度而变化,温度升高,k值通常增大。
④k是有单位的量,k的单位随反应级数的不同而不同。
3.反应级数
由速率方程可以看出化学反应的速率与其反应物浓度的定量关系,对于一般的化学反应:

其速率方程一般可表示为:v=k·cm(A)·cn(B)
式中的c(A)、c(B)表示反应物A、B的浓度,a、b表示A、B在反应方程式中的计量数。m、n分别表示速率方程中c(A)和c(B)的指数。
速率方程中,反应物浓度的指数m、n分别称为反应物A和B的反应级数,各组分反应级数的代数和称为该反应的总反应级数。
总反应级数=m+n
通过实验可以得到许多化学反应的速率方程,如表1所示:
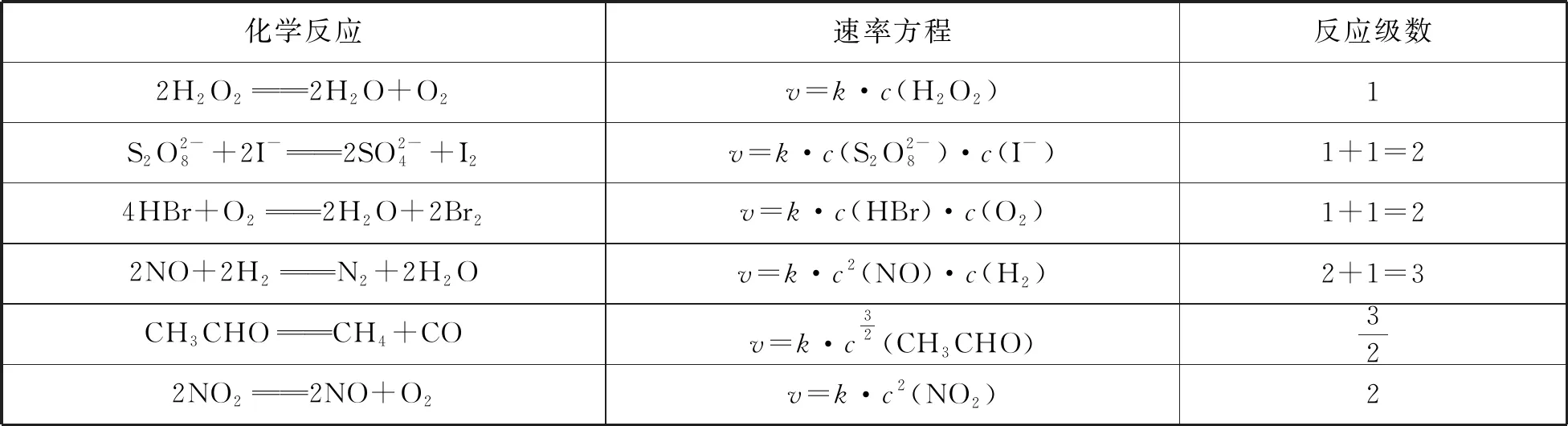
表1
可见,反应级数的大小,表示浓度对反应速率的影响程度,级数越大,速率受浓度的影响越大。
若为零级反应,则表示反应速率与反应物浓度无关。某些表面催化反应,例如氨在金属钨表面上的分解反应,其分解速率在一定条件下与氨的浓度无关,这就属于零级反应。
观察上表中六个反应的反应级数,并与化学方程式中反应物的计量数比较可以明显地看出:反应级数不一定与计量数相符合,因而对于非基元反应,不能直接由反应方程式推导出反应级数。
另外,还应明确反应级数和反应分子数在概念上的区别:①反应级数是根据反应速率与各物质浓度的关系来确定的;反应分子数是根据基元反应中发生碰撞而引起反应时所需的分子数来确定的。②反应级数可以是零、正整数、负整数和分数;反应分子数只可能是一、二、三。③反应级数是对宏观化学反应而言的;反应分子数是对微观上基元步骤而言的。

实际上分三步进行:

慢反应(决速步骤)


实验测得速率方程为v=k·c(N2O5)
它是一级反应,不是二级反应。
4.速率常数k正、k逆与化学平衡常数K的关系

(1)当v正和v逆没有注明具体的物质时,如v正=k正c(N2O4)和v逆=k逆c2(NO2),则建立平衡关系式时不需要考虑化学式前面的计量数,平衡时v正=v逆,则有k正c(N2O4)=k逆c2(NO2),
(2)当v正和v逆注明了具体的物质,如v(N2O4)正=k正c(N2O4),v(NO2)逆=k逆c2(NO2),则建立平衡关系式时要考虑化学式前面的计量数,平衡时2v(N2O4)正=v(NO2)逆。
则有2k正c(N2O4)=k逆c2(NO2),
三、阿累尼乌斯(Arrhenius)公式
1.阿累尼乌斯公式的表达式及意义
1889年,阿累尼乌斯在大量实验结果的基础上,总结出了速率常数k与热力学温度T的经验公式:

式中:
k——温度为T时的速率常数;
A——指前因子,也称为阿累尼乌斯常数,单位同k;
Ea——活化能,一般可视为与温度无关的常数,其单位为J/mol或kJ/mol;
R——气体摩尔常数,其数值为8.314 J/(mol·K);
T——绝对温度(热力学温度),单位为K;
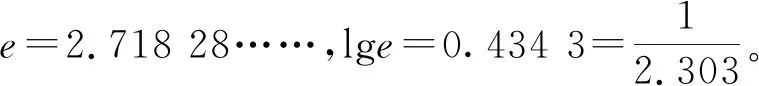


应用阿累尼乌斯公式讨论问题时,可以认为Ea、A不随温度变化而变化。但由于T在指数上,故对k的影响较大。
根据阿累尼乌斯公式,知道了反应的Ea和某温度T1时的k1,即可求出任意温度T2时的k2。由对数式:

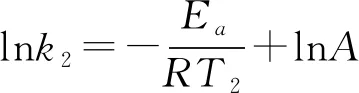
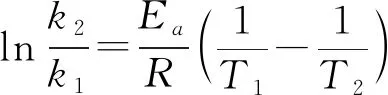
2.活化能
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能。活化分子的最低能量与反应物分子平均能量的差值即为活化能。
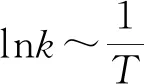

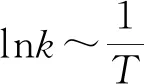
四、用速率方程和阿累尼乌斯公式解释化学反应速率的影响因素

v正=k正·ca(A)·cb(B);
v逆=k逆·cg(G)·ch(H)
阿累尼乌斯经验公式的指数式表达式为
(1)由于a、b、g、h均为正值,故增大反应物A或B浓度,正反应速率增大;增大生成物G或H浓度,逆反应速率增大;减小反应物A或B浓度,正反应速率减小;减小生成物G或H浓度,逆反应速率减小。
(2)若A、B、G、H均为气体,且a+b>g+h,即正反应的反应级数大于逆反应的反应级数,若通过缩小体积增大压强时,反应物浓度增大对正反应速率的影响大于生成物浓度增大对逆反应速率的影响,此时v正和v逆均增大,且v正增大的更多,该反应正向移动,即向气体体积减小的方向移动;若通过增大体积减小压强时,反应物浓度减小对正反应速率的影响大于生成物浓度减小对逆反应速率的影响,此时v正和v逆均减小,且v正减小的更多,该反应逆向移动,即向气体体积增大的方向移动;即压强的改变对气体体积减小方向的速率影响更大。
(3)根据阿累尼乌斯公式,由于正、逆反应的活化能Ea(正)与Ea(逆)为正值,气体摩尔常数R为正值,故升高温度k正和k逆均增大,若反应为吸热反应,即Ea(正)>Ea(逆),升高相同温度时,k正增大的更多,故反应向吸热方向移动;降低相同温度时,k正减小的更多,故反应向放热方向移动;即温度的改变对吸热方向的速率影响更大。
五、典型例题

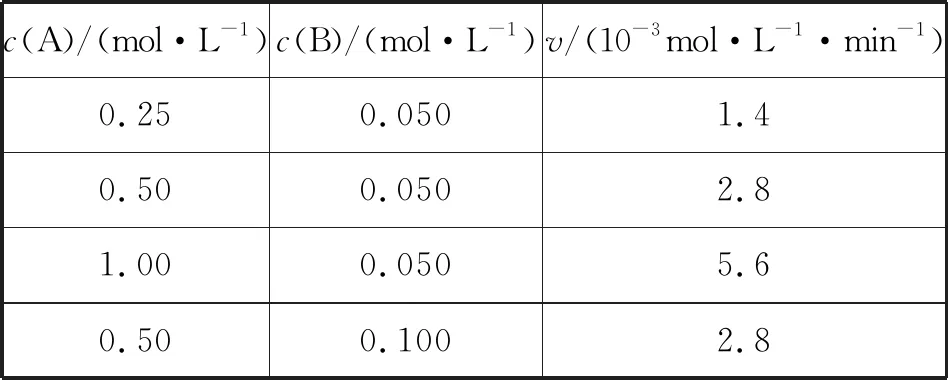
表2
下列说法正确的是
( )
A.速率方程中的m=1、n=1
B.该反应的速率常数k=2.8×10-3min-1
C.增大反应物浓度,k增大导致反应的瞬时速率加快
D.在过量的B存在时,反应掉87.5%的A所需的时间是375 min


已知该反应的v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2)(k正、k逆分别为正、逆向反应速率常数)。






净反应速率v=v正-v逆=k正·p2(NO)·p2(CO)-k逆·p(N2)·p2(CO2),其中k正、k逆分别为正、逆反应的速率常数,p为气体的分压(分压=总压×物质的量分数)。
(1)升高温度,k正-k逆________(填“增大” “减小”或“不变”);

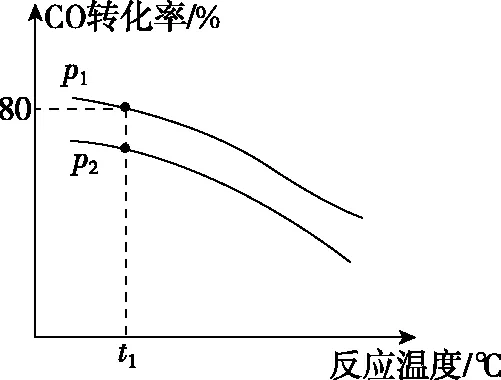
【解析】(1)根据图像升高温度,CO转化率减小可知,该反应为放热反应,则升高温度,正反应速率和逆反应速率均增大,但逆反应速率增大的更快,即k逆增大的程度大于k正增大的程度,因此k正-k逆减小。
(2)已知该反应为正向气体体积减小的反应,则压强越大,CO转化率越高,故p1>p2。根据题意,设起始时CO和NO的物质的量均为1 mol,则在压强为p1、温度为t1℃条件下平衡时CO的转化量为0.8 mol,列出三段式:
起始(mol) 1 1 0 0
转化(mol) 0.8 0.8 0.4 0.8
平衡(mol) 0.2 0.2 0.4 0.8

设N2的体积分数为20%时,CO转化量为2xmol,列出三段式:
起始(mol) 1 1 0 0
转化(mol) 2x2xx2x
平衡(mol) 1-2x1-2xx2x



(快平衡)
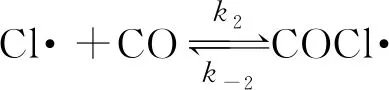
(快平衡)

(慢反应)
试指出反应速率方程中的k与反应机理中的速率常数(k1,k-1,k2,k-2,k3)之间的关系________。
【解析】在上述反应机理中,第三步反应是慢反应,整个反应的速率由第三步反应决定,所以
v=k3c(COCl·)·c(Cl2)
①
根据题意可知,第一步反应和第二步反应都快速建立平衡,由它们的平衡式可得:
②
③
可见由这一机理导出的速率方程与实验得出的速率方程相符合。