牦牛早期胚胎核旁斑点形成及对后续发育的影响
2023-04-11潘阳阳王靖雷王萌王立斌张倩陈睿张甜甜崔燕徐庚全樊江峰余四九
潘阳阳,王靖雷,王萌,王立斌,张倩,陈睿,张甜甜,崔燕,徐庚全,樊江峰,余四九
牦牛早期胚胎核旁斑点形成及对后续发育的影响

1甘肃农业大学动物医学院,兰州 730070;2甘肃省牛羊胚胎工程技术研究中心,兰州 730070
【目的】明确牦牛早期胚胎发育过程中核旁斑点形成的关键时期,确定其参与形成长链非编码RNA(Long non-coding RNA,LncRNAs),探索核旁斑点形成对后续胚胎发育能力的影响及调控机制。【方法】体外受精生产牦牛胚胎,DAPI染色标记结合核旁斑点结构蛋白1(paraspeckle Protein 1,)mRNA实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测确定牦牛早期胚胎发育核旁斑点形成关键时期,免疫荧光技术验证胚胎PSPC1蛋白表达水平;qRT-PCR检测核旁斑点形成相关LncRNAs核旁斑点组装转录因子1(encoding nuclear paraspeckle assembly transcript 1,)、共激活因子相关的精氨酸甲基转移酶1(coactivator associated arginine methyltransferase 1,)及54 kD核结合蛋白(non-POU domain containing octamer-binding protein,)mRNA在各时期胚胎中表达水平;RNA干扰技术抑制合子mRNA水平,比较后续各阶段胚胎发育率,通过分析囊胚细胞总数、滋养层细胞数(trophoblast cells,TE)、内细胞团数(inner cell mass,ICM)评估囊胚质量;检测对照组和mRNA干扰组囊胚中B-细胞淋巴瘤/白血病-2原癌基因(B-celllymphoma/leukemia-2,Bcl-2)和B细胞淋巴瘤/白血病基因伴随蛋白x(B-cell lymphoma/leukemia associatedx protein,Bax)表达水平。【结果】(1)在不同发育阶段胚胎细胞的细胞核均可观察到核旁斑点,但2-细胞和4-细胞时期胚胎细胞核中核旁斑点更为清晰,2-细胞至桑椹胚阶段mRNA呈现高水平表达,其中4-细胞到桑椹胚阶段mRNA水平最高,PSPC1蛋白荧光强度在此阶段最强。(2)、及mRNA均在2-细胞到桑椹胚阶段呈现高水平表达,其中和在4细胞时期水平最高,在2-细胞到桑椹胚3个阶段表达水平差异不显著(>0.05)。(3)mRNA干扰组桑椹胚与囊胚发育率均显著降低,且桑椹胚发育率降低幅度高于囊胚,mRNA干扰组囊胚细胞总数显著低于对照组,其中以ICM细胞数降低为主,TE细胞数在两组之间差异不显著。(4)mRNA干扰处理组囊胚中促细胞凋亡因子mRNA和蛋白均显著增加,抑凋亡相关因子mRNA和蛋白降低,且囊胚中内细胞团发生裂解。【结论】牦牛早期胚胎发育核旁斑点形成的关键时期为2-细胞至桑椹胚阶段,其中主要集中在4-细胞时期,且PSPC1、NEAT1、CRAM1、p54nrb在核旁斑点形成时期呈高水平表达。干扰牦牛合子mRNA导致后续胚胎发育能力降低,并通过诱导ICM凋亡降低囊胚质量,影响囊胚中细胞命运决定。
牦牛;核旁斑点;细胞命运;细胞凋亡;长链非编码RNA(LncRNAs)
0 引言
【研究意义】核旁斑点为核小体的一种,是在哺乳动物细胞核内发现的一种新型亚细胞器结构[1],其通过长链非编码RNA(long non-coding RNA,LncRNAs)介导形成,参与细胞核重定位、染色质重组、组蛋白修饰等多种生理应答,也可滞留细胞核内RNA,调控特定基因表达,阻止某些RNA与靶标蛋白结合,限制相关生物学功能,如影响小鼠早期胚胎发育细胞分化、抵抗外源病原体感染、调节机体和细胞适应低氧环境应激等[2-4]。以不同哺乳动物早期发育胚胎为试验材料,探索核旁斑点形成关键时期,明确其形成分子机制及对后续胚胎发育能力的调控,有助于从环境应激和细胞命运决定等理论层面改善胚胎发育质量,促进家畜体外胚胎生产、胚胎干细胞分离培养等技术的发展。【前人研究进展】核旁斑点最早于2002年发现于Hela细胞[5],随后在多种哺乳动物组织和细胞均发现存在核旁斑点,由于其最早发现在细胞核染色体空隙中,因此被命名为核旁斑点(paraspeckles),在这些细胞核特殊结构中发现了一种新的蛋白被称为核旁斑点蛋白1(paraspeckle protein 1,PSPC1),目前许多学者通过PSPC1免疫标记分析核旁斑点数量及大小[6]。研究发现有大量LncRNAs位于该特殊细胞核结构,是其结合蛋白关键位置,且核旁斑点形成依赖于LncRNAs合成,其可作为开放的细胞核系统,进行分子自由交换[6]。LncRNAs为核旁斑点结构建立了基本支架,主要以核旁斑点组装转录因子1(encoding nuclear paraspeckle assembly transcript 1,)为主,其持续转录是维持核旁斑点结构完整性的必要条件,也可通过核旁斑点调控其他基因转录。和其协同因子54 kD核结合蛋白(Non-POU domain containing octamer- binding protein,)有助于共激活因子相关精氨酸甲基转移酶1(coactivator associated arginine methyltransferase 1,)和核旁斑点之间结合,导致蛋白修饰出现差异,相反CARM1又影响核旁斑点形成[7-8]。除此之外,通过干细胞研究发现可调控关键多能性细胞因子八聚体结合转录因子(octamer-binding transcription factor 4,OCT4)转录,其在哺乳动物早期胚胎发育过程参与细胞命运决定调控。低氧条件下,细胞可通过低氧诱导因子家族(hypoxia inducible factors,HIFs)介导而表达NEAT1,其再作为调节子诱导核旁斑点形成,提高细胞对低氧适应性,当氧气浓度恢复正常时核旁斑点消失[9]。利用毒性干扰素处理动物细胞,蛋白酶体可导致NEAT1聚集点成熟核旁斑点释放延迟,进而调控B-细胞淋巴瘤/白血病-2原癌基因(B-celllymphoma/ leukemia-2,Bcl-2)和B细胞淋巴瘤/白血病基因伴随蛋白x(B-cell lymphoma/leukemia associatedx protein,Bax)表达促进细胞凋亡[10]。【本研究切入点】牦牛因长期生活在青藏高原,独特的生殖环境影响机体相关基因和蛋白表达,使其具备独特生殖调控特性。已有研究显示,牦牛胚胎或生殖细胞体外发育过程受低氧诱导因子(hypoxia-inducible factor, HIF-1α)[11]、热休克蛋白(heat shock proteins, HSPs)[12]、冷诱导RNA结合蛋白(cold inducible RNA-binding protein, CIRP)等高寒低氧相关因子调控[13]。在表皮生长因子(epidermal growth factor, EGF)和胰岛素生长因子(insulin-like growth factor, IGF)作用下,不仅可以通过减少细胞凋亡提高牦牛体外胚胎发育能力,而且可通过调控高寒环境相关因子影响囊胚质量,改变囊胚中不同命运细胞分布[14]。可见高寒低氧环境哺乳动物胚胎体外发育过程细胞分化、囊胚质量和囊胚附植能力的体外调控机制均具有自身独特性[13, 15-16]。【拟解决的关键问题】本研究以附植前不同阶段的牦牛胚胎为试验材料,探索高寒哺乳动物早期胚胎发育核旁斑点的形成关键时期,分析其对胚胎发育能力的影响及其潜在调控机制,为进一步解析哺乳动物胚胎发育过程中核旁斑点形成机制和生理功能提供关键信息。
1 材料与方法
1.1 主要试剂
M199卵母细胞成熟培养液,促卵泡生成素(follicle- stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)和雌二醇(Estradiol,E2)均购自美国Sigma公司,G1/G2液购自瑞典Vitrolife公司;CDX2(ab88129)、Bax(ab32503)、PSPC1(ab104238)和Bcl-2(ab117115)一抗购自Abcam公司;二抗均购自北京博奥森生物公司,微量细胞RNA提取、cDNA合成试剂盒购自美国Invitrogen公司、SYBR GreenⅡ试剂盒购自Takara生物公司,细胞蛋白提取试剂盒购自北京英文特生物技术公司,试验中所用到的其他试剂均购买于南京碧云天生物公司。
1.2 牦牛卵母细胞体外成熟培养与胚胎生产
牦牛卵巢于2020年10—11月采集于甘肃省临夏自治州牛羊屠宰场,采集卵巢置于30—35℃含有双抗的生理盐水中,4 h内带回实验室,用预热生理盐水冲洗3—5遍,从直径大小约为5—8 mm卵泡中抽取牦牛卵母细胞,体视显微镜下筛选形态完整的卵丘卵母细胞复合体(cumulus-oocyte complexes,COCs),清洗3遍,参照前期建立的牦牛卵母细胞成熟培养方法与体系进行体外成熟培养[15]。24 h后取出成熟COCs生产体外受精胚胎。
取出2—4支牦牛冻精,37℃温水快速水浴解冻,上浮法处理冻精并调整精子密度至约3×106个/mL,转移到四孔板,每孔约400 µL,并用200 µL矿物油覆盖。将成熟COCs用受精液清洗3—5次后,转移到含有精子的四孔板,每孔约40枚COCs,培养箱中共孵育16 h。取出COCs至预热DPBS液,吹打脱除卵丘细胞,将合子移入G1液,清洗3遍,每100 µL G1液微滴移入20枚合子,置于条件为38℃、5% CO2的细胞培养箱,96 h后移入G2液继续培养,分别在受精完成后12、36、48、96、168 h收集合子、2-细胞、4-细胞、桑椹胚和囊胚(图1)用于后续试验。
1.3 合子PSPC1 mRNA干扰
根据Genbank 公布的牛mRNA序列(NM_001075277.1),利用siDirect version 2.0软件设计筛选出3条干扰mRNA序列siRNA(表1),由上海吉玛制药生物技术公司合成。合子培养12 h,先后选取240枚形态完整合子(3条siRNA组+对照组,每组20枚胚胎,3个重复),置于含有7.5 µg·mL-1细胞松弛素B和5 %血清的D-PBS微滴,50枚/微滴,矿物油覆盖后继续37 ℃平衡10 min,利用显微操作仪将约0.1 µL含有siRNA(100 pg)核酸溶液注射到合子内。siRNA注射结束后将合子清洗3遍,按照每100 µL G1液20枚胚胎培养48 h,弃掉未卵裂胚胎,调整到20枚/100 µL后继续培养,96 h后检测桑椹胚mRNA表达水平确定最优siRNA,再设最优siRNA处理组和对照组,每组200枚胚胎,3个重复继续培养,于96和168 h统计桑椹胚与囊胚发育率,囊胚继续用于后续试验。

A:合子;B:2-4细胞胚胎(黑色箭头);C:4细胞-桑椹胚阶段细胞胚胎;黑色箭头为4-细胞胚胎,蓝色箭头为桑葚胚;D:囊胚(黑色箭头)
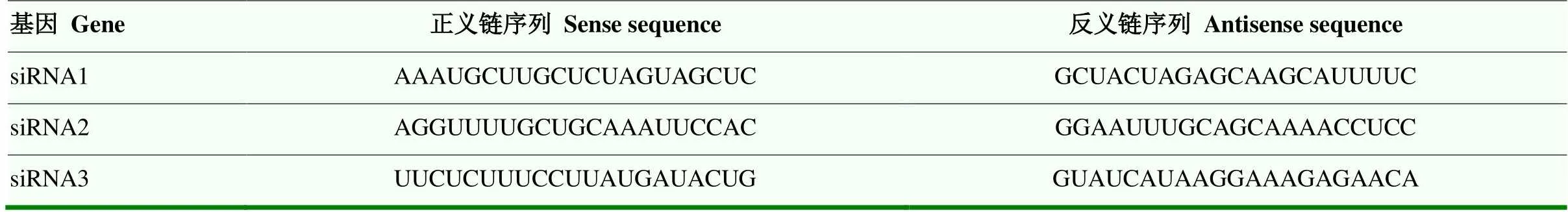
表1 干扰牦牛PSPC1 mRNA的siRNAs信息
1.4 核旁斑点的观察与胚胎发育能力统计
对照组中收集不同发育时期胚胎各3枚,洗涤3遍后用荧光染色固定液25 ℃作用约1 h,清洗3遍,用含有0.25%TritonX-100荧光染色封闭液25 ℃作用1 h,清洗3遍,用含有2.5 ng·mL-1DAPI 的PBS避光25 ℃作用3 min,清洗3遍,将胚胎转移到载玻片,GE DeltaVision Elite活细胞工作站检测胚胎细胞核形态。在收集对照组胚胎时,根据图1形态学观察,以处理后4-细胞胚胎数为基数,统计最优siRNA干扰mRNA组和对照组桑椹胚发育率,以桑椹胚为基数统计两组囊胚率。
1.5 不同时期胚胎中PSPC1、NEAT1、CARM1和P54nrb检测
1.5.1 不同时期胚胎中、、和基因检测 收集对照组各发育时期胚胎,每个时期10枚胚胎,根据微量细胞与胚胎RNA提取试剂盒(Invitrogen)说明提取mRNA,按照cDNA合成试剂盒说明合成cDNA,-20 ℃保存备用。
参照Genbank公布的牛mRNA和、和序列设计引物,具体序列信息和qRT-PCR反应条件见表2。反应体系为cDNA 1.25 µL,上、下游引物各0.6 µL,使其终浓度为0.25 μmol·mL-1,SYBR GreenⅡ 荧光定量PCR Mix(2×)10 µL,用ddH2O调整最终体积为20 µL,放入Roche 480实时荧光定量RCR仪器。反应条件为:95 ℃预变性20 s,95 ℃变性10 s,退火 10 s(反应温度见表2),72 ℃延伸10 s,共40个循环,-actin作为参照基因,采用相对定量法计算基因表达水平,合子作为对照组[17]。

表2 试验所用引物信息表
1.5.2 不同时期胚胎中PSPC1蛋白检测 根据表达水平检测结果,采用荧光免疫检测其高表达时期PSPC1蛋白表达与定位,每个时期取3枚胚胎,洗涤3遍后用荧光免疫染色固定液25 ℃固定约1 h,用含有0.25%TritonX-100的荧光染色封闭液25 ℃作用2 h,加入PSPC1一抗(1﹕400)4 ℃过夜孵育,清洗3遍,用AlexaFluor488标记的二抗25 ℃孵育2 h,清洗3遍,用2.5 ng·mL-1DAPI 避光25 ℃作用3 min,清洗3遍,GE DeltaVision Elite活细胞工作站检测胚胎中PSPC1蛋白表达。
1.6 囊胚细胞数统计与细胞凋亡相关因子检测
1.6.1 囊胚细胞数统计 最优siRNA干扰mRNA处理组和对照组中各选囊胚5枚,参照1.5.2 PSPC1蛋白染色方法,用CDX2(1﹕100)作为一抗标记囊胚,AlexaFluor488标记二抗与CDX2抗体反应,用2.5 ng·mL-1DAPI标记囊胚中所有细胞的细胞核,将不同荧光标记的囊胚置于GE DeltaVision Elite活细胞工作站成像,参照笔者前期研究方法分别计算囊胚中的内细胞团(inner cell mass,ICM)细胞数、滋养层细胞(trophectoderm,TE)数和总细胞数[15]。
1.6.2 不同处理组囊胚细胞凋亡相关因子检测 最优siRNA干扰mRNA处理组和对照组选取囊胚,每个重复选5枚,参照1.5.1方法提取囊胚mRNA,反转录合成第一链cDNA,利用qRT-PCR技术检测不同处理组囊胚中和mRNA表达水平,采用相对定量法进行比较两组之间表达差异。
选取siRNA干扰mRNA处理组和对照组选取囊胚各20枚,参照细胞蛋白提取试剂盒(英文特,SD-001)说明提取总蛋白,将蛋白与5×上样缓冲液SDS混合,水浴变性10 min,加入蛋白样品,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamidegel electrophoresis,SDS-PAGE)分离蛋白,电转膜至0.45 µmol·L-1的聚偏二氟乙烯膜(Polyvinylidene fluoride,PVDF)上,封闭2 h后在对应的PVDF膜上加入Bax和Bcl抗体,4 ℃过夜孵育,清洗3遍,用辣根过氧化物酶(horse radish peroxidase,HRP)标记二抗37 ℃作用1 h,清洗3遍,采用电化学发光(electrochemiluminescence,ECL)试剂在蛋白成像仪(Tanon 2500)内曝光,拍摄清晰蛋白条带,根据蛋白条带光密度采用相对定量方法计算比较蛋白表达差异。
同时参照1.5.2 PSPC1蛋白染色方法,先后用Bax(1﹕500)和Bcl-2(1﹕800)抗体作为一抗孵育囊胚,在分别用AlexaFluor488和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记二抗与Bax和Bcl-2抗体反应,用2.5 ng·mL-1DAPI标记囊胚中所有细胞的细胞核,将不同荧光标记囊胚置于GE DeltaVision Elite活细胞工作站成像,观察凋亡相关因子表达水平与定位。
1.7 数据分析
采用SPSS16.0数据分析软件对试验结果进行单因素方差分析,不同处理组桑椹胚发育率和囊胚率分别以合子数和桑椹胚数为基数进行计算,每个处理组至少重复3遍,或至少选择3个样品。<0.05 表示差异显著,所有数据结果以“Mean ± SE”表示。
2 结果
2.1 牦牛胚胎早期发育核旁斑点形成观察
DAPI标记不同阶段的胚胎细胞核,GE DeltaVision Elite活细胞工作站荧光成像如图2所示:各阶段胚胎细胞核均可见细胞核小体,但2-细胞和4-细胞时期胚胎细胞核中的核小体更为清晰(图2-B、C)。

A:合子;B:2-细胞胚胎;C:4-细胞胚胎;D:桑椹胚;E:D图中红的区域;F:囊胚;红色箭头所指为核旁核斑
2.2 不同发育阶段牦牛胚胎PSPC1表达的变化
相对定量分析法比较不同发育阶段牦牛胚胎中mRNA表达水平如图3-A所示:牦牛胚胎发育2-细胞至桑椹胚阶段mRNA呈现高水平表达,显著高于合子阶段和囊胚阶段,其中桑椹胚和4-细胞阶段胚胎mRNA表达水平最高,其表达水平分别为合子时期的3.54 ± 0.62和3.52 ± 0.26倍,且两者差异不显著(>0.05),其次为2-细胞阶段胚胎,表达水平为合子时期2.48 ± 0.08倍,囊胚mRNA表达水平略高于合子的表达水平,但两者差异不显著(>0.05)。
根据不同阶段胚胎mRNA表达水平检测结果,本研究采用免疫荧光技术检测合子、2-细胞、4-细胞和桑椹胚各阶段胚胎PSPC1蛋白表达水平,结果如图4所示:各阶段胚胎中均可检测到PSPC1蛋白,但4-细胞和桑椹胚阶段胚胎中荧光强度最强,合子中仅呈现少量微弱荧光;在各阶段胚胎中分裂细胞的整个细胞核和细胞质均可表达PSPC1蛋白,但主要以细胞核中的强荧光为主。
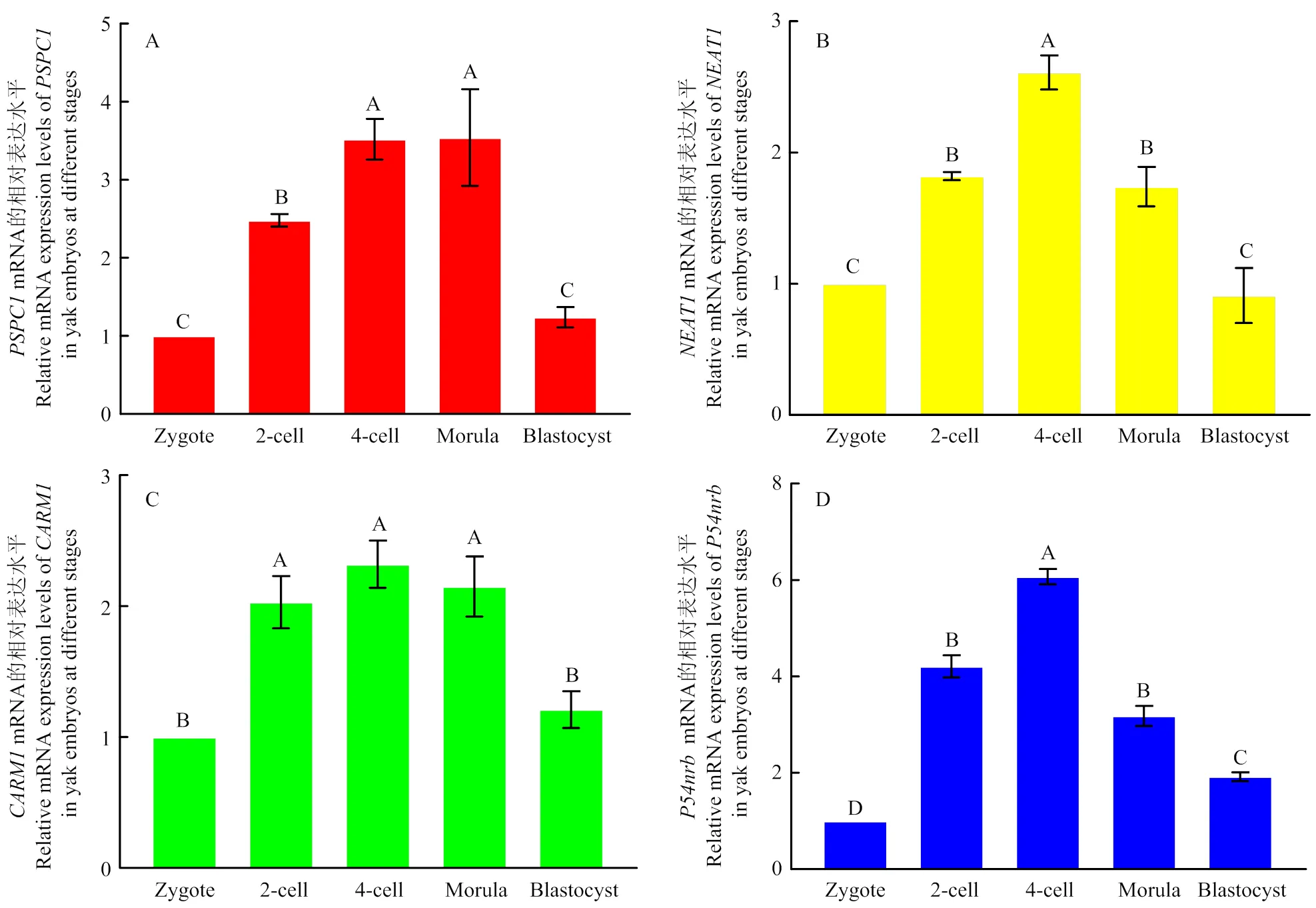
A: PSPC1; B: NEAT1; C: CARM1; D: P54nrb;误差线上不同的字母表示差异极显著(P<0.05); 相同的字母表示差异不显著(P>0.05)
2.3 核旁斑点形成关键时期NEAT1、CARM1和P54nrb的表达
参照2.1和2.2的结果,采用qRT-PCR技术检测合子、2-细胞、4-细胞、桑椹胚和囊胚中与核旁斑点形成相关的LncRNAs、及mRNA表达水平,如图3-B—D所示:、及mRNA均在2-细胞到桑椹胚阶段呈现高水平表达,其中在4细胞时期表达水平最高,显著高于2-细胞和桑椹胚时期(<0.05),2-细胞和桑椹胚时期的表达水平差异不显著(>0.05),合子和囊胚中的表达水平最低,两者差异不显著(>0.05)。在2-细胞到桑椹胚阶段呈现高水平表达,显著高于囊胚和合子阶段(<0.05),但其中2-细胞至桑椹胚3个阶段表达差异并不显著(>0.05)。4-细胞时期表达最高,其次为2细胞时期和桑椹胚时期,两者差异不显著(>0.05),囊胚时期表达水平显著低于合子阶段(<0.05)。
2.4 不同siRNAs干扰牦牛胚胎PSPC1 mRNA效果评价
受精12 h后,分别用siRNA1、siRNA2、siRNA3干扰合子mRNA,qRT-PCR检测桑椹胚中mRNA显示,3条siRNAs序列均可降低mRNA水平,其中siRNA1处理组mRNA水平最低,约为对照组的0.23 ± 0.01倍(图5),可作为干扰牦牛胚胎早期mRNA最佳siRNA。
2.5 核旁斑点形成对胚胎发育和囊胚质量的影响
根据2.4的研究结果,选取siRNA1处理组和对照组胚胎继续培养,比较后期胚胎发育能力。结果如表3所示,siRNA1处理组桑椹胚与囊胚发育率均显著降低,桑椹胚发育率由对照组的(75.22±3.32)%降低到siRNA1处理组的(58.26±1.86)%,两者之间差异显著(<0.05),囊胚率由对照组(41.17±2.23)%降低到siRNA1处理组(32.83±1.54)%,差异显著(<0.05),同时发现桑椹胚发育率降低幅度高于囊胚率降低幅度。

图4 牦牛不同阶段胚胎中PSPC1蛋白表达的免疫荧光检测
通过对囊胚内总细胞用DAPI标记、TE细胞用CDX2荧光标记,荧光显微镜下观察siRNA1处理组和对照组囊胚如图6所示,不同细胞计数比较见表4、图7,结果显示siRNA1处理组囊胚内细胞总数低于对照组(<0.05),其中主要以ICM细胞数低于对照组(<0.05),TE细胞数在两组之间的差异不显著(>0.05)。
2.6 核旁斑点形成对囊胚细胞凋亡的调控
qRT-PCR检测siRNA1处理组和对照组囊胚中、mRNA相对表达量,如图8所示:mRNA表达水平在siRNA1处理组囊胚中显著增加(<0.05),为对照组2.86 ± 0.16倍(图 8-A),而相对表达显著降低(<0.05),为对照组0.48 ± 0.106倍(图 8-B)。Bax、Bcl-2蛋白相对表达水平,如图9所示,siRNA1处理组囊胚中Bax 蛋白相对表达量增加,为对照组2.13 ± 0.24倍(图 9-B),而Bcl-2蛋白相对表达量降低,为对照组0.54 ± 0.11倍(图9-C)。

误差线上不同的字母表示差异极显著(p<0.05); 相同的字母表示差异不显著(p>0.05)
不同处理组囊胚中Bax和Bcl-2蛋白免疫荧光检测显示如图10,siRNA1处理组囊胚中促凋亡相关因子Bax的标记荧光强度显著高于对照组,抗凋亡蛋白Bcl-2荧光强度低于对照组,TE细胞和ICM细胞均可表达Bax和Bcl-2蛋白荧光,且Bcl-2荧光强度在siRNA1处理组囊胚ICM细胞显著降低,而Bax荧光在siRNA1处理组囊胚ICM显著增强。DAPI标记细胞核显示在siRNA1处理组囊胚内细胞部分细胞核发生裂解,形成细胞凋亡碎片。

图6 不同处理组牦牛囊胚的染色标记
3 讨论
3.1 早期胚胎发育核旁斑点形成与分子机制
目前细胞核荧光标记只能检测到细胞核亚单位结构[4],很多学者通过将其与核旁斑点主要组成蛋白荧光检测PSPC1相结合来确认核旁斑点是否形成[1,4]。附植前小鼠胚胎发育过程中核旁斑点与CARM1协同,主要聚集在2—4细胞时期胚胎细胞核中,敲除核旁斑点关键组成LncRNAs,胚胎发育在桑椹胚时期停止[18-19],表明哺乳动物胚胎发育早期核旁斑点对其后续发育能力具有重要的调控作用。HeLa细胞中及任何一个的缺失都会影响细胞核核旁斑点的形成[20]。本研究发现牦牛早期胚胎核旁斑点形成关键时间为2-细胞至囊胚时期,其中以4-细胞时期最为显著,该阶段CARM1和主要组成NEAT1及p54nrb mRNA的动态表达趋势与PSPC1具有相似性(图3),证实哺乳动物胚胎中核旁斑点形式时间存在物种差异性,但主要形成机制和组成不存在动物种属和细胞种类的差异,有些特殊细胞核旁斑点的形成还需要其他特定蛋白,如B淋巴细胞中的BCL11A,可介导PSPC1和p54nrb之间的相互作用[21]。

表3 干扰合子PSPC1 mRNA后胚胎发育能力
数据表示为:mean ± S.E.M (n=3),同一列中不同字母表示组间差异显著(<0.05),相同字母表示组间差异不显著(>0.05)。桑葚胚率:桑葚胚胎数量/4-细胞胚胎数量;囊胚率:囊胚数量/桑椹胚胚胎数量
Data was presented mean ± S.E.M (n=3), the letters (a, b) within a row for a particular parameter differs significantly(<0.05). The morula rate: number of morula/number of 4-cell embryo; the blastocyst rate: number of blastocyst/number of morula

表4 不同处理组第7天囊胚特征
数据表示为:mean ± S.E.M,同一列中不同字母表示组间差异极显著(<0.05),相同字母表示组间差异不显著(>0.05)
Data was presented mean ± S.E.M (n=5), the letters (a, b) within a row for a particular parameter differs significantly (<0.05)

*表示差异显著(P<0.05) Bars with * are significantly different (P<0.05)
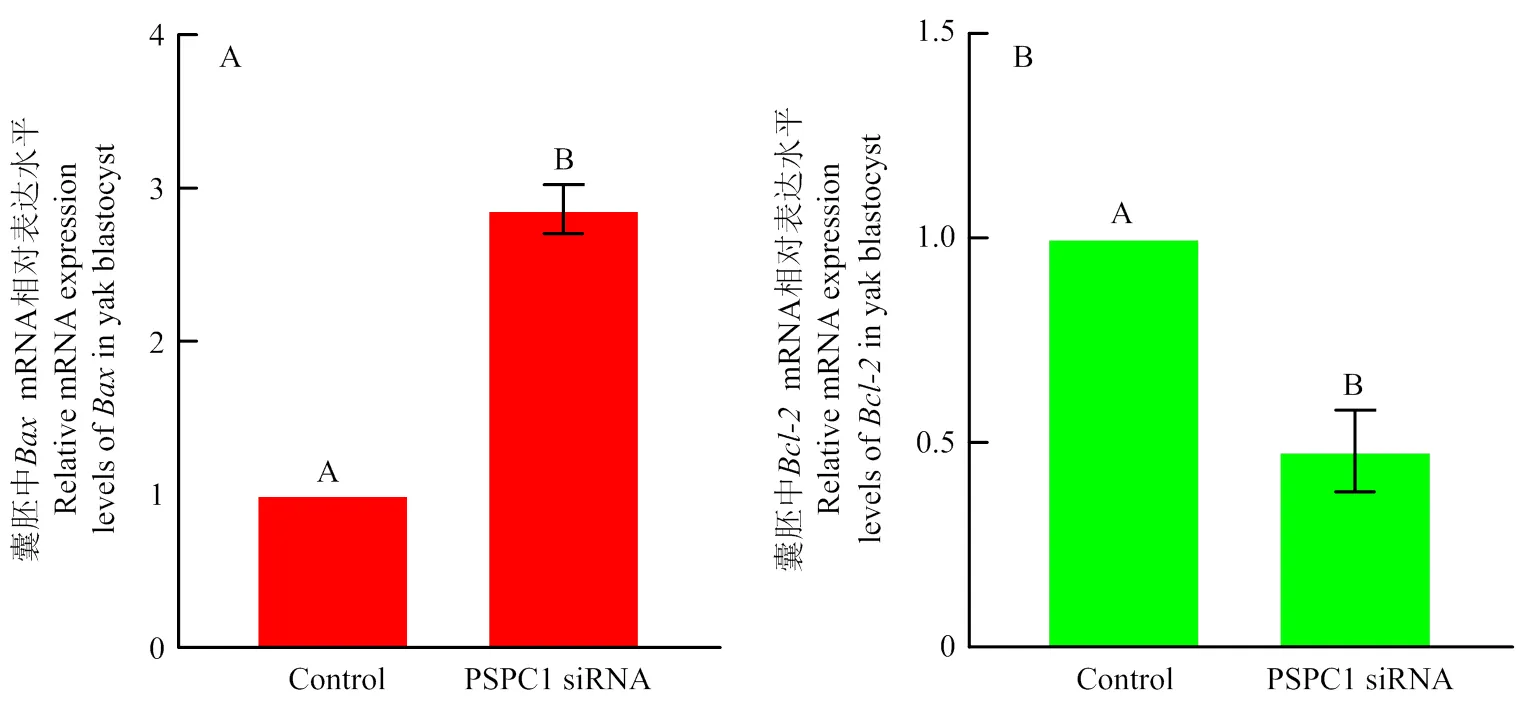
A: Bax; B: Bcl-2;误差线上不同的字母表示差异显著(p<0.05) A: Bax; B: Bcl-2; Bars with different letters are significantly different (p<0.05)

A:Bax与Bcl蛋白的检测; B:Bax相对表达水平; C: Bcl-2蛋白相对表达水平;误差线上不同的字母表示差异显著(p<0.05)

图10 不同处理组牦牛囊胚中Bax和Bcl-2蛋白免疫荧光标记
3.2 核旁斑点形成影响胚胎细胞命运决定
动物早期胚胎发育2细胞至桑椹胚时期是胚胎细胞定向分化和细胞命运决定的关键时期,但具体作用时间点需依据不同动物早期胚胎发育细胞命运决定关键时期研究结果而确定。敲除核旁斑点关键形成调控因子,小鼠胚胎中的CDX2表达水平上升,导致细胞向胚外层分化,影响胚胎细胞命运[22]。除此之外,发现癌细胞中核旁斑点组成因子受细胞多能性因子OCT4调控[23]。本研究干扰合子mRNA囊胚内的ICM细胞数显著减少(图6、7),证实早期核旁斑点形成与后续胚胎的细胞命运存在关联。不同处理组间TE细胞数差异不显著(图7),而CDX2作为TE细胞的关键标记因子[24],表明牦牛早期胚胎发育核旁斑点对TE细胞命运调控较低,可见不同物种及不同靶细胞之间细胞分子调控机制存在差异。
3.3 核旁斑点通过多种信号通路调节胚胎细胞凋亡
相关研究证实核旁斑点可通过多种信号通路调节细胞凋亡,当细胞凋亡启动时细胞核通过蛋白水解酶复合体抑制NEAT1位点成熟核旁斑点释放,导致其在染色体上延伸,影响其组装完成,占据了染色体上富含脯氨酸和谷氨酰胺的剪接因子(splicing factor proline and glutamine rich,SFPQ)和p54nrb的形成空间,进而细胞核内SFPQ和p54nrb水平显著降低[25-26]。已有研究证明SFPQ可通过诱导细胞坏死信号通路关键蛋白促进细胞凋亡,如干扰素刺激基因(interferon- stimulated genes,ISGs)、BCL-2结合元件[10, 26-27]。本研究中干扰牦牛mRNA,囊胚细胞凋亡水平显著增加(图8、9),导致该处理组ICM细胞数降低,Bax和Bcl-2蛋白的荧光定位证实囊胚中ICM和TE细胞凋亡均受早期胚胎核旁斑点影响,推测核旁斑点影响囊胚附植能力。癌细胞和神经元细胞中NEAT1通过p53或调控胞内miRNA表达影响细胞凋亡[28-29],miRNA上升时通过dsRNA反应修饰介导细胞凋亡,miRNA下降时,细胞凋亡的发生主要受ISG转录影响[30]。牦牛生殖调控中p53和miRNA介导多种信号影响精子生成和胚胎发育[31-33],但核旁斑点是否通过p53和miRNA调控其早期胚胎质量仍需相关研究证实。
3.4 牦牛胚胎核旁斑点形成与自身生理特性潜在联系
牦牛生长环境和自身生理结构具有独特性,其生长调控易受相关生理应激影响,如牦牛胚胎早期胚胎发育由于HIF-1α介导,使其具有较强的低氧适应性,且会影响后续细胞多能性因子如NANOG、OCT4和SOX2表达[34]。除胚胎外,相关研究显示HIF-1α在低氧应激刺激牦牛肺动脉平滑肌细胞时可促进细胞增殖[35],进一步证明HIF-1α对牦牛生理调控至关重要。核旁斑点作为新发现的调节机体和细胞适应低氧等环境应激的亚细胞核结构,主要通过HIF与NEAT1相互作用阻碍核内蛋白,也可通过p54nrb介导其他因子调控细胞低氧适应性,如细胞黏附分子F11R[36]。低氧条件下NEAT1参与核旁斑点形成调控[9],当低氧浓度恢复正常水平时,核旁斑点消失[10],低氧又作为胚胎早期胚胎发育关键影响因素,参与后续胚胎细胞的分化[37]。证实哺乳动物胚胎发育过程中核旁斑点与低氧应激存在互相调控关系。本研究以牦牛的早期发育胚胎为试验材料,探索核旁斑点形成机制,有效的将低氧应激和核旁斑点形成结合在一起,有助于揭示哺乳动物早期胚胎发育核旁斑点与低氧调控的相互关系。
4 结论
牦牛早期胚胎发育核旁斑点形成的关键时期为2-细胞至桑椹胚阶段,其中主要集中在4-细胞时期,且PSPC1与、和在牦牛早期胚胎发育核旁斑点形成时期呈现高水平表达。干扰合子mRNA表达可降低后续胚胎发育能力,以4-细胞至桑椹胚发育率降低为主,同时其可降低囊胚中ICM细胞数及细胞凋亡水平,影响囊胚质量(图11)。研究结果为进一步探索核旁斑点参与哺乳动物早期胚胎发育的调控制提供了科学依据,有助于以核旁斑点为靶点,改善牦牛早期胚胎的发育能力和胚胎质量,促进牦牛体外胚胎生产技术的发展。

牦牛早期胚胎发育核旁斑点形成时期为2细胞至桑椹胚阶段,且PSPC1与NEAT1、CRAM1和p54nrb呈高水平表达;干扰PSPC1mRNA,降低桑椹胚发育率,增加囊胚细胞凋亡,降低ICM细胞数
[1] MAO Y S, ZHANG B, SPECTOR D L. Biogenesis and function of nuclear bodies. Trends in Genetics, 2011, 27(8): 295-306. doi:10. 1016/j.tig.2011.05.006.
[2] FOX A H, LAMOND A I. Paraspeckles. Cold Spring Harbor Perspectives in Biology, 2010, 2(7): a000687. doi:10.1101/cshperspect. a000687.
[3] FRANK S, AHUJA G, BARTSCH D, RUSS N, YAO W J, KUO J C C, DERKS J P, AKHADE V S, KARGAPOLOVA Y, GEORGOMANOLIS T, MESSLING J E, GRAMM M, BRANT L, REHIMI R, VARGAS N E, KUROCZIK A, YANG T P, SAHITO R G A, KURIAN L. yylncT defines a class of divergently transcribed lncRNAs and safeguards the T-mediated mesodermal commitment of human PSCs. Cell Stem Cell, 2019, 24(2): 318-327.e8. doi:10.1016/j.stem.2018.11.005.
[4] WANG Y, CHEN L L. Organization and function of paraspeckles. Essays in Biochemistry, 2020, 64(6): 875-882. doi:10.1042/EBC20200010.
[5] FOX A H, LAM Y W, LEUNG A K L, LYON C E, ANDERSEN J, MANN M, LAMOND A I. Paraspeckles: a novel nuclear domain. Current Biology, 2002, 12(1): 13-25. doi:10.1016/S0960-9822(01) 00632-7.
[6] MAO Y S, SUNWOO H, ZHANG B, SPECTOR D L. Direct visualization of the co-transcriptional assembly of a nuclear body by noncoding RNAs. Nature Cell Biology, 2011, 13(1): 95-101. doi:10. 1038/ncb2140.
[7] CLEMSON C M, HUTCHINSON J N, SARA S A, ENSMINGER A W, FOX A H, CHESS A, LAWRENCE J B. An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles. Molecular Cell, 2009, 33(6): 717-726. doi:10.1016/ j.molcel.2009.01.026.
[8] SUNWOO H, DINGER M E, WILUSZ J E, AMARAL P P, MATTICK J S, SPECTOR D L. MEN epsilon/beta nuclear-retained non-coding RNAs are up-regulated upon muscle differentiation and are essential components of paraspeckles. Genome Research, 2009, 19(3): 347-359. doi:10.1101/gr.087775.108.
[9] CHOUDHRY H, ALBUKHARI A, MOROTTI M, HAIDER S, MORALLI D, SMYTHIES J, SCHÖDEL J, GREEN C M, CAMPS C, BUFFA F, RATCLIFFE P, RAGOUSSIS J, HARRIS A L, MOLE D R. Tumor hypoxia induces nuclear paraspeckle formation through HIF-2α dependent transcriptional activation of NEAT1 leading to cancer cell survival. Oncogene, 2015, 34(34): 4482-4490. doi:10.1038/onc.2014.378.
[10] PISANI G, BARON B. Nuclear paraspeckles function in mediating gene regulatory and apoptotic pathways. Non-Coding RNA Research, 2019, 4(4): 128-134. doi:10.1016/j.ncrna.2019.11.002.
[11] 张译夫, 潘阳阳, 温泽星, 余四九. 表皮生长因子对牦牛卵丘细胞低氧诱导因子-1α表达的影响及与凋亡的关联性分析. 畜牧兽医学报, 2016, 47(6): 1154-1161. doi:10.11843/j.issn.0366-6964.2016.06. 010.
ZHANG Y F, PAN Y Y, WEN Z X, YU S J. The effect of epidermal growth factor on the expression of hypoxia inducible factor-1α in cumulus cells of yak () and its correlation analysis with apoptosis. Acta Veterinaria et Zootechnica Sinica, 2016, 47(6): 1154-1161. doi:10.11843/j.issn.0366-6964.2016.06.010. (in Chinese)
[12] 许涛, 潘阳阳, 何翃闳, 李谷月, 张慧珠, 赵凌, 崔燕, 余四九. TNF-α对牦牛卵母细胞HIF-1α和HSP70的表达及后续胚胎发育能力的影响. 畜牧兽医学报, 2019, 50(6): 1198-1207. doi:10.11843/ j.issn.0366-6964.2019.06.010.
XU T, PAN Y Y, HE H H, LI G Y, ZHANG H Z, ZHAO L, CUI Y, YU S J. The effects of tumor necrosis factor-α (TNF-α) on the expression of HIF-1α and HSP70 in yak oocytes and the subsequent embryo development. Acta Veterinaria et Zootechnica Sinica, 2019, 50(6): 1198-1207. doi:10.11843/j.issn.0366-6964.2019. 06.010. (in Chinese)
[13] PAN Y Y, CUI Y, HE H H, BALOCH A R, FAN J F, XU G Q, HE J F, YANG K, LI G Y, YU S J. Developmental competence of mature yak vitrified-warmed oocytes is enhanced by IGF-I via modulation of CIRP duringmaturation. Cryobiology, 2015, 71(3): 493-498. doi:10.1016/j.cryobiol.2015.10.150.
[14] 潘阳阳, 李秦, 崔燕, 樊江峰, 杨琨, 何俊峰, 余四九. EGF、EGFR在牦牛卵母细胞中的表达及对胚胎发育能力的作用. 中国农业科学, 2015, 48(12): 2439-2448. doi:10.3864/j.issn.0578-1752.2015.12. 017.
PAN Y Y, LI Q, CUI Y, FAN J F, YANG K, HE J F, YU S J. The expression of EGF and EGFR in yak oocyte and its function on development competence of embryo. Scientia Agricultura Sinica, 2015, 48(12): 2439-2448. doi:10.3864/j.issn.0578-1752.2015.12.017. (in Chinese)
[15] PAN Y Y, CUI Y, BALOCH A R, HE H H, FAN J F, HE J F, LI Q, YANG K, ZHANG Q, YU S J. Epidermal growth factor enhances the developmental competence of yak () preimplantation embryos by modulating the expression of survivin and HSP70. Livestock Science, 2015, 182: 118-124. doi:10.1016/j.livsci.2015.11. 002.
[16] WEN Z X, PAN Y Y, CUI Y, PENG X M, CHEN P, FAN J F, LI G Y, ZHAO T, ZHANG J, QIN S J, YU S J. Colony-stimulating factor 2 enhances the developmental competence of yak (Poephagus grunniens) preimplantation embryos by modulating the expression of heat shock protein 70 kDa 1A. Theriogenology, 2017, 93: 16-23. doi:10.1016/ j.theriogenology.2017.01.034.
[17] PFAFFL M W, HORGAN G W, DEMPFLE L. Relative expression software tool (REST©) for group-wise comparison and statistical analysis of relative expression results in real-time PCR. Nucleic Acids Research, 2002, 30(9): e36. doi:10.1093/nar/30.9.e36.
[18] HUPALOWSKA A, JEDRUSIK A, ZHU M, BEDFORD M T, GLOVER D M, ZERNICKA-GOETZ M. CARM1 and paraspeckles regulate pre-implantation mouse embryo development. Cell, 2018, 175(7): 1902-1916.e13. doi:10.1016/j.cell.2018.11.027.
[19] ZHANG Y, DUAN E K. LncRNAs and paraspeckles predict cell fate in early mouse embryo. Biology of Reproduction, 2019, 100(5): 1129-1131. doi:10.1093/biolre/ioz021.
[20] SASAKI Y F, IDEUE T, SANO M, MITUYAMA T, HIROSE T. MENε/β noncoding RNAs are essential for structural integrity of nuclear paraspeckles. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(8):2525-30. doi: 10.1073/pnas.0807899106.
[21] LIU H, IPPOLITO G C, WALL J K, NIU T, PROBST L, LEE B S, PULFORD K, BANHAM A H, STOCKWIN L, SHAFFER A L, STAUDT L M, DAS C, DYER M J S, TUCKER P W. Functional studies of BCL11A: characterization of the conserved BCL11A-XL splice variant and its interaction with BCL6 in nuclear paraspeckles of germinal center B cells. Molecular Cancer, 2006, 5: 18. doi:10.1186/ 1476-4598-5-18.
[22] MA C, KARWACKI-NEISIUS V, TANG H R, LI W J, SHI Z N, HU H L, XU W Q, WANG Z T, KONG L C, LV R T, FAN Z, ZHOU W H, YANG P Y, WU F Z, DIAO J B, TAN L, SHI Y G, LAN F, SHI Y. Nono, a bivalent domain factor, regulates erk signaling and mouse embryonic stem cell pluripotency. Cell Reports, 2016, 17(4): 997-1007. doi:10.1016/j.celrep.2016.09.078.
[23] JEN J, TANG Y N, LU Y H, LIN C C, LAI W W, WANG Y C. Oct4 transcriptionally regulates the expression of long non-coding RNAs NEAT1 and MALAT1 to promote lung cancer progression. Molecular Cancer, 2017, 16(1): 104. doi:10.1186/s12943-017-0674-z.
[24] TOYOOKA Y. Trophoblast lineage specification in the mammalian preimplantation embryo. Reproductive Medicine and Biology, 2020, 19(3): 209-221. doi:10.1002/rmb2.12333.
[25] HIROSE T, VIRNICCHI G, TANIGAWA A, NAGANUMA T, LI R H, KIMURA H, YOKOI T, NAKAGAWA S, BÉNARD M, FOX A H, PIERRON G. NEAT1 long noncoding RNA regulates transcription via protein sequestration within subnuclear bodies. Molecular Biology of the Cell, 2014, 25(1): 169-183. doi:10.1091/mbc.E13-09-0558.
[26] IMAMURA K, IMAMACHI N, AKIZUKI G, KUMAKURA M, KAWAGUCHI A, NAGATA K, KATO A, KAWAGUCHI Y, SATO H, YONEDA M, KAI C, YADA T, SUZUKI Y, YAMADA T, OZAWA T, KANEKI K, INOUE T, KOBAYASHI M, AKIMITSU N. Long noncoding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli. Molecular Cell, 2014, 53(3): 393-406. doi:10.1016/j.molcel.2014.01. 009.
[27] ZENG C W, LIU S C, LU S, YU X B, LAI J, WU Y F, CHEN S H, WANG L, YU Z, LUO G X, LI Y Q. The c-myc-regulated lncRNA NEAT1 and paraspeckles modulate imatinib-induced apoptosis in CML cells. Molecular Cancer, 2018, 17(1): 130. doi:10.1186/s12943- 018-0884-z.
[28] ADRIAENS C, STANDAERT L, BARRA J, LATIL M, VERFAILLIE A, KALEV P, BOECKX B, WIJNHOVEN P W G, RADAELLI E, VERMI W, LEUCCI E, LAPOUGE G, BECK B, VAN DEN OORD J, NAKAGAWA S, HIROSE T, SABLINA A A, LAMBRECHTS D, AERTS S, BLANPAIN C, MARINE J C. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity. Nature Medicine, 2016, 22(8): 861-868. doi:10.1038/nm.4135.
[29] SHELKOVNIKOVA T A, KUKHARSKY M S, AN H Y, DIMASI P, ALEXEEVA S, SHABIR O, HEATH P R, BUCHMAN V L. Protective paraspeckle hyper-assembly downstream of TDP-43 loss of function in amyotrophic lateral sclerosis. Molecular Neurodegeneration, 2018, 13(1): 30. doi:10.1186/s13024-018-0263-7.
[30] SEO G J, KINCAID R P, PHANAKSRI T, BURKE J M, PARE J M, COX J E, HSIANG T Y, KRUG R M, SULLIVAN C S. Reciprocal inhibition between intracellular antiviral signaling and the RNAi machinery in mammalian cells. Cell Host & Microbe, 2013, 14(4): 435-445. doi:10.1016/j.chom.2013.09.002.
[31] LIU P G, YU S J, CUI Y, HE J F, ZHANG Q, SUN J, HUANG Y F, YANG X Q, CAO M X, LIAO B, MA J X. Regulation by Hsp27/P53 in testis development and sperm apoptosis of male cattle (cattle-yak and yak). Journal of Cellular Physiology, 2018, 234(1): 650-660. doi:10.1002/jcp.26822.
[32] 郑红飞, 潘阳阳, 李秦, 张译夫, 吕鹏, 崔燕, 余四九. 肿瘤抑制蛋白基因Tp53在牦牛体外受精早期胚胎中的表达. 农业生物技术学报, 2015, 23(9): 1240-1245. doi:10.3969/j.issn.1674-7968.2015.09. 014.
ZHENG H F, PAN Y Y, LI Q, ZHANG Y F, LÜ P, CUI Y, YU S J. The expression of tumor protein p53 gene (Tp53) in yak (grunneins)fertilization (IVF) early embryos during developmental process. Journal of Agricultural Biotechnology, 2015, 23(9): 1240-1245. doi:10.3969/j.issn.1674-7968.2015.09.014. (in Chinese)
[33] PRATIM DAS P, SULTANA BEGUM S, CHOUDHURY M, MEDHI D, PAUL V, JYOTI DAS P. Characterizing miRNA and mse-tsRNA in fertile and subfertile yak bull spermatozoa from Arunachal Pradesh. Journal of Genetics, 2020, 99: 88.
[34] HE H H, ZHANG H Z, LI Q, FAN J F, PAN Y Y, ZHANG T X, ROBERT N, ZHAO L, HU X Q, HAN X H, YANG S S, CUI Y, YU S J. Low oxygen concentrations improve yak oocyte maturation and enhance the developmental competence of preimplantation embryos. Theriogenology, 2020, 156: 46-58. doi:10.1016/j.theriogenology. 2020.06.022.
[35] ZHANG H Z, HE H H, CUI Y, YU S J, LI S J, AFEDO S Y, WANG Y L, BAI X F, HE J F. Regulatory effects of HIF-1α and HO-1 in hypoxia-induced proliferation of pulmonary arterial smooth muscle cells in yak. Cellular Signalling, 2021, 87: 110140. doi:10.1016/j. cellsig.2021.110140.
[36] BEN-ZVI M, AMARIGLIO N, PARET G, NEVO-CASPI Y. F11R expression upon hypoxia is regulated by RNA editing. PLoS ONE, 2013, 8(10): e77702. doi:10.1371/journal.pone.0077702.
[37] DUNWOODIE S L. The role of hypoxia in development of the mammalian embryo. Developmental Cell, 2009, 17(6): 755-773. doi:10.1016/j.devcel.2009.11.008.
Formation and Function of Paraspeckle During Pre-implantation Embryos Development in Yak

1College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070;2Gansu Province Livestock Embryo Engineering Research Center, Lanzhou 730070
【Objective】The aim of present study was to identify of paraspeckle formation stages during the early embryonic development in yak (). Furthermore, the long non-coding RNAs (LncRNAs) involved in paraspeckle formation were determined, and the effects and regulatory mechanism of their formation on the subsequent developmental ability of yak embryos were studied. 【Method】The yak embryos were produced by(IVF), DAPI staining of embryonic nuclei combined with paraspeckle protein 1 () mRNA detection were done by quantitative real-time fluorescence PCR (qRT-PCR) at different stages in order to confirm paraspeckle formation. PSPC1 protein in embryos was verified by immunofluorescence technique. The levels of encoding nuclear paraspeckle assembly transcript 1 (NEAT1), coactivator associated arginine methyl transferase 1 (CARM1) and non-POU domain containing octamer-binding protein () mRNAs were also detected by qRT-PCR at different stages. The mRNA level of PSPC1 in zygote was inhibited by RNA interference technology, and the developmental rate of embryos in subsequent stages was compared. The blastocyst quality was evaluated by analyzing the number of total cells, trophoblast cells (TE) and inner cell mass (ICM). B-cell lymphoma/leukemia-2 (Bcl-2) and b-cell lymphoma/leukemia associated X protein (Bax) in blastocysts form in the control andmRNA interference groups was detected. 【Result】(1) Paraspeckle could be observed in the nuclei of embryos at all different stages; however, nuclei could be more clearly seen at 2-cell stage and 4-cell stage. ThemRNA was higher in yak embryos from 2-cell to morula stage, which was the highest in embryos at 4-cell embryos and morula. The fluorescence intensity ofprotein was the strongest in embryos from those stages. (2) The levels of,andmRNA were higher from 2-cell to morula stage than that from other stages.andwere found to be highest in embryos at 4-cell stage, while CARM1 was not significantly different from 2-cell to morula stage (>0.05). (3) The developmental rates of morula and blastocyst inmRNA interference group were reduced, which was more significantly reduced in morula rate. The total number of blastocyst cells inmRNA interference group was significantly lower than that in the control group, which was mainly caused by ICM reduction. There was no significant difference in number of TE between the two groups. (4) The levels ofmRNA and protein were enhanced in blastocyst forminterference group, while the levels ofmRNA and protein were reduced in blastocyst, and the cell lysis was observed in ICM.【Conclusion】The paraspeckle was formed at 2-cell to morula stage transition in the yak embryo, which was more prominent in 4-cell stage. The expression of PSPC1, NEAT1, CRAM1 and p54nrb in the stages of paraspeckle formation were on high levels. Interference withmRNA in yak zygotes resulted in decreased developmental ability of subsequent embryo. The blastocyst quality was also reduced by inducing apoptosis of inner cell mass, which was also involved in the regulation of cell fate determination in early embryo development.
yak; paraspeckle; cell fate; apoptosis; LncRNAs

10.3864/j.issn.0578-1752.2023.06.014
2021-11-23;
2022-04-28
国家自然科学基金(31972760、32160859)、甘肃省杰出青年基金(20JR10RA561)、甘肃省教育厅创新创业能力提升项目(2019B-081)、甘肃农业大学伏羲青年英才基金(Gaufx-02Y10)、甘肃农业大学博士科研启动基金(GSAU-RCZX201701)
潘阳阳,E-mail:panyangyang_2007@126.com。通信作者余四九,E-mail:sjyu@163.com
(责任编辑 林鉴非)
