内蒙古地区羊源副结核分枝杆菌的分离与基因分型
2023-04-11赵维宏韩文雄杨波孟维康柴海亮马懿敏张占胜王利峰王艳王明圆张姗丁玉林王金玲吉林台王凤龙赵丽刘永宏
赵维宏,韩文雄,杨波,孟维康,柴海亮,马懿敏,张占胜,王利峰,王艳,王明圆,张姗,丁玉林,王金玲,吉林台,王凤龙,赵丽,刘永宏
内蒙古地区羊源副结核分枝杆菌的分离与基因分型

1内蒙古农业大学兽医学院/农业农村部动物疾病临床诊疗技术重点实验室,呼和浩特 010000;2内蒙古赛科星繁育生物技术(集团)股份有限公司,呼和浩特 011517;3鄂尔多斯市动物疫病预防控制中心,内蒙古鄂尔多斯 017000
【目的】副结核病被世界动物卫生组织(OIE)列入必须报告的《OIE疫病、感染及侵染名录》,我国将其列为二类动物疫病,引起多种反刍动物慢性、增生性肠炎,感染动物通过肠道间歇性排菌而成为养殖场的持续传染源,给养殖业带来了巨大经济损失。其病原体副结核分枝杆菌(MAP)属于胞内寄生的革兰氏阳性菌,为三类动物病原微生物,包括S型(羊型,细分为Ⅰ型、Ⅲ型和骆驼型)和C型(牛型、Ⅱ型,包括B型(野牛型))。有研究表明,各亚型MAP无宿主特异性,但具有地域性,内蒙古作为国内该病的首发地区,获得并准确鉴定内蒙古地区MAP菌株亚型及基因特征,对副结核病的预防控制意义重大。【方法】对内蒙古地区来源的28份MAP阳性的羊源病料进行MAP分离培养,菌落Ziehl-Neelsen染色,染色阳性菌扩繁,提取扩繁菌液基因组DNA,进行IS900基因、IS1311基因和DMC基因扩增、测序和序列分析,同时IS1311基因PCR产物进行f I和I双酶切鉴定。【结果】28份样品经过7—12周培养,共有9支培养基长出菌落,菌落半透明乳白色、表面光滑。挑取单菌落进行抗酸染色,在显微镜下观察到呈不规则(单个或分枝状)、红染的细短杆菌,符合分枝杆菌的形态学特征及抗酸染色特性。9株分离菌IS900、IS1311和DMC基因PCR扩增产物均与目的基因片段预期大小一致。确定了本研究9株分离株均为MAP菌株,分别命名为MAP-NM1至MAP-NM9。DMC基因扩增产物大小为310bp,符合Ⅱ型MAP特征;IS1311基因扩增产物经f Ⅰ和Ⅰ双酶切,本研究9株MAP均得到4条目的条带,与Ⅱ型MAP一致;IS1311基因测序结果与S型、C型、印度野牛型和美国野牛型MAP代表株对照分析显示,9株MAP IS1311基因片段的64、65、68、223、236、422、527、628位碱基位点符合C型和B型MAP特征;IS900基因测序结果序列分析显示,9株MAP IS900基因片段第169位及第216位碱基分别为C(胞嘧啶)和A(腺嘌呤),符合Ⅱ型和Ⅲ型MAP特征;17株来自GenBank数据库的MAP IS900基因参考序列与本研究9株分离株IS900基因系统进化树显示,本研究9株MAP均划分于Ⅱ型MAP分支;3个基因测序结果进行Blast在线分析,与本研究所得分离株同源性最高的参考序列均为Ⅱ型MAP,且同源性均高于98%。综上所述,本研究9株MAP分离株均为Ⅱ型MAP。【结论】首次分离得到内蒙古地区羊源Ⅱ型MAP菌株。
副结核分枝杆菌;分离培养;亚型鉴定;羊;内蒙古
0 引言
【研究意义】副结核病()被世界动物卫生组织(OIE)列入必须报告的《OIE疫病、感染及侵染名录》,我国将其列为二类动物疫病,其病原体副结核分枝杆菌(subsp.MAP)归类为三类动物病原微生物。该病特征性病理变化主要为慢性增生性肠炎和肠系膜淋巴结增生性炎[1],患病动物最终因进行性消瘦、衰弱而死[2]。与牛相比,羊更易感染副结核分枝杆菌,且大都呈慢性或隐性感染[3],极易被忽视或误诊,部分感染动物通过肠道间歇性排菌而成为养殖场的持续传染源[4],给羊养殖业带来了较大经济损失[5]。【前人研究进展】MAP属于胞内寄生的革兰氏阳性菌,包括S型(羊型,细分为Ⅰ型、Ⅲ型和骆驼型)和C型(牛型、Ⅱ型,包括B型),B型(野牛型)又包括印度野牛型和美国野牛型[6-8]。各亚型MAP无宿主特异性,培养特征也有很大差异[8-9]。MAP初代分离培养非常困难,在体外培养时必须添加草分枝杆菌素提取物[10],然而该菌生长缓慢,Ⅱ型MAP一般接种后6周开始出现菌落,而Ⅰ型甚至需半年以上才能开始观测到菌落,且菌落较小不易观察。【本研究切入点】1953年在我国内蒙古地区首次发现了1例副结核病[11],随后该病迅速蔓延至全国大部分地区,感染谱涉及众多家畜和野生动物。截至目前,国内MAP分离株多为牛源MAP,包括山东、新疆、甘肃、黑龙江等地[12]。另外,仅有新疆地区马鹿源、绵羊源[13-14]和辽宁绒山羊源[15]MAP分离株,未见内蒙古地区MAP分离株分型的报道。有研究表明MAP基因型具有地域性[16],对国内该病首发地区的MAP进行分离培养及亚型鉴定,内蒙古地区MAP分离株的获得尤为重要。【拟解决的关键问题】本研究拟对实验室保存的内蒙古地区PCR鉴定阳性的山羊和绵羊样品进行MAP的分离培养,通过对疑似菌落进行形态学和分子生物学鉴定以确定MAP及其亚型,分离培养得到的菌株为后续MAP的病原学研究和流行病学调查奠定基础,为内蒙古地区羊源MAP遗传变异的监测及国内羊副结核病的防控提供理论依据。
1 材料与方法
试验于2021年3—10月在内蒙古农业大学兽医学院家畜病理学实验室完成,实验室生物安全等级为ABSL-2。
1.1 材料
1.1.1 组织病料及粪便 12份检测为MAP阳性的组织病料,包括羊小肠及肠系膜淋巴结,分别编号1—12;以及16份MAP阳性山羊粪便,编号为A1至A16(表1)。以上材料均在内蒙古农业大学兽医学院家畜病理学实验室-20℃保存。
1.1.2 引物和参考序列 副结核分枝杆菌IS900基因、IS1311基因和DMC基因分子鉴定及分型引物(IS900-F、IS900-R、IS1311-F、IS1311-R、DMC529、DMC531和DMC533),由生工生物工程(上海)有限公司合成(表2)。基因序列分析参考菌株均来源于NCBI数据库(表3)。
1.1.3 主要试剂及仪器 卵黄琼脂培养基(Code No. 222233)和Middlebrook 7H9培养基(Code No. 271310)购自美国BD公司。Ferric Mycobactin J(Code No. MYCO)购自ID-VET公司。TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver. 3.0(Code No. 9763)、Premix TaqTM(TakaRa TaqTMVersion 2.0 plus dye)(Code No. RR901A)、f I限制性内切酶(Code No. 1238A)和I限制性内切酶(Code No. 1247A),购自宝日医生物工程(北京)有限公司。使用仪器设备高速冷冻离心机(Cat No.75004250, ThermoFisher)、PCR仪(Part No.4359659, Gene Company Limited)、电泳仪(Model No. PowerPacTMUniversal Power Supply, BIO RAD)、凝胶成像仪(BDA Box 2, Biometra GmbH)等。
表1 病料采集信息

表2 特异性引物

表3 参考菌株
1.2 方法
1.2.1 MAP的分离培养及抗酸染色 组织病料研磨和阳性粪便采用改良的NADC法[20]处理后,分别接种卵黄琼脂培养基。37℃恒温培养7—12周,每周观察并记录培养基中菌落生长情况。
采用Ziehl-Neelsen热染法对疑似菌落进行抗酸染色镜检。阳性单菌落接种7H9液体培养基,37℃恒温培养扩繁。
1.2.2 分离菌DNA提取、PCR扩增及分型鉴定 使用TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver. 3.0试剂盒提取细菌基因组DNA,-20℃保存备用。对IS900基因、IS1311基因和DMC基因进行PCR扩增,退火温度分别为58℃、62℃和60℃,PCR产物经1.5%凝胶电泳鉴定。IS1311基因PCR扩增产物进行I和I双酶切鉴定。
1.2.3 序列分析 IS900、IS1311和DMC基因各20 μL阳性PCR产物送至生工生物工程(上海)有限公司进行测序。测序结果应用BLAST在线平台(https://blast.ncbi.nlm.nih.gov/Blast.cgi)和DNAstar、MEGA5.0等软件,进行MAP鉴定、亚型分析和IS900基因系统进化树构建。
2 结果
2.1 菌株鉴定
2.1.1 MAP分离培养及Ziehl-Neelsen染色结果 28份样品接种卵黄琼脂培养基,经过7—12周培养后,共有9支培养基长出半透明乳白色、表面光滑的菌落(图1左),样品编号对应为4、9、10、11、A10、A11、A12、A14和A16;挑取单菌落进行抗酸染色,在显微镜下观察到呈不规则(单个或分枝状)、红染的细短杆菌(图1右)。
2.1.2 PCR结果 分别使用IS900基因和IS1311基因特异性引物对细菌基因组DNA进行PCR扩增,结果显示9株分离菌PCR均为阳性,分别得到约为400 bp和608 bp的条带,与目的基因片段大小一致。9株分离菌命名为MAP-NM1至MAP-NM9。
2.1.3 亚型鉴定 用亚型鉴定特异性引物DMC529、DMC531和DMC533对已鉴定为MAP的9株分离菌进行PCR扩增分型,结果显示9株MAP的DNA均扩增得到约310 bp的条带(图2左)。使用f I和I限制性内切酶对IS1311基因的PCR产物进行双酶切,9株MAP均得到约为67、218、285和323 bp 4条带(图2右)。
2.2 序列分析
2.2.1 IS900基因序列分析 9株MAP IS900基因片段第169位及第216位碱基分别为C(胞嘧啶)和A(腺嘌呤),符合Ⅱ型和Ⅲ型MAP特征。
2.2.2 IS1311基因序列分析 与来自GenBank数据库的各亚型MAP代表菌株分析结果显示,9株MAP IS1311基因的8个特殊位点符合C型和B型MAP特征(表4)。

图1 菌落形态(左)和分离株抗酸染色结果(右)
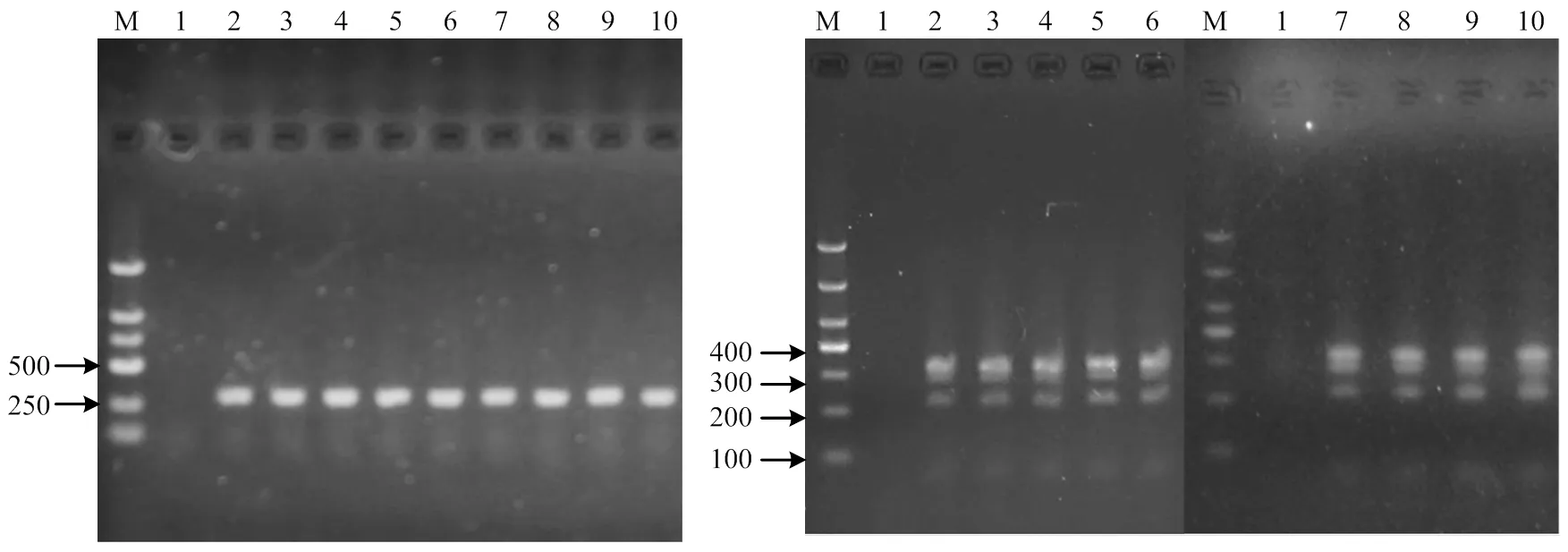
M:Marker;1:阴性对照;2-10:分离株MAP-NM1至MAP-NM9 M: Marker; 1: Negative control; 2-10: MAP-NM1 isolate to MAP-NM9 isolate
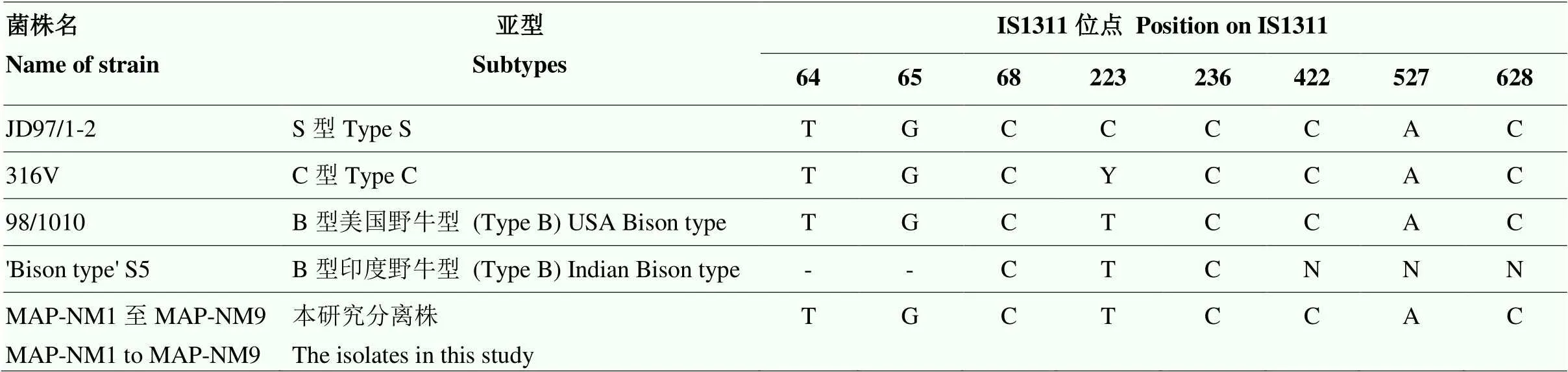
表4 参考菌株
Y代表C/T,N代表A/T/C/G Y stands for C / T, N stands for A / T / C / G
2.3 IS900基因进化树
17株来自GenBank数据库的MAP IS900基因参比序列与本研究9株MAP IS900基因,使用MEGA5软件构建基因进化树显示,本研究9株MAP均处于Ⅱ型MAP分支(图3)。
2.4 Blast在线分析
对测序所得9株MAP的IS900基因、IS1311基因和DMC基因序列进行Blast分析结果显示,与9株MAP的3个基因同源性最高的序列全部为Ⅱ型MAP菌株,同源性为98.58%至100%(表5)。

◆标注序列为本研究序列 The black rhombus tagging sequence is the sequence of this research
3 讨论
3.1 国内MAP分离鉴定现状
副结核病是1895年由JOHNE和HOTHINGHOW首次发现,主要引起牛肠道感染,当时命名为“假结核性肠炎”,1923年MAP被正式认为是引起副结核病的病原体。副结核病是畜禽的主要限产性疾病,因其潜伏期漫长、发病呈慢性经过,不易被察觉。我国该病在散户以及农村呈散发,在规模化养殖场主要呈区域流行,在全国范围呈地方性流行。在美国、澳大利亚、南非、西班牙、希腊、法国[21]等国也有报道该病的发生,给羊养殖业带来了极大的经济损失。据统计,仅美国每年由此病带来的损失在2亿美元以上[13]。
国内关于副结核病的研究多集中于血清学调查,病原分离鉴定较少,因MAP的初代分离是非常困难的,可能与MAP对分枝杆菌素的依赖性、病料的去污方法、MAP的生长速度和培养基的适宜度等方面有关。截至目前,国内多个省市报道了副结核病,而仅有从4种动物获得MAP分离株的报道[14],其中只有2018年4株山东奶牛分离株为Ⅰ型MAP,其余均为Ⅱ型MAP。这对于众多的可感染动物种类稍显不足,严重制约了对副结核病进一步的研究。内蒙古为国内首次发现副结核病的地区,分离培养得到内蒙古地区MAP及其亚型确定,对掌握内蒙古地区MAP菌株基因特征,和对国内副结核病的防控具有重大意义。

表5 27个MAP基因片段Blast比对分析
3.2 试验样品分型
本研究对28份采集自内蒙古各地区的MAP阳性组织样品和粪便进行MAP分菌培养,自接种后第7—12周,共有9份样品在含分枝杆菌素的卵黄琼脂培养基上长出菌落,随着培养时间延长,菌落由开始的光滑半透明变为粗糙不透明的乳头状,与蔡珠明等[22]得到的菌落形态相似;单菌落Ziehl-Neelsen染色,在油镜下可观察到单个或分枝状排列的红染杆状菌,符合分枝杆菌的形态学特征及抗酸染色特性[23],表明9株分离菌均为抗酸染色阳性菌。对MAP特异性基因IS900、IS1311和DMC进行PCR扩增,扩增产物大小与文献[24]报道一致,证明9株分离菌均为MAP。
9株MAP DMC基因扩增产物约为310bp,符合COLLINS[19]报道的Ⅱ型MAP特征。由于不同亚型IS1311基因的第223位碱基不同,导致限制性内切酶的选择不同,通过f Ⅰ和Ⅰ两种限制性内切酶对该基因酶切鉴定MAP亚型[23, 25],本研究9株MAP IS1311基因扩增产物酶切结果与报道的Ⅱ型MAP一致。IS1311基因序列分析结果可区分S型、C型和B型MAP菌株,参照各亚型代表菌株IS1311基因第64、65、68、223、236、422和527位碱基特征[26-27],本研究9株MAP可能为B型或C型MAP。IS900基因的第169和216位碱基在区分Ⅰ型、Ⅱ型和Ⅲ型MAP时起重要作用,Ⅰ型分别为CG,Ⅱ型分别为CA,Ⅲ型分别为TG或C/TG/A[28],根据上述信息分析,本研究9株MAP可能为Ⅱ型或Ⅲ型MAP。同时IS900基因进化树显示9株分离株均处于Ⅱ型MAP分支。另外,将本研究获得的3个基因测序结果Blast在线分析显示,与本研究MAP同源性最高的参考序列均为Ⅱ型MAP。综上所述,本研究成功分离获得的9株MAP为Ⅱ型MAP(表6),是国内首次分离得到内蒙古地区MAP菌株,为后续MAP遗传稳定性研究和动物回归试验提供了基础。

表6 亚型分析结果
3.3 OIE标准及生物安全
OIE《陆生动物诊断试验与疫苗手册》推荐两种分离培养MAP的方法,其一为使用草酸及NaOH去污搭配LJ培养基,另一种是使用十六烷基氯化吡啶(HPC)去污结合固体培养基进行培养,如卵黄琼脂培养基和Middlebrook 7H10培养基。本试验采用HPC去污,继而接种卵黄琼脂培养基,获得单菌落后使用7H9液体培养基扩繁。此次分离培养使用的28份样品中,绵羊源样品和已鉴定为Ⅲ型MAP的样品[28]未成功分离获得MAP,可能是样品保存时间较久,导致MAP失活,或者所选卵黄琼脂培养基不适宜绵羊源和Ⅲ型MAP生长,亦可能因为去污过程导致MAP活菌损失过多。
本次研究结果与COLLINS[29]报道的羊以Ⅰ型MAP感染为主不同,与LIAPI等[30]提到羊可能因适应性而感染Ⅱ型MAP的报道相一致。已有研究报道,MAP各亚型之间无宿主特异性,各亚型MAP菌株不仅可以感染羊,对周边反刍家畜和其他野生动物也有较大危害。甚至有研究表明,MAP与某些人类疾病,如克罗恩病[31]、Blau综合征或Ⅰ型糖尿病有关[32]。因此,对副结核病的调查、监测和防制极为重要,避免给养殖业造成更大的损失,也为人类公共卫生安全进行预警。由于MAP的特殊性,在保证试验材料不被污染的同时,也要保证试验人员及试验环境的安全,本试验活菌操作均在生物安全柜内进行,试验器材高温高压灭菌处理。
3.4 MAP菌株致病力及耐药性
STABEL[1]等用新鲜分离自奶牛的S型MAP临床菌株感染两周龄山羊、绵羊和犊牛在感染后90d开始出现抗原特异性IFN-γ反应,且高于犊牛;绵羊在感染后90d检测到MAP特异性抗体反应,而山羊和犊牛几乎没有反应;感染后7d,山羊粪便中MAP脱落量最大,只有1头犊牛脱落MAP。彭永[33]将分离自奶牛的S型MAP菌株感染C57B/L小鼠,小鼠MAP抗体水平在第4周开始大幅上升,表示MAP已攻克机体细胞免疫防线,免疫应答主体由细胞免疫转为体液免疫;IL-6、IL-10以及IFN-γ三种不同细胞因子转录水平均有不同程度增高。高建鹏[34]将实验室分离的马鹿源C型MAP菌株感染BALB/c小鼠,在饲养的8周内未见小鼠体重下降,粪便抗酸染色未见阳性杆菌;在肠道、肝脏、脾脏和肾脏组织切片均可见抗酸染色阳性菌,且肝脏与脾脏中的载菌量要多于肠道和肾脏。上述报道表明MAP具有较强的致病力,能快速定植于动物体内,针对不同宿主可引起不同程度的细胞免疫和体液免疫。此外,有报道称实验室分离菌株的连续传代会改变RpoA、RpoB、GroEL1和ClpP等蛋白的翻译表达,从而影响其毒力水平[35]。
目前世界上对副结核病尚无有效的药物治疗措施,而有多种药物能够抑制MAP的体外生长。马呼和等[36]试验结果表明MAP菌株对环丙沙星(Ciprofloxacin)和卡那霉素(Kanamycin)敏感,对头孢呋肟(Cefuroxime)中度敏感,而对其他16种药物有不同程度的耐药性;ALCEDO等[37]验证了克拉霉素(Clarithromycin)、氯苯吩嗪(Clofazimine)和利福布汀(Rifabutin)对MAP具有明显的抑制作用;SHIN[38]亦证明硫唑嘌呤(Azathioprine)和6-巯基嘌呤(6-Mercaptopurine)抑制MAP体外生长,阿奇霉素(Azithromycin)对MAP具有杀菌作用。本试验分离的羊源Ⅱ型MAP及其传代菌的致病性和耐药性有待进一步研究。
4 结论
首次成功分离培养得到9株内蒙古地区羊源Ⅱ型副结核分枝杆菌(MAP)菌株,确认内蒙古地区羊存在Ⅱ型MAP感染。该研究可为进一步研究内蒙古地区MAP菌株基因特征,以及副结核病的防控研究提供依据。
[1] STABEL J R, BANNANTINE J P, HOSTETTER J M. Comparison of sheep, goats, and calves as infection models foravium subsp.. Veterinary Immunology and Immunopathology, 2020, 225: 110060. doi:10.1016/j.vetimm.2020.110060.
[2] WINDSOR P A. Managing control programs for ovine caseousandin Australia, and the need for persistent vaccination. Veterinary Medicine (Auckland, N Z), 2014, 5: 11-22. doi:10.2147/VMRR.S44814.
[3] STEVENSON K, HUGHES V M, DE JUAN L, INGLIS N F, WRIGHT F, SHARP J M. Molecular characterization of pigmented and nonpigmented isolates ofsubsp.. Journal of Clinical Microbiology, 2002, 40(5): 1798-1804. doi:10.1128/jcm.40.5.1798-1804.2002.
[4] PURDIE A C, PLAIN K M, BEGG D J, DE SILVA K, WHITTINGTON R J. Gene expression profiles during subclinicalsub speciesinfection in sheep can predict disease outcome. Scientific Reports, 2019, 9: 8245. doi:10.1038/s41598-019-44670-w.
[5] RASMUSSEN P, BARKEMA H W, MASON S, BEAULIEU E, HALL D C. Economic losses due to Johne's disease () in dairy cattle. Journal of Dairy Science, 2021, 104(3): 3123-3143. doi:10.3168/jds.2020-19381.
[6] CASTELLANOS E, ARANAZ A, ROMERO B, DE JUAN L, ALVAREZ J, BEZOS J, RODRÍGUEZ S, STEVENSON K, MATEOS A, DOMÍNGUEZ L. Polymorphisms inandgenes amongsubsp.type I, II, and III isolates. Journal of Clinical Microbiology, 2007, 45(10): 3439-3442. doi:10.1128/jcm.01411-07.
[7] BRYANT J M, THIBAULT V C, SMITH D G E, MCLUCKIE J, HERON I, SEVILLA I A, BIET F, HARRIS S R, MASKELL D J, BENTLEY S D, PARKHILL J, STEVENSON K. Phylogenomic exploration of the relationships between strains ofsub species. BMC Genomics, 2016, 17: 79. doi:10.1186/s12864-015-2234-5.
[8] WIBBERG D, PRICE-CARTER M, RÜCKERT C, BLOM J, MÖBIUS P. Complete Genome Sequence of Ovinesubsp.Strain JIII-386 (MAP-S/type III) and Its Comparison to MAP-S/type I, MAP-C, andComplex Genomes. Microorganisms, 2020, 9(1): 70. doi:10.3390/ microorganisms9010070.
[9] HODGEMAN R, MANN R, SAVIN K, DJITRO N, ROCHFORT S, RODONI B. Molecular characterisation ofsubsp.in Australia. BMC Microbiology, 2021, 21(1): 101. doi:10.1186/s12866-021-02140-2.
[10] BHAT A M, MALIK H U, CHAUBEY K K, HUSSAIN T, MIR A Q, NABI S U, GUPTA S, SINGH S V. Bio-typing ofsub speciesisolates recovered from the Himalayan sheep and goats. Tropical Animal Health and Production, 2021, 53(2): 237. doi:10.1007/s11250-021-02682-7.
[11] 牟巍, 蒋菲, 何宇, 丁家波, 彭小兵, 蒋玉文. 副结核分枝杆菌map0862基因的克隆及其在大肠杆菌中的表达. 中国兽药杂志, 2010, 44(8): 10-12, 21.
MU W, JIANG F, HE Y, DING J B, PENG X B, JIANG Y W. Cloning and expression ofsubsp.gene map0862 in.. Chinese Journal of Veterinary Drug, 2010, 44(8): 10-12, 21. (in Chinese)
[12] 刘虹秀, 程玉笛, 党光辉, 李田田, 李鹤, 崔子寅, 宋宁宁, 陈利苹, 刘思国. 牛副结核分枝杆菌的分离及鉴定. 中国预防兽医学报, 2018, 40(12): 1177-1180.
LIU H X, CHENG Y D, DANG G H, LI T T, LI H, CUI Z Y, SONG N N, CHEN L P, LIU S G. Isolation and identification ofsubsp.from cattle. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(12): 1177-1180. (in Chinese)
[13] 高建鹏, 赵鑫, 高静雯, 李慧, 张莉, 齐亚银. 马鹿源副结核分枝杆菌的分离鉴定. 动物医学进展, 2019, 40(9): 128-132. doi:10. 16437/j.cnki.1007-5038.2019.09.025.
GAO J P, ZHAO X, GAO J W, LI H, ZHANG L, QI Y Y. Isolation and identification ofsubsp.from red deer(). Progress in Veterinary Medicine, 2019, 40(9): 128-132. doi:10.16437/j.cnki.1007-5038.2019.09.025. (in Chinese)
[14] 洪都孜·波拉提, 魏玉荣, 孟肖潇, 杨学云, 古努尔·吐尔逊, 李建军, 吴建勇. 绵羊副结核分枝杆菌的分离与分子分型. 中国预防兽医学报, 2021, 43(2): 134-138.
HONGDUZI BOLATI, WEI Y R, MENG X X, YANG X Y, GUNUER TUERXUN, LI J J, WU J Y. Isolation and molecular typing of sheepsub species. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(2): 134-138. (in Chinese)
[15] 宋先忱, 李冰, 朱延旭, 张兴会, 王世泉, 郭伶, 徐鹏, 郭维军, 刘孝刚. 辽宁绒山羊副结核分枝杆菌的分离鉴定及分子生物学检测. 中国兽医杂志, 2018, 54(6): 32-34.
SONG X C, LI B, ZHU Y X, ZHANG X H, WANG S Q, GUO L, XU P, GUO W J, LIU X G. Isolation, identification and molecular biological detection offrom Liaoning cashmere goats. Chinese Journal of Veterinary Medicine, 2018, 54(6): 32-34. (in Chinese)
[16] AHLSTROM C, BARKEMA H W, STEVENSON K, ZADOKS R N, BIEK R, KAO R, TREWBY H, HAUPSTEIN D, KELTON D F, FECTEAU G, LABRECQUE O, KEEFE G P, MCKENNA S L B, DE BUCK J. Limitations of variable number of tandem repeat typing identified through whole genome sequencing ofsubsp.on a national and herd level. BMC Genomics, 2015, 16: 161. doi:10.1186/s12864-015-1387-6.
[17] MARCHESI J R, SATO T, WEIGHTMAN A J, MARTIN T A, FRY J C, HIOM S J, DYMOCK D, WADE W G. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA. Applied and Environmental Microbiology, 1998, 64(2): 795-799. doi:10.1128/AEM.64.2.795-799.1998.
[18] MARSH I, WHITTINGTON R, COUSINS D. PCR-restriction endonuclease analysis for identification and strain typing of Mycobacterium aviumsubsp.paratuberculosisandsubsp. avium based on polymorphisms in IS1311. Molecular and Cellular Probes, 1999, 13(2): 115-126. doi:10.1006/mcpr.1999.0227.
[19] COLLINS D M, DE ZOETE M, CAVAIGNAC S M.subsp.strains from cattle and sheep can be distinguished by a PCR test based on a novel DNA sequence difference. Journal of Clinical Microbiology, 2002, 40(12): 4760-4762. doi:10.1128/JCM.40.12.4760-4762.2002.
[20] STABEL J R. An improved method for cultivation offrom bovine fecal samples and comparison to three other methods. International Dental Journal, 1997, 9(4): 375-380. doi:10.1177/104063879700900406.
[21] WINDSOR P A.in sheep and goats. Veterinary Microbiology, 2015, 181(1/2): 161-169. doi:10.1016/j.vetmic.2015. 07.019.
[22] 蔡珠明, 党光辉, 臧鑫鑫, 邵明珠, 唐阳阳, 崔子寅, 宋宁宁, 刘思国. 黑龙江某规模化牛场副结核分枝杆菌的分离与鉴定. 中国预防兽医学报, 2020, 42(11): 1177-1180.
CAI Z M, DANG G H, ZANG X X, SHAO M Z, TANG Y Y, CUI Z Y, SONG N N, LIU S G. Isolation and identification ofsubsp.from a large-scale cattle farm in Heilongjiang. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(11): 1177-1180. (in Chinese)
[23] 常塔娜, 田莉莉, 许芳, 樊晓旭, 孙淑芳, 范伟兴. 甘肃省奶牛副结核分枝杆菌的调查与分离鉴定. 中国兽医科学, 2020, 50(7): 874-879. doi:10.16656/j.issn.1673-4696.2020.0123.
CHANG T N, TIAN L L, XU F, FAN X X, SUN S F, FAN W X. Investigation and isolation ofsubsp.in a cattle farm in Gansu Province, China. Chinese Veterinary Science, 2020, 50(7): 874-879. doi:10.16656/j.issn.1673- 4696.2020.0123. (in Chinese)
[24] SZTEYN J, LIEDTKE K, WISZNIEWSKA-ŁASZCZYCH A, WYSOK B, WOJTACKA J. Isolation and molecular typing ofsubsp.from faeces of dairy cows. Polish Journal of Veterinary Sciences, 2020, 23(3): 415-422. doi:10.24425/pjvs.2020.134686.
[25] PARK H T, PARK H T, PARK W B, KIM S, HUR T Y, JUNG Y H, YOO H S. Genetic diversity of bovinesubspdiscriminated by IS1311 PCR-REA, MIRU-VNTR, and MLSSR genotyping. Journal of Veterinary Science2018, 19(5): 627-624. DOI: https://doi.org/10.4142/jvs.2018.19.5.627.
[26] FAWZY A, ZSCHÖCK M, EWERS C, EISENBERG T. Genotyping methods and molecular epidemiology ofsubsp.(MAP). International Journal of Veterinary Science and Medicine, 2018, 6(2): 258-264. doi:10.1016/j.ijvsm.2018.08.001.
[27] WHITTINGTON R, MARSH I, CHOY E, COUSINS D. Polymorphisms in IS1311, an insertion sequence common toandsubsp., can be used to distinguish between and within these species. Molecular and Cellular Probes, 1998, 12(6): 349-358. doi:10.1006/mcpr.1998.0194.
[28] ZHAO L, WANG Y, WANG J L, ZHAO W H, CHENG H X, MA Y M, CHAI H L, ZHANG Z S, WANG L F, MIAO Z Q, DING Y L, SULIJID J, DANG G H, LIU S Y, WANG F L, LIU S G, LIU Y H. Serological investigation and genotyping ofsubsp.in sheep and goats in Inner Mongolia, China. PLoS ONE, 2021, 16(9): e0256628. doi:10.1371/journal.pone.0256628.
[29] COLLINS M T. Diagnosis of paratuberculosis. Veterinary Clinics of North America Food Animal Practice, 1996, 12(2): 357-371. DOI: 10.1016/s0749-0720(15)30411-4.
[30] LIAPI M, LEONTIDES L, KOSTOULAS P, BOTSARIS G, IACOVOU Y, REES C, GEORGIOU K, SMITH G C, NASEBY D C. Bayesian estimation of the true prevalence ofsubsp.infection in Cypriot dairy sheep and goat flocks. Small Ruminant Research, 2011, 95(2/3): 174-178. doi:10. 1016/j.smallrumres.2010.09.010.
[31] HOSSEINIPORGHAM S, CUBEDDU T, ROCCA S, SECHI L A. Identification ofsubsp.(MAP) in sheep milk, a zoonotic problem. Microorganisms, 2020, 8(9): E1264. doi:10.3390/microorganisms8091264.
[32] DZIEDZINSKA R, SLANA I.subsp.-an overview of the publications from 2011 to 2016. Current Clinical Microbiology Reports, 2017, 4(1): 19-28. doi:10. 1007/s40588-017-0054-x.
[33] 彭永. 副结核分枝杆菌分离及小鼠感染模型的建立[D]. 北京: 中国兽医药品监察所, 2018.
PENG Y. Isolation ofsubsp.and the establishment of mouse infection model[D]. Beijing: China Institute of Veterinary Drug Control, 2018. (in Chinese)
[34] 高建鹏. 塔河马鹿源副结核分枝杆菌的分离鉴定及部分生物学特性研究[D]. 石河子: 石河子大学, 2019.
GAO J P. Isolation, identification and some biological characteristics study ofSubsp.from Tarim red deer (yarkandensis) source[D]. Shihezi: Shihezi University, 2019. (in Chinese)
[35] RADOSEVICH T J, REINHARDT T A, LIPPOLIS J D, BANNANTINE J P, STABEL J R. Proteome and differential expression analysis of membrane and cytosolic proteins fromsubsp.strains K-10 and 187. Journal of Bacteriology, 2007, 189(3): 1109-1117. doi:10.1128/JB.01420-06.
[36] 马呼和, 东风, 杨万科. 羊传染性腹泻病的调查及防治试验. 畜禽业, 2015(2): 72-74. doi:10.19567/j.cnki.1008-0414.2015.02.048.
MA H H, DONG F, YANG W K. Investigation and control of infectious diarrhea in sheep. Livestock and Poultry Industry, 2015(2): 72-74. doi:10.19567/j.cnki.1008-0414.2015.02.048. (in Chinese)
[37] ALCEDO K P, THANIGACHALAM S, NASER S A. RHB-104 triple antibiotics combination in culture is bactericidal and should be effective for treatment of Crohn's disease associated with. Gut Pathogens, 2016, 8: 32. doi:10.1186/s13099- 016-0115-3.
[38] SHIN S J, COLLINS M T. Thiopurine drugs azathioprine and 6-mercaptopurine inhibitgrowth. Antimicrobial Agents and Chemotherapy, 2008, 52(2): 418-426. doi:10.1128/AAC.00678-07.
Isolation and Genotyping ofsubsp.from Sheep in Inner Mongolia

1College of Veterinary Medicine, Inner Mongolia Agricultural University/Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease, Ministry of Agriculture and Rural Affairs, Hohhot 010000;2Inner Mongolia Saikexing Reproductive Biotechnology (Group) Co.,Ltd., Hohhot, 011517;3Animal Disease Control Center of Ordos, Ordos 017000, Inner Mongolia
【Objective】Paratuberculosis is listed in the must-report at the list of “World Organization for Animal Health (OIE) diseases, infections and Invasion” by OIE. It is classified as the second kind of animal disease in China. It causes chronic and proliferative enteritis in many ruminants. The infected animals become a continuous source of infection in farms through intestinal intermittent excretion, which has brought great economic losses to aquaculture. The pathogen ofsubsp.(MAP) belongs to intracellular parasitic Gram-positive bacteria, and is a third group of zoological pathogenic microorganisms, including type C (also designated as type II) and type S. Type C also includes type B. Type S can be further subdivided into sub-group types I and III. And sub-lineages of camelid isolates Studies have shown that each subtype of MAP has no host specificity, but is regional. Inner Mongolia is the first region of the disease in China. It is of great significance to obtain and accurately identify the subtype and genetic characteristics of MAP strains in Inner Mongolia for the prevention and control of paratuberculosis. 【Method】28 MAP-positive sheep disease samples collected in Inner Mongolia were isolated and cultured by MAP, and the colonies were stained with Ziehl-Neelsen. The positive bacteria were propagated and the genomic DNA was extracted. IS900 gene, IS1311 gene and DMC gene were amplified, sequenced, and analyzed. The PCR products of IS1311 gene were identified byI andI double digestion. 【Result】28 samples were cultured for 7- 2 weeks, a total of 9 mediums grew colonies, and the colonies were translucent milky white smooth surface. Single colonies were selected for acid-fast staining, and irregular (single or branched), red-stained Brevibacterium was observed under the microscope, which was consistent with the morphological characteristics and acid-fast staining characteristics of Mycobacterium. The PCR products of IS900, IS1311 and DMC genes of 9 isolates were consistent with the expected size of the target gene fragment. 9 isolates were identified as MAP strains, named MAP-NM1 to MAP-NM9. DMC gene amplification product size of 310bp, which was consistent with type II MAP characteristics. IS1311 gene amplification products were digested byI andI restriction endonucleases, and 4 target bands were obtained in 9 strains of MAP, which were consistent with type II MAP. The sequencing results of IS1311 gene and the analysis of MAP representative strains of type I, type II, type III, Indian Buffalo and American Buffalo showed that the nucleotide sites at positions 64, 65, 68, 223, 236, 422, 527 and 628 of the nine MAP IS1311 gene fragments were conformed to the characteristics of type C and type B MAP. Sequence analysis of IS900 gene sequencing results showed that the 169th and 216th nucleotides of the nine MAP IS900 gene fragments were C (cytosine) and A (adenine), and accorded with Type II and type III MAP. The phylogenetic tree of 17 MAP IS900 gene reference sequences from GenBank database with 9 isolates in this study showed that the 9 isolates in this study were all in the type II MAP branch. Blast online analysis was performed on the sequencing results of the three genes. The reference sequences with the highest homology with the isolates obtained in this study were all type II MAP, and the homology was higher than 98%. In conclusion, all the 9 MAP isolates were type II MAP. 【Conclusion】To the best of our knowledge, this was the first isolate of the MAP type Ⅱ strains in sheep in Inner Mongolia.
subsp.; isolated; typing;sheep; Inner Mongolia

10.3864/j.issn.0578-1752.2023.06.015
2021-11-11;
2022-08-30
国家自然科学基金(31860698)、内蒙古农业大学高层次人才科研启动金项目(NDYB2019-3,NDYB2018-5)
赵维宏,E-mail:zhaoweihong@foxmail.com。通信作者赵丽,E-mail:zhaolidky@126.com。通信作者刘永宏,E-mail:lyhdky@126.com
(责任编辑 林鉴非)
