血浆维生素B12与阿尔茨海默病脑脊液的相关性
2023-04-08彭艳赵冰李鑫王皓张伟
彭艳 赵冰 李鑫 王皓 张伟

[摘要] 目的
探究血浆维生素B12的浓度与非痴呆人群阿尔茨海默病(AD)脑脊液生物标志物的相关性。
方法 将来自阿尔茨海默病神经成像计划数据库(http://adni.loni.usc.edu)的539名非痴呆者分为轻度认知功能障碍(MCI)和认知功能正常(CN)两组。建立多元线性回归模型,对年龄、性别、教育程度、载脂蛋白E基因型、高血压、糖尿病、高脂血症、吸烟和饮酒进行校正,探讨在非痴呆人群以及两个亚组中血浆维生素B12浓度与AD脑脊液生物标志物tau蛋白(tau)、磷酸化tau蛋白(p-tau)之间的关系。
结果 在非痴呆人群中,血浆维生素B12浓度与tau(β=-1.227e-04,P<0.05)、p-tau(β=-4.575e-05,P<0.05)呈显著负相关。亚组分析显示,MCI组血浆维生素B12浓度与tau(β=-1.688e-04,P<0.05)、p-tau(β=-1.718e-04,P<0.05)呈显著负相关;CN组血浆维生素B12浓度与tau(β=-5.983e-06,P>0.05)、p-tau(β=-2.375e-05,P>0.05)无显著相关性。
结论 血浆维生素B12浓度与非痴呆人群AD脑脊液生物标志物tau、p-tau显著相关。
[关键词] 维生素B12;阿爾茨海默病;认知功能障碍;生物标记
[中图分类号] R745.7
[文献标志码] A
[文章编号] 2096-5532(2022)06-0855-05
doi:10.11712/jms.2096-5532.2022.59.197
[网络出版] https://link.cnki.net/urlid/37.1517.R.20240104.1607.008;2024-01-05 20:14:21
ASSOCIATION BETWEEN PLASMA VITAMIN B12 AND CEREBROSPINAL FLUID BIOMARKERS FOR ALZHEIMERS DISEASE
PENG Yan, ZHAO Bing, LI Xin, WANG Hao, ZHANG Wei
(Affiliated Hospital of Weifang Medical University, School of Clinical Medicine, Weifang Medical University, Weifang 261053, China)
; [ABSTRACT]ObjectiveTo investigate the association between plasma vitamin B12 concentration and cerebrospinal fluid biomarkers for Alzheimers disease (AD) in the non-dementia population.
MethodsA total of 539 non-dementia subjects were selected from the Alzheimers Disease Neuroimaging Initiative database (http://adni.loni.usc.edu) and were then divided into mild cognitive impairment (MCI) group and cognitively normal (CN) group. A multiple linear regression model was established for the adjustment of age, sex, educational level, apolipoprotein E genotype, hypertension, diabetes, hyperlipidemia, smoking, and drinking, and the association of plasma vitamin B12 concentration with cerebrospinal fluid biomarkers (tau protein (tau) and phosphorylated tau protein (p-tau)) for AD was analyzed in the non-dementia population and the two subgroups.
ResultsIn the non-dementia population, plasma vitamin B12 concentration was significantly negatively correlated with tau (β=-1.227e-04,P<0.05) and p-tau (β=-4.575e-05,P<0.05). The subgroup analysis showed that in the MCI group, plasma vitamin B12 concentration was significantly negatively correlated with tau (β=-1.688e-04,P<0.05) and p-tau (β=-1.718e-04,P<0.05), while in the CN group, plasma vitamin B12 concentration was not significantly correlated with tau (β=-5.983e-06,P>0.05) or p-tau (β=-2.375e-05,P>0.05).
ConclusionPlasma vitamin B12 concentration is significantly correlated with the cerebrospinal fluid biomarkers tau and p-tau for AD in the non-dementia population.
[KEY WORDS]vitamin B12; Alzheimer disease; cognitive dysfunction; biomarkers
阿尔茨海默病(AD)是一种严重的脑神经退行性疾病,以β-淀粉样蛋白(Aβ)、神经元纤维缠结、胆碱能神经元死亡、血管病理和炎症为特征 。AD是老年期最常见的痴呆类型,约占所有痴呆病例的60%~80%。随着我国逐步进入老龄化社会,AD越来越受到国内外研究者的关注。有研究表明,维生素B12缺乏可能与老年人进行性脑萎缩有关。低水平的维生素B12和叶酸会影响痴呆症病人的记忆等认知功能。增加老年人维生素B12的摄入量可能会显著降低与年龄相关的脑萎缩的风险。本文探讨血浆维生素B12浓度与非痴呆人群AD脑脊液生物标志物的相关性,现将结果报告如下。
1 资料与方法
1.1 研究对象
研究对象数据来自阿尔茨海默病神经成像倡议
(ADNI)数据库。纳入标准:①年龄55~90岁;②具备完整的研究所需数据;③轻度认知功能障碍(MCI)者,简易精神状态检查量表(MMSE)评分≥24分,临床痴呆评定量表(CDR)评分0.5分,韦氏记忆量表逻辑记忆Ⅱ延迟回忆测试客观记忆丧失(标准差>1,低于正常均值),日常生活能力正常,无痴呆;认知功能正常(CN)者MMSE评分≥24分,临床痴呆评定量表总分为0;④研究对象知情同意。排除标准:①患有可能影响AD脑脊液水平的严重全身性疾病(如恶性肿瘤)者;②有遗传病家族史者;③口服补充维生素B12的药物或影响维生素B12测量结果药物者。
1.2 研究方法
从数据库提取相关资料,包括年龄、性别、教育程度、载脂蛋白E基因型、高血压、糖尿病、高脂血症、吸烟、饮酒、维生素B12浓度、Aβ、tau、p-tau、海马体积和MMSE评分。将血浆维生素B12浓度去除高于或低于平均值3个标准差的极值,按照四分位数进行分组,分为A组(维生素B12≤324 pmol/L)、B组(324 pmol/L<维生素B12≤461 pmol/L)、C组(461 pmol/L<维生素B12≤639 pmol/L)和D组(维生素B12>639 pmol/L)。分别在非痴呆人群、MCI组、CN组中,以正态转化后的AD脑脊液生物标志物为因变量,以年龄、性别、教育程度、载脂蛋白E基因型、高血压、糖尿病、高脂血症、吸烟、饮酒和血浆维生素B12浓度为自变量建立多元线性回归模型,探究校正混杂因素后不同浓度的血浆维生素B12与AD脑脊液生物标志物的相关性。
1.3 相关指标检测方法
1.3.1 维生素B12浓度和AD脑脊液标志物的检测
采集研究对象空腹静脉血浆样本,应用免疫分析法检测血浆维生素B12浓度。血浆成分分析采用安捷伦科技公司6490QQQ质谱仪、1290系列高效液相色谱系统以及ZORBAX Eclipse plus C18色谱柱(2.1 mm×100 mm,1.8 μm),质谱分析采用正离子模式,动态程序多反应监测。使用安捷伦科技公司软件(Mass Hunter B9.00)对质谱结果进行整合。Aβ、tau、p-tau浓度由INNOBIA AlzBio3(Ghent, Belgium)免疫分析試剂盒测定。
1.3.2 海马体积测量 使用MRI 1.5-T成像系统进行脑扫描,采用标准化方案,包括T1加权图像;使用矢状位、容积、磁化准备的梯度回波序列快速采集。应用Free Surfer(http://surfer.nmr.mgh.harvard.edu/fswiki)进行自动容量测量,海马体积为双侧海马的平均体积。
1.4 疾病及相关指标判定标准
①高血压:收缩压/舒张压≥18.7/12.2 kPa和(或)已确诊高血压并治疗者;②糖尿病:随机或餐后2 h血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L,和(或)确诊为糖尿病并治疗者;③高脂血症:空腹血清总胆固醇水平>5.7 mmol/L,三酰甘油>1.7 mmol/L或高密度脂蛋白胆固醇<0.9 mmol/L(男)、<1.0 mmol/L(女),和(或)确诊为高脂血症并治疗者;④吸烟:平均≥10支/天;⑤饮酒:乙醇平均摄入量>24 g/d。
1.5 统计学分析
应用SPSS 23.0和R编程语言64 4.0.4软件进行统计学处理。采用Shapiro-Wilk法对计量资料进行正态性检验,符合正态分布的数据以±s表示,组间比较采用单因素方差分析;偏态分布数据以M(P25,P75)表示,组间比较采用H检验;计数资料以频数和百分率表示,组间比较采用卡方检验。正态性检验显示,总人群中Aβ、tau、p-tau、MMSE评分、海马体积为偏态分布资料,MCI和CN组Aβ、tau、p-tau、MMSE评分为偏态分布资料,进行Box-Cox转换使之呈正态分布,以进行下一步分析。回归模型中用方差膨胀因子(VIF)评估共线性的量度,VIF值均<2,自变量间无多重共线性。以P<0.05为差异有统计学意义。
2 结 果
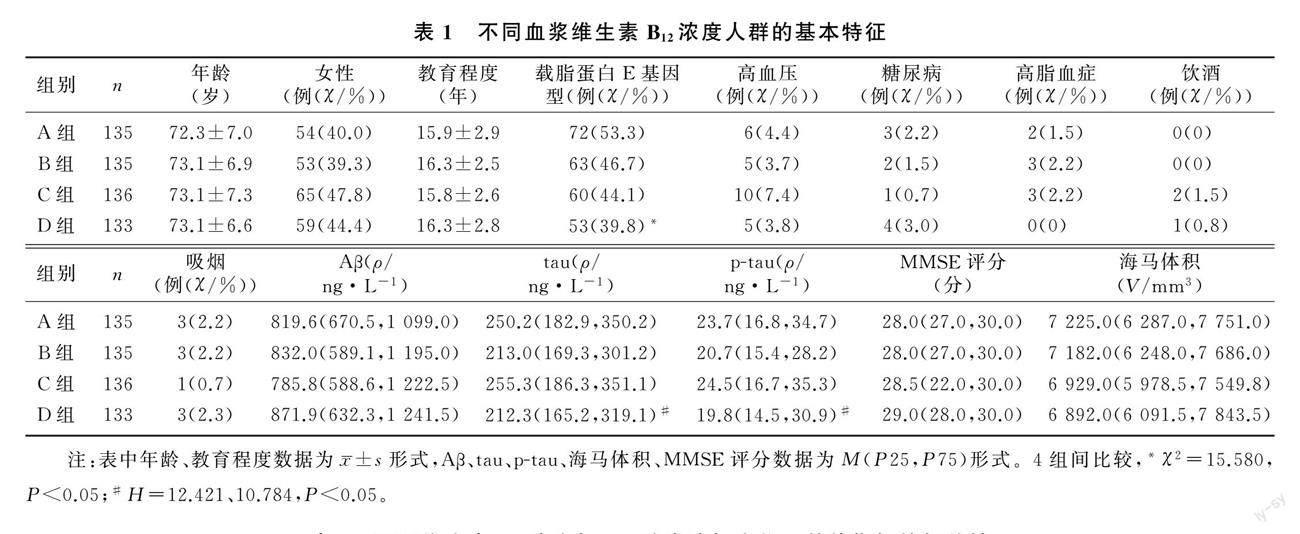
2.1 不同维生素B12浓度人群的基本特征
A、B、C、D组年龄、性别、教育程度、高血压、糖尿病、高脂血症、饮酒、吸烟、Aβ水平、海马体积、MMSE评分差异无统计学意义(P>0.05);而4组间载脂蛋白E基因型(χ2=15.580,P<0.05)、tau(H=12.421,P<0.01)、p-tau(H=10.784,P<0.05)差异有统计学意义。见表1。
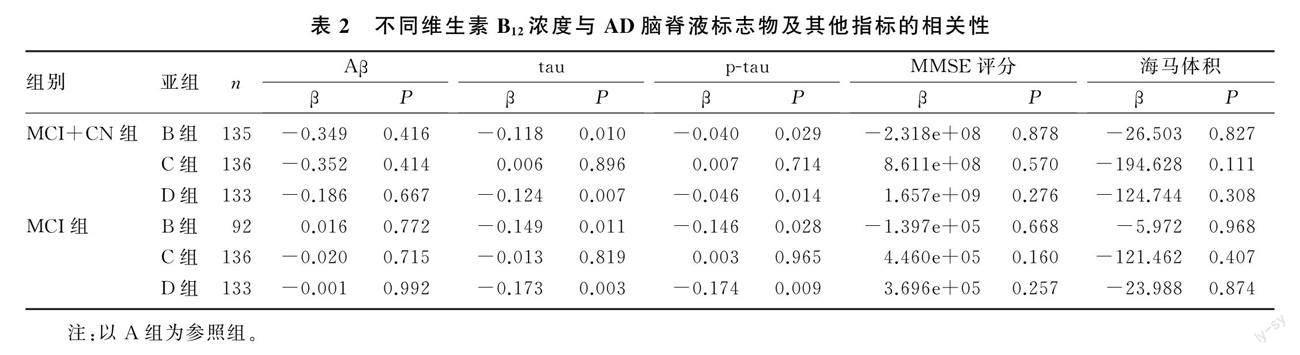
2.2 不同維生素B12浓度与AD脑脊液标志物及其他指标的相关性
在非痴呆总人群(MCI+CN组),以A组为参照组,B组维生素B12浓度与tau(β=-0.118,P<0.01)、p-tau(β=-0.040,P<0.05)呈显著负相关,D组维生素B12浓度与tau(β=-0.124,P<0.01)、p-tau(β=-0.046,P<0.05)呈显著负相关;在MCI组中,以A组为参照组,B组维生素B12浓度与tau(β=-0.149,P<0.05)、p-tau(β=-0.146,P<0.05)呈显著负相关,D组维生素B12浓度与tau(β=-0.173,P<0.01)、p-tau(β=-0.174,P<0.01)呈显著负相关。在非痴呆人群和MCI组,C组维生素B12浓度与tau、p-tau均无显著相关性(P>0.05);各组维生素B12浓度与Aβ、MMSE评分、海马体积均无显著相关性(P>0.05)。见表2。
2.3 不同人群维生素B12浓度与AD脑脊液标志物及其他指标相关性
在非痴呆人群(MCI+CN组)中,维生素B12浓度与tau(β=-1.227e-04,P<0.05)、p-tau(β=-4.575e-05,P<0.05)呈显著负相关,与Aβ(β=-0.001,P>0.05)、海马体积(β=-0.196,P>0.05)、MMSE评分(β=2.176e+06,P>0.05)无显著相关性。在MCI组中,维生素B12浓度与tau(β=-1.688e-04,P<0.05)、p-tau(β=-1.718e-04,P<0.05)呈显著负相关,与Aβ(β=-4.719e-05,P>0.05)、海马体积(β=-2.938e-02,P>0.05)、MMSE评分(β=610.400,P>0.05)无显著相关性。在CN组中,维生素B12浓度与海马体积呈显著负相关(β=-0.426,P<0.05),与Aβ(β=-0.067,P>0.05)、tau(β=-5.983e-06,P>0.05)、p-tau(β=-2.375e-05,P>0.05)、MMSE评分(β=9.575e+19,P>0.05)无相关性。见表3。
3 讨 论
维生素B12是一种水溶性化合物,维生素B12缺乏是高同型半胱氨酸血症最常见的原因之一。维生素B12是蛋氨酸合成酶的重要辅助因子,能将同型半胱氨酸转化为蛋氨酸。同型半胱氨酸可通过多种机制来调节活性氧化物(ROS)的积累,包括同型半胱氨酸的自氧化,产生过氧化氢;以及抑制细胞抗氧化酶,即谷胱甘肽过氧化物酶和超氧化物歧化酶活性。维生素B12也可以直接清除ROS,特别是胞浆和线粒体中的超氧化物,并可以通过补充谷胱甘肽间接刺激ROS清除[18-22]。神经元容易受到氧化应激的影响,因为它们含有抗氧化剂谷胱甘肽和多不饱和脂肪酸,可以与ROS相互作用,导致脂质过氧化和分子破坏,从而损伤神经元[23]。维生素B12参与了细胞能量过程、髓鞘和神经递质的合成[24-26]。髓鞘碱性蛋白约占髓鞘蛋白的1/3,维生素B12缺乏引起的脱髓鞘改变与认知功能下降有关[6,18,27-28]。维生素B12可通过调节白细胞介素6、肿瘤坏死因子-α和表皮生长因子的产生,保护机体免受炎症引起的氧化应激损伤[29-32]。白细胞介素6已被证明可诱导tau过度磷酸化[24]。
有研究表明,AD的演变过程与维生素B12浓度降低有关[8,33]。补充维生素B12可以减缓与认知能力下降有关的特定大脑区域的萎缩[16]。对特异性的维生素B12相关生物标志物,如甲基丙二酸和全反式钴胺的研究表明,智力下降与维生素B12低水平有关[8]。本研究通过ADNI数据库,探究血浆维生素B12浓度与非痴呆人群AD脑脊液的相关性,进一步明确血液生物标记物作为AD预测标记物的可行性。本文研究结果显示,在非痴呆人群中,血浆维生素B12浓度与tau、p-tau呈显著负相关;亚组分析显示,MCI组血浆维生素B12浓度与tau、p-tau呈显著负相关,CN组血浆维生素B12浓度与tau、p-tau无显著相关性。说明血浆维生素B12浓度与非痴呆人群AD脑脊液tau、p-tau显著相关。本文研究结果可为AD的预防、早期诊断及治疗提供新的思路。
有研究表明,维生素B12以浓度依赖的方式抑制Aβ的聚集,并且对淀粉样蛋白诱导的人类神经细胞的细胞毒性有保护作用。然而,本研究中未发现血浆维生素B12浓度与Aβ的相关性。考虑主要原因是:本研究对象为非痴呆人群,并不是所有个体的脑脊液生物标志物的沉积都达到了平台期,这可能影响了研究结果。不列颠哥伦比亚省的指南和方案咨询委员会发布的《老年人认知障碍诊断指南》指出,对轻度认知障碍或痴呆症病人早期进行维生素B12干预治疗可以改善病人的认知水平[7]。
综上所述,血浆维生素B12浓度与非痴呆人群AD脑脊液生物标志物tau、p-tau的沉积密切相关,血浆维生素B12水平可能通过影响AD早期阶段脑脊液的生物标志物,导致认知功能下降。
[参考文献]
[1]WELLER J, BUDSON A. Current understanding of Alzheimers disease diagnosis and treatment[J]. F1000Research, 2018,7: F1000FacultyRev-F1000Faculty1161.
[2]张赫,郑焱. β淀粉样蛋白级联假说相关的阿尔茨海默病发病机制及防治策略研究进展[J]. 中国医学科学院学报, 2019,41(5):702-708.
[3]MANTZAVINOS V, ALEXIOU A. Biomarkers for Alzheimers disease diagnosis[J]. Current Alzheimer Research, 2017,14(11):1149-1154.
[4]BLASKO I, DEFRANCESCO M, OBERACHER H, et al. Plasma phosphatidylcholines and vitamin B12/folate levels are possible prognostic biomarkers for progression of Alzheimers disease[J]. Experimental Gerontology, 2021,147:111264.
[5]ALAM P, SIDDIQI M K, CHATURVEDI S K, et al. Vitamin B12 offers neuronal cell protection by inhibiting Aβ-42 amyloid fibrillation[J]. International Journal of Biological Macromolecules, 2017,99:477-482.
[6]GRBER U, KISTERS K, SCHMIDT J. Neuroenhancement with vitamin B12-underestimated neurological significance[J]. Nutrients, 2013,5(12):5031-5045.
[7]LEE Y M, HA J K, PARK J M, et al. Apolipoprotein E ge-
notype modulates effects of vitamin B12 and homocysteine on grey matter volume in Alzheimers disease[J]. Psychogeriatrics: the Official Journal of the Japanese Psychogeriatric Society, 2016,16(1):3-11.
[8]SANTOS G A A D, PARDI P C. Biomarkers in Alzheimers disease: evaluation of platelets, hemoglobin and vitamin B12[J]. Dementia & Neuropsychologia, 2020,14(1):35-40.
[9]HEALTH QUALITY ONTARIO. Vitamin B12 and cognitive function: an evidence-based analysis[J]. Ontario Health Technology Assessment Series, 2013,13(23):1-45.
[10]HU H, CHEN K L, OU Y N, et al. Neurofilament light chain plasma concentration predicts neurodegeneration and clinical progression in nondemented elderly adults[J]. Aging, 2019,11(17):6904-6914.
[11]MA Y H, SHEN X N, XU W, et al. A panel of blood lipids associated with cognitive performance, brain atrophy, and Alzheimers diagnosis: a longitudinal study of Elders without dementia[J]. Alzheimers & Dementia (Amsterdam, Netherlands), 2020,12(1): e12041.
[12]DOUAUD G, REFSUM H, DE JAGER C A, et al. Preventing Alzheimers disease-related gray matter atrophy by B-vitamin treatment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013,110(23):9523-9528.
[13]吉璐,陳慧,周玉颖,等. 血中叶酸、维生素B12及蛋氨酸循环产物与阿尔茨海默病关系的人群研究[J]. 营养学报, 2015,37(3):235-238.
[14]BOSTON P F, MCKIRDY S J, AL-TURKI M A, et al. Vita- min B12 and folate levels in progression of Alzheimers di-
sease-a short report[J]. International Journal of Psychiatry in Clinical Practice, 2020,24(1):68-70.
[15]GAGLIANO TALIUN S A. Genetic determinants of low vitamin B12 levels in Alzheimers disease risk[J]. Alzheimers & Dementia (Amsterdam, Netherlands), 2019,11:430-434.
[16]CHO H S, HUANG L K, LEE Y T, et al. Suboptimal baseline serum vitamin B12 is associated with cognitive decline in people with Alzheimers disease undergoing cholinesterase inhibitor treatment[J]. Frontiers in Neurology, 2018,9:325.
[17]SHEN L, JI H F. Associations between homocysteine, folic acid, vitamin B12 and Alzheimers disease: insights from Meta-analyses[J]. Journal of Alzheimers Disease, 2015,46(3):777-790.
[18]MOREIRA E S, BRASCH N E, YUN J E. Vitamin B12 protects against superoxide-induced cell injury in human aortic endothelial cells[J]. Free Radical Biology and Medicine, 2011,51(4):876-883.
[19]CHAN W, ALMASIEH M, CATRINESCU M M, et al. Cobalamin-associated superoxide scavenging in neuronal cells is a potential mechanism for vitamin B12-deprivation optic neuro-
pathy[J]. The American Journal of Pathology, 2018,188(1):160-172.
[20]MANZANARES W, HARDY G. Vitamin B12: the forgotten micronutrient for critical care[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010,13(6):662-668.
[21]KARAMSHETTY V, ACHARYA J D, GHASKADBI S, et al. Mathematical modeling of glutathione status in type 2 diabetics with vitamin B12 deficiency[J]. Frontiers in Cell and Developmental Biology, 2016,4:16.
[22]WEISS N. Mechanisms of increased vascular oxidant stress in hyperhomocys-teinemia and its impact on endothelial function[J]. Current Drug Metabolism, 2005,6(1):27-36.
[23]LAUER A A, GRIMM H S, APEL B, et al. Mechanistic link between vitamin B12 and Alzheimers disease[J]. Biomolecules, 2022,12(1):129.
[24]KENNEDY D O. B vitamins and the brain: mechanisms, dose and efficacy: a review[J]. Nutrients, 2016,8(2):68.
[25]EVANS J R, LAWRENSON J G. Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration[J]. The Cochrane Database of Systema-
tic Reviews, 2017,7(7): CD000254.
[26]CALDERN-OSPINA C A, NAVA-MESA M O. B Vitamins in the nervous system: current knowledge of the biochemical modes of action and synergies of thiamine, pyridoxine, and cobalamin[J]. CNS Neuroscience & Therapeutics, 2020,26(1):5-13.
[27]COPPED F, TANNORELLA P, PEZZINI I, et al. Folate, homocysteine, vitamin B12, and polymorphisms of genes participating in one-carbon metabolism in late-onset Alzheimers disease patients and healthy controls[J]. Antioxidants & Re-
dox Signaling, 2012,17(2):195-204.
[28]IKEDA T, FURUKAWA Y, MASHIMOTO S, et al. Vitamin B12 levels in serum and cerebrospinal fluid of people with Alzheimers disease[J]. Acta PsychiatricaScandinavica, 1990,82(4):327-329.
[29]HAMA Y K, HAMANO T, SHIRAFUJI N, et al. Influences of folate supplementation on homocysteine and cognition in patients with folate deficiency and cognitive impairment[J]. Nutrients, 2020,12(10):3138.
[30]POLITIS A, OLGIATI P, MALITAS P, et al. Vitamin B12 levels in Alzheimers disease: association with clinical features and cytokine production[J]. Journalof Alzheimers Disease, 2010,19(2):481-488.
[31]BIRCH C S, BRASCH N E, MCCADDON A, et al. A novel role for vitamin B12: Cobalamins are intracellular antioxidants in vitro[J]. Free RadicalBiologyand Medicine, 2009,47(2):184-188.
[32]QUINTANILLA R A, ORELLANA D I,GONZLEZ-BILLAULT C, et al. Interleukin-6 induces Alzheimer-type phosphorylation of tau protein by deregulating the cdk5/p35 pathway[J]. Experimental Cell Research, 2004,295(1):245-257.
[33]FAUX N G, ELLIS K A, PORTER L, et al. Homocysteine, vitamin B12, and folic acid levels in Alzheimers disease, mild cognitive impairment, and healthy elderly: baseline characte-
ristics in subjects of the Australian Imaging Biomarker Lifestyle study[J]. Journal of Alzheimers Disease: JAD, 2011,27(4):909-922.
(本文編辑 黄建乡)