甾醇类化合物降低高胆固醇HepG2细胞内胆固醇的作用机制
2023-04-06谢建华郭小妹袁兰兰申明月
谢建华,郭小妹,袁兰兰,余 强,陈 奕,申明月*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
甾醇类化合物是一类来自于植物或真菌的天然活性物质,其主要膳食来源是植物油、谷物、坚果、豆类和食用菌等。这些甾醇类化合物的结构与胆固醇相似,但仅在植物或真菌中合成。甾醇类化合物具有许多重要的生物活性,例如降胆固醇、抗炎、抗肿瘤、抗菌等[1-2],其中降胆固醇作用尤为明显,被称为“胆固醇的克星”,国内外关于甾醇类化合物降胆固醇的研究也越来越多。研究表明甾醇类化合物可以显著降低血清总胆固醇(total cholesterol,TC)、血清甘油三酯(triglycerides,TG)、肝脂水平和致动脉粥样硬化指数(即高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)/低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C))[3-5],促进胆固醇排出,增加小鼠粪便胆固醇含量[6]。
近年来,由于不良的饮食习惯和生活方式,人群血脂水平明显增加。血脂异常是以人体内脂蛋白代谢异常为特征,主要包括TC、LDL-C、TG水平的升高和/或HDL-C水平的降低等。血脂异常是心血管疾病的主要诱因和危险因素。人体内的血浆胆固醇稳态主要受肝脏内源性合成、肠道对膳食胆固醇的吸收以及胆汁的清除和排泄控制。在过去的几十年里,科学家们已达成共识,营养和饮食管理是预防血脂异常,从而最大限度降低心血管疾病风险的关键策略[7]。增加富含甾醇类食物的摄入有助于改善血脂水平,降低胆固醇,预防心血管疾病。
目前,关于甾醇类化合物降胆固醇活性的研究主要集中于植物甾醇如β-谷甾醇、豆甾醇、菜油甾醇等,对于来源于食用菌类的甾醇研究很少,且大多都停留在表象指标研究阶段,其作用机理仍不明确。本研究以麦角甾醇、麦角甾醇酯、(22E)-麦角甾-4,6,8(14),22-四烯-3-酮((22E)-ergosta-4,6,8(14),22-tetrean-3-one,(22E)-Ergosta)、星鱼甾醇为研究对象,通过构建高胆固醇HepG2细胞模型,探究其对胆固醇水平的影响及其作用机制。
1 材料与方法
1.1 材料与试剂
人肝肿瘤细胞系HepG2来源于中国科学院细胞库。
麦角甾醇(批号:E0018,纯度>95%) 梯希爱(上海)化成工业发展有限公司;麦角甾醇酯(纯度97%,批号:12-CF-135-3)、(22E)-Ergosta(纯度98%,批号:4-EKP-158-1)、星鱼甾醇(纯度94%,批号:7-VHP-132-1) 加拿大Toronto Research Chemicals公司;DMEM培养基、油红O染色液(细胞专用) 北京索莱宝科技有限公司;胎牛血清 以色列Biological Industries公司;胆固醇、25-羟基胆固醇、辛伐他汀上海阿拉丁生化科技股份有限公司;CCK8试剂盒日本同仁化学研究所;细胞裂解液、细胞总蛋白提取试剂盒、ECL化学发光试剂盒 上海碧云天生物技术研究所;兔单克隆尼曼-匹克C1型类似蛋白1(Niemann-Pick type C1-like 1,NPC1L1)抗体、兔单克隆ATP结合盒转运体G5(ATP-binding cassette transporter G5,ABCG5)抗体、兔单克隆固醇调节元件结合蛋白2(sterolregulatory element binding protein 2,SREBP2)抗体、小鼠β-actin抗体 美国Abcam公司;兔单克隆ABCG8抗体、兔单克隆胆固醇酰基转移酶2(acetyl-coenzyme A acetyltransferase,ACAT2)抗体、兔单克隆羟甲基戊二酸单酰辅酶A合成酶(3-hydroxy-3-methylglutarylcoenzyme A synthase,HMGCS1)抗体 美国Cell Signaling Technology公司;辣根过氧化物酶标记山羊抗鼠、山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗 北京中杉金桥生物技术有限公司;TG、总蛋白定量检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
MULTISKAN MK3酶标仪、HERACELL 150i二氧化碳细胞恒温培养箱 美国Thermo Scientific公司;Research plus单道固定量程移液器 德国艾本德公司;CKX53倒置显微镜 日本Olympus公司;GelDoc XR Biorad凝胶成像系统、Mini-PROTEAN Tetra电泳仪、1704150全能型蛋白转印系统 美国Bio-Rad公司;1260超高效液相色谱仪 美国Agilent Technologies公司。
1.3 方法
1.3.1 HepG2细胞的培养及实验分组
HepG2细胞培养于含10%胎牛血清的DMEM培养基,每2~3 d按照1∶3比例传代,取对数生长期细胞经胰蛋白酶消化,按2×105个/孔接种于6 孔板。实验分为4 组:空白对照组:加入2 mL无血清培养基;模型组:加入2 mL无血清培养基配制的胆固醇(10 μg/mL)和25-羟胆固醇(1 μg/mL)混合溶液[8-9];阳性对照组:加入2 mL以无血清培养基配制的胆固醇(10 μg/mL)、25-羟胆固醇(1 μg/mL)和辛伐他汀(10 μmol/L)混合溶液;甾醇类化合物处理组:加入2 mL无血清培养基配制的胆固醇(10 μg/mL)、25-羟胆固醇(1 μg/mL)及不同浓度甾醇类化合物(25、50、100 μmol/L)的混合溶液。各组细胞培养24 h后用于后续实验。
1.3.2 细胞存活率测定
将对数生长期HepG2细胞(1×104个/孔)接种于96 孔板。细胞贴壁后,无血清培养基同化处理12 h,然后分别加入200 μL浓度为25、50、100 μmol/L的各甾醇溶液处理24 h,按照CCK8试剂盒说明书测定光密度值(OD450nm)。以不加甾醇溶液为空白对照组,以不接种细胞、不加甾醇溶液为空白,根据下式计算细胞存活率。根据细胞存活率结果确定甾醇作用浓度。
1.3.3 细胞内TG相对含量测定
将对数生长期HepG2细胞以2×105个/孔接种于6 孔板中,按照分组处理各组细胞。吸去细胞上清液,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3 次,加入100 μL细胞裂解液,轻晃使裂解液充分作用,将细胞收集于离心管中,2 000 r/min、4 ℃离心5 min,取上清液。按照试剂盒说明书测定细胞内TG含量。模型组、阳性对照组和甾醇类化合物处理组TG相对含量均以其相对空白对照组的含量表示,单位为%。
1.3.4 细胞内TC相对含量测定
细胞按照分组处理完成后,4 ℃、1 000 r/min离心10 min收集细胞。加入100 μL细胞裂解液,振荡涡旋30 s,静置5 min,反复处理6 次,离心后收集上清液,采用总蛋白定量检测试剂盒测定上清蛋白质量浓度。取细胞上清于EP管中,加入等体积质量分数15% KOH-乙醇溶液,涡旋5 min,40 ℃水浴超声皂化1 h,加入数滴质量分数6%三氯乙酸溶液去除蛋白,涡旋5 min,加入等体积正己烷-异丙醇(3∶2,V/V)充分混匀,室温12 500 r/min离心15 min,收集上层有机相,剩余溶液反复抽提4 次。合并有机相,氮吹至近干,加入1 mL流动相复溶,室温12 500 r/min离心15 min,取上清液,滤膜过滤后进样,进行超高效液相色谱分析。
检测条件:ZORBAX SB-C18色谱柱(4.6 mm×150.0 mm,5 μm),流动相为乙腈-异丙醇(67∶33,V/V),检测器为二极管阵列检测器,检测波长206 nm、柱温20 ℃、进样量20 μL、流速1 mL/min,等度洗脱。模型组、阳性对照组和甾醇类化合物处理组的TC相对含量均以其相对空白对照组的含量表示,单位为%。
1.3.5 油红O和Filipin III染色并观察细胞结构
将对数生长期细胞以2.5×105个/孔接种于6 孔板,按前述分组处理48 h。根据油红O染色液(细胞专用)试剂盒说明书对细胞染色,显微镜获取图像。
将对数生长期细胞接种在13 mm盖玻片上,用胆固醇合成抑制剂辛伐他汀处理24 h,质量分数4%多聚甲醛溶液室温固定30 min,PBS冲洗后,细胞用50 μg/mL的Filipin III避光染色45 min,PBS漂洗,并用显微镜观察拍照。
1.3.6 蛋白免疫印迹法检测HepG2细胞胆固醇调控相关蛋白的表达
细胞按照上述分组分别处理后,用预冷的PBS洗3 遍,收集各组细胞,每管加入150 μL细胞裂解液,冰上裂解5 min。随后4 ℃、12 000 r/min离心10 min,取上清液,部分用于蛋白定量,剩余上清液加入Loading Buffer变性后保存于-80 ℃备用。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转移至聚偏二氟乙烯膜,5%牛血清白蛋白封闭1 h,加入相应抗体,4 ℃过夜,用TBST洗膜3 次,每次15 min,然后加入相应的辣根过氧化物酶标记二抗,室温孵育1 h。用TBST洗膜3 次后在聚偏二氟乙烯膜上均匀加入ECL化学发光试剂,使用凝胶成像仪显影。以β-actin条带灰度作为参照,计算靶蛋白的相对表达水平。
1.4 数据处理与分析
所有实验均重复3 次,结果用平均值±标准偏差表示。使用Origin 2021软件进行图形绘制,使用SPSS Statistics 21软件进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 甾醇类化合物对HepG2细胞存活率的影响
为确定甾醇类化合物是否对细胞活力和增殖有影响,使用CCK8试剂盒检测不同浓度甾醇类化合物对HepG2细胞的毒性作用。如图1A所示,不同浓度各甾醇类化合物处理组与空白对照组的细胞存活率均无显著差异,说明甾醇化合物的加入对细胞活力没有影响,所选择的浓度可用于后续实验。
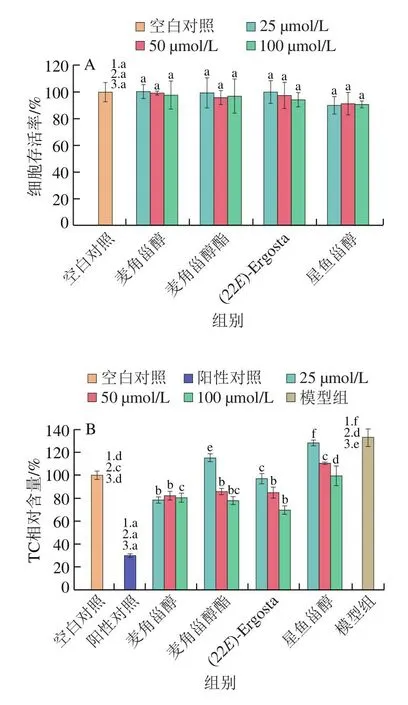

图1 甾醇类化合物对HepG2细胞存活率(A)、细胞内TC(B)和TG(C)水平的影响(n=3)Fig.1 Effect of sterol compounds on the viability (A) and intracellular TC (B) and TG (C) levels of HepG2 cells (n = 3)
2.2 甾醇类化合物对细胞TC水平的影响
如图1B所示,胆固醇和25-羟胆固醇处理细胞后,模型组细胞内TC水平相较于空白对照组显著升高(P<0.05),与模型组相比,甾醇类化合物处理组TC水平发生不同程度的下降。浓度为25 μmol/L时,麦角甾醇组TC水平最低,其次为(22E)-Ergosta和麦角甾醇酯组,星鱼甾醇组TC水平最高;浓度为50 μmol/L时,麦角甾醇、麦角甾醇酯和(22E)-Ergosta组之间无显著差异(P>0.05),TC水平均显著低于星鱼甾醇组;浓度为100 μmol/L时,麦角甾醇酯和(22E)-Ergosta组TC水平较低,其次为麦角甾醇组,星鱼甾醇组TC水平最高。
2.3 甾醇类化合物对细胞TG水平的影响
TG是重要的脂质组分,如图1C所示,与模型组相比,4 种甾醇均显著降低了高TC细胞内TG水平(P<0.05)。高浓度(100 μmol/L)时麦角甾醇酯降TG效果最佳,与阳性对照组辛伐他汀相当,其余3 组间无显著差异;低浓度(25 μmol/L)时麦角甾醇的降TG效果最好;浓度为50 μmol/L时,麦角甾醇、麦角甾醇酯和(22E)-Ergosta组间TG水平没有显著差异,降TG效果均优于星鱼甾醇(P<0.05)。
2.4 甾醇类化合物对HepG2细胞脂质蓄积的影响
油红O可以特异性使细胞脂质染红,通过颜色分布和程度可以观察细胞内脂质分布情况。图2显示,胆固醇和25-羟胆固醇处理细胞后颜色较正常组更红,说明脂质含量明显增加,阳性药物和甾醇类化合物处理后的细胞红色分布减少,说明它们不同程度减少了HepG2细胞内的脂质蓄积,并且甾醇类化合物对细胞内脂质的减少作用呈浓度依赖性,其中(22E)-Ergosta作用最为明显。结果表明甾醇类化合物可以降低胆固醇和25-羟胆固醇诱导的细胞内脂质积聚。
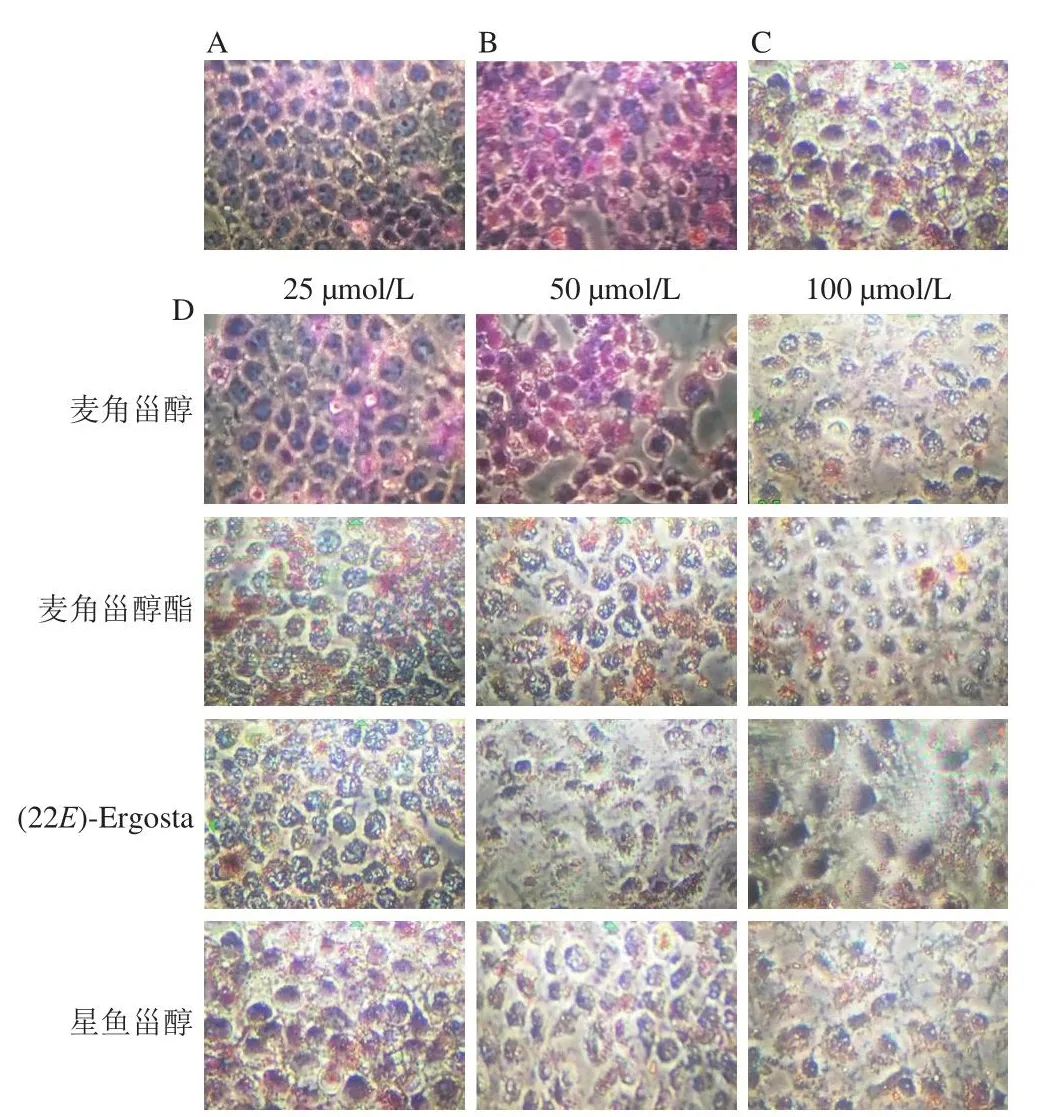
图2 甾醇类化合物对HepG2细胞脂质蓄积的影响(×200)Fig.2 Effect of sterol compounds on lipid accumulation in HepG2 cells (× 200)
2.5 甾醇类化合物对HepG2细胞胆固醇代谢相关蛋白表达的影响
上述结果表明甾醇类化合物可以降低胆固醇和25-羟胆固醇诱导HepG2细胞内TC、TG水平并抑制脂质积聚。为进一步探究甾醇类化合物降低细胞内胆固醇的作用机制,分析胆固醇代谢相关蛋白表达水平变化。如图3、4所示,相较于模型组,4 种甾醇类化合物均抑制了NPC1L1的表达,且抑制作用呈现剂量依赖性。其中高浓度麦角甾醇酯下调NPC1L1表达的效果与阳性对照辛伐他汀相近。与模型组相比,甾醇类化合物不同程度上调了ABCG5/8的表达,其中麦角甾醇的上调作用最为显著,这与阳性对照辛伐他汀的作用效果相反。随着作用浓度的上升,麦角甾醇酯、(22E)-Ergosta及星鱼甾醇上调ABCG8蛋白表达的能力增强。HMGCS1和SREBP2是调控胆固醇合成的关键蛋白[10-11],ACAT2可将胆固醇酯化,随后组装成乳糜微粒进入淋巴循环[12],本实验发现4 种甾醇类化合物均可有效下调HMGCS1、SREBP2和ACAT2蛋白的表达。

图3 甾醇类化合物作用下HepG2细胞胆固醇代谢相关蛋白表达免疫印迹图Fig.3 Western blot analysis of cholesterol metabolism-related protein expression in HepG2 cells treated with sterols

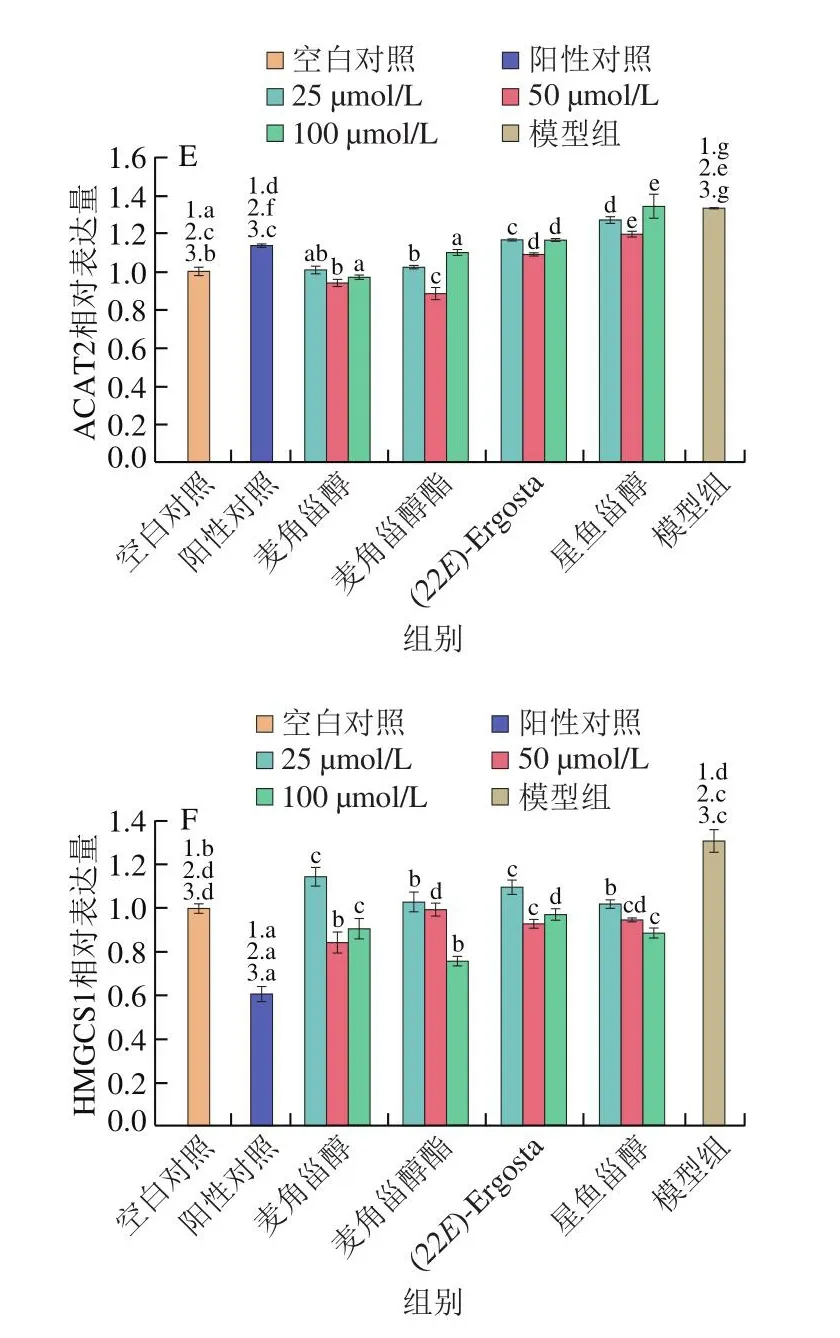
图4 甾醇类化合物对HepG2细胞胆固醇代谢相关蛋白表达的影响(n=3)Fig.4 Effects of sterols on the expression of cholesterol metabolismrelated proteins in HepG2 cells (n = 3)
以上结果提示4 种甾醇类化合物可能通过降低NPC1L1、HMGCS1、SREBP2和ACAT2的表达,从而减少胆固醇的吸收、合成和酯化,进而降低细胞内TC水平。同时,甾醇类化合物上调了胆固醇转运蛋白ABCG5/8的表达,说明甾醇类化合物促进了胆固醇的转运。
3 讨 论
甾醇的主要食物来源为植物油、面包、谷物和蔬菜等,随着物质的丰富,不健康的饮食习惯使人们容易摄入过多的胆固醇,从而导致心血管疾病。现有研究证实甾醇具有显著的降低胆固醇作用,补充甾醇类化合物可以改善血脂代谢情况,但是多数研究仅通过测定血清脂质、血清TC水平等指标[7,10,13-15]说明甾醇降胆固醇的作用,对于其降胆固醇的内在机制并未深入探索。本研究通过建立高胆固醇HepG2细胞模型,以辛伐他汀作为阳性对照,考察4 种甾醇类化合物(麦角甾醇、麦角甾醇酯、(22E)-Ergosta、星鱼甾醇)对HepG2细胞TC、TG水平的影响,并通过其对胆固醇代谢相关蛋白表达的影响探究甾醇类化合物可能的降胆固醇机制。
TC、TG水平是反映机体脂质代谢水平的主要生化指标。研究发现甾醇类化合物可以有效降低TC、TG、LDL-C含量[16-18],在本实验中,4 种甾醇类化合物降低了高固醇导致的细胞内TC及TG水平的升高,油红O染色结果显示甾醇类化合物改善了高胆固醇细胞的脂质蓄积。为进一步研究4 种甾醇类化合物对HepG2细胞内胆固醇水平调节作用的机制,使用Western blot测定胆固醇合成代谢相关蛋白的表达。人体内血浆胆固醇的稳态主要受到肝脏内源性合成、肠道对膳食胆固醇的吸收以及胆汁的清除和排泄控制。NPC1L1是膳食和胆汁胆固醇肠道吸收的关键蛋白[19]。NPC1L1在HepG2细胞中高表达,并定位于富含小GTPase Rab5蛋白的亚细胞泡状室。Davies等[20]建立NPC1L1敲除的小鼠模型,与野生型小鼠的肝细胞相比,敲除NPC1L1的小鼠肝细胞表现出异常的质膜吸收和脂质(包括胆固醇和鞘脂)转运。NPC1L1缺失可以完全抵消饮食诱导的小鼠高胆固醇血症,其血浆脂蛋白和肝胆固醇谱与使用胆固醇吸收抑制剂依麦哲布治疗的野生型小鼠相似[21]。本实验发现4 种甾醇类化合物相较模型组显著下调了NPC1L1蛋白的表达(P<0.05),表明甾醇类化合物可能通过减少胆固醇的吸收降低细胞内胆固醇含量。ACAT2在胆固醇酯化、肠道胆固醇吸收和载脂蛋白释放中具有重要作用,研究表明植物甾醇可以下调ACAT2表达,从而有效抑制胆固醇吸收,降低脂肪水平[22-23]。在本研究中,模型组ACAT2表达量较空白对照组显著升高(P<0.05),胆固醇可以激活ACAT2的表达,促进胆固醇酯化,4 种甾醇类化合物可以下调ACAT2表达,从而减少胆固醇的酯化,影响胆固醇的吸收。
ABCG5和ABCG8位于肠上皮细胞和肝细胞的顶膜上,ABCG5和ABCG8形成专性异源二聚体,限制肠道吸收胆固醇,促进胆固醇排泄到胆汁[24-25]。小鼠中过表达ABCG5和ABCG8可减少肝脏胆固醇循环从而延缓饮食诱导的动脉粥样硬化[24]。本实验结果表明4 种甾醇类化合物可以有效上调ABCG5/8蛋白的表达,且对ABCG8的上调较ABCG5显著,说明4 种甾醇类化合物可能通过促进肝细胞内胆固醇向胆汁分泌,从而降低细胞内胆固醇水平。
HMGCS包括HMGCS1和HMGCS2,是促进胆固醇合成的重要酶[26],Yao Weilong等[27]研究表明抑制HMGCS1蛋白表达后细胞内胆固醇水平显著下降。SREBPs能够调控脊椎动物细胞中的脂质稳态,其激活后调节下游基因的表达[28],SREBP途径的发现使控制胆固醇合成和摄取分子机制的研究取得重大进展[29-31]。本实验中4 种甾醇类化合物显著降低了HMGCS1及SREBP2蛋白的表达,说明4 种甾醇类化合物可能通过减少胆固醇的合成,从而降低胆固醇的水平。
4 结 论
通过添加胆固醇和25-羟基胆固醇构建高胆固醇HepG2细胞模型,在培养体系中添加不同浓度的4 种甾醇类化合物,对细胞进行油红O染色,测定细胞中的TC、TG水平,发现4 种甾醇类化合物可以抑制胆固醇和25-羟基胆固醇引起的HepG2细胞内TC、TG水平升高,改善细胞内脂质积累情况。为进一步探究甾醇类化合物在高胆固醇HepG2细胞模型中的作用机制,对涉及胆固醇合成、转运和代谢的相关蛋白表达水平进行测定发现,4 种甾醇类化合物可以降低NPC1L1、HMGCS1、SREBP2和ACAT2的表达,上调胆固醇转运蛋白ABCG5和ABCG8表达。
