坦索罗辛缓释制剂释放度检测分析
2023-04-02王卓琰高莹莹商丽丽
王卓琰 高莹莹 商丽丽
摘 要:盐酸坦索罗辛属是治疗良性前列腺增生症(BPH)的药物,为选择性α1肾上腺素受体阻断剂,用于治疗前列腺增生症引起的排尿障碍。口服本品常释制剂会出现血药浓度迅速升高,易引起血压下降,因此本品适宜制成缓释制剂。盐酸坦索罗辛吸收迅速(BCS I类),故稳定释放是保证本品安全性和有效性的重要条件。本文根据吉林省检验研究院关于《盐酸坦洛新(坦索罗辛)缓释制剂质量分析》,进一步进行关于坦索罗辛缓释制剂释放度检查分析。
关键词:坦索罗辛,释放度,处方工艺,标准,分析
DOI编码:10.3969/j.issn.1002-5944.2023.18.032
坦索罗辛是日本山之内制药公司研发的药物,在使用过程中主要采用其盐酸盐的形式,商品名为“哈乐”。盐酸坦索罗辛在水中的溶解度较差,主流制剂均为日服一次的缓释胶囊。在缓释制剂制备过程中通常采用有机溶剂包衣,包衣过程中环境污染大,并且容易爆炸,安全性低。此外,为进一步提升药物的缓释性能,蜡质骨架应运而生。但是由于蜡质骨架容易溶蚀,导致骨架的释药面积逐渐增大,药物扩散-溶出效应增强,难以维持零级释放,造成施药不均匀,前期释放较快,后期释放不完全。由此可见,改进缓释制剂的处方工艺,提升坦索罗辛缓释制剂的溶出均一性和有效性具有至关重要的作用。本文通过对坦索罗辛缓释制剂释放度进行检测分析,为提升坦索罗辛缓释制剂的溶出均一性和有效性提供一定参考。
1 品种概况
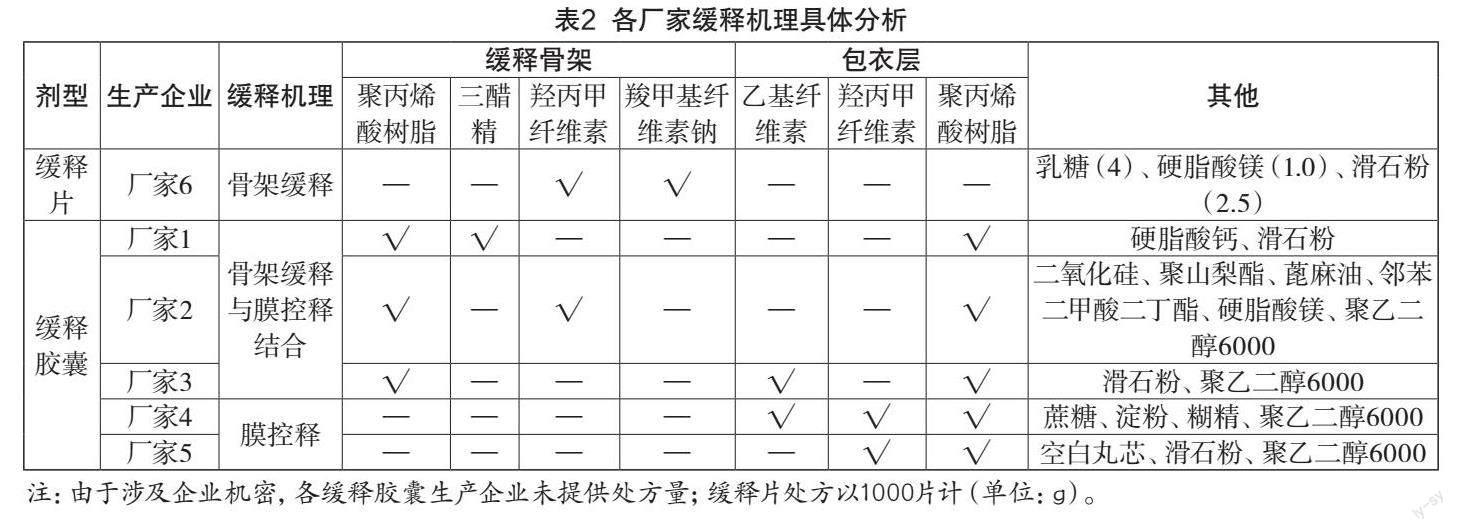
1.1 品种信息
盐酸坦索罗辛(TamsulosinHydrochloride),曾用名盐酸坦洛辛,属良性前列腺增生症(BPH)治疗用药,为选择性α1肾上腺素受体阻断剂,用于治疗前列腺增生症引起的排尿障碍。其主要作用机理是Chemicalbook选择性地阻断前列腺中的α1A肾上腺素受体,松弛前列腺平滑肌,从而改善良性前列腺增生症所致的排尿困难等症状[1]。坦索罗辛属于第三代α1受体阻断剂,比第二代具有更好地对前列腺α1受体的选择性,很少引发服用者低血压。盐酸坦索罗辛由日本山之内(安斯泰来)制药研发,1993年緩释胶囊在日本上市,1995年取得我国进口分装生产批件,2004年浙江海力生首仿,2005年国内批准缓释片上市。
1.2 基本特效
盐酸坦索罗辛属生物药剂学分类Ⅰ类即高溶解度高渗透性药物,化学方程式见图1。适应症:治疗良性前列腺增生与前列腺肥大引起的排尿障碍;不良反应:与血压下降相伴随的一过性意识丧失。口服本品常释制剂会引发血药浓度迅速升高,易引起血压下降,因此本品适宜制成缓释制剂。
2 标准检验分析
2.1 质量标准
(1)盐酸坦洛新缓释胶囊 : WS1-(X-282)-2002、YBH01682008、YBH03272005、YBH04822005。盐酸坦索罗辛缓释胶囊 : WS1-(X-333)-2003Z。盐酸坦洛新缓释片: YBH19552005(试行)、WS1-(X-009)-2015Z。
(2)现行标准分析
盐酸坦索罗辛缓释制剂收载于JP16、BP2015、USP38。
1)厂家1- WS1-(X-333)-2003Z
释放度:HPLC,浆法,500 mL,100转/分,进样100 μL,双介质。
2)厂家2 - WS1-(X-282)-2002
释放度:HPLC,小杯法,250 mL,100转/分,进样20 μL。
2 h(氯化钠盐酸溶液):1 2%~4 0%;3 h(pH7.2 P.B.S):40%~70%;5 h(pH7.2 P.B.S):≥75%。
3)厂家3 - YBH01682008
释放度:HPLC,小杯法,100 mL,100转/分,进样20μL。
2 h(氯化钠盐酸溶液,pH1.2,加吐温-80):12%~39%;3 h(pH7.2 P.B.S):44%~70%;5 h(pH7.2 P.B.S):≥70%。
4)厂家4-YBH03272005
释放度:HPLC,小杯法,250 mL,100转/分,进样500 μL。
2 h(氯化钠盐酸溶液):5%~30%;3 h(pH7.2P.B.S):35%~70%;5 h(pH7.2 P.B.S):≥70。
5)厂家5 -YBH04822005
释放度:HPLC,浆法,500 mL,100转/分,进样500 μL。
2 h(氯化钠盐酸溶液,pH1.2,加吐温-80):10%~40%;3 h(pH7.2 P.B.S):40%~70%;5 h(pH7.2 P.B.S):≥70%。
6)厂家6(缓释片)
①YBH19552005
释放度:HPLC,小杯法,100 mL,100转/分,进样20 μL。
介质:0 . 1 m o L / L盐酸溶液;限度:2 h:15%~40%;4 h:30%~60%;12 h:≥70%。
②WS1-(X-009)-2015Z
释放度:HPLC,浆法,500 mL,50转/分,进样100 μL。
介质:pH6.8 P.B.S;限度:2 h:15%~40%;4h:30%~60%;12 h:≥70%。
2.2 检验结果
按现行标准检验98批次样品,合格率94.9%,5批缓释片释放度不合格。执行试行标准的5批样品酸中释放量超限,不符合规定。执行转正标准的9批样品均符合规定。不合格原因分析见表2。
试行标准:小杯法,0.1 moL / L盐酸。考察时间:2 h、4 h、12 h。
转正标准:桨法,0.1 moL/L盐酸,pH6.8磷酸盐缓冲液。
原研标准:桨法,p H1. 2氯化钠盐酸溶液,pH7.2磷酸盐缓冲液。
3 探索性研究分析
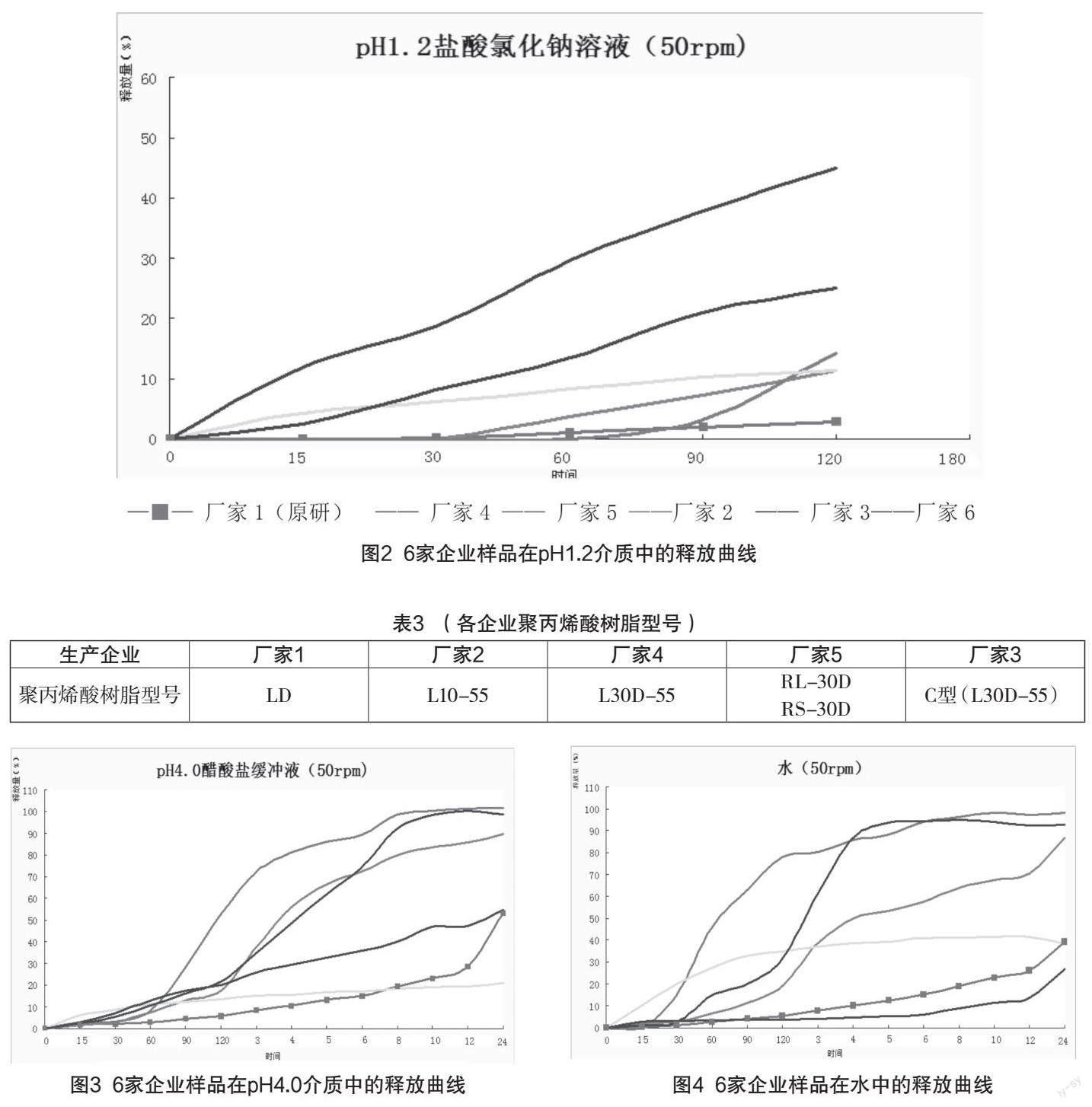
盐酸坦索罗辛吸收迅速(BCS Ⅰ 类),故稳定释放是保证本品安全性和有效性的重要条件,原研企业采用放射性标记试验证明,本品口服后经十二指肠、空肠、回肠及结肠被充分吸收,几乎不经胃吸收[2]。参考《普通口服固体制剂溶出曲线测定与比较指导原则》及《日本橙皮书》,测定6家企业样品在4种不同pH介质中的释放曲线。原研制剂在4种介质中的释放行为与《日本橙皮书》收载的4条标准曲线几乎重叠,且批间重复性好。
原研制剂在pH1. 2介质中(见图2)几乎不释放,与本品不经胃吸收呈良好的体内外相关;国产缓释胶囊释放速率均显著高于原研。虽然国产缓释胶囊处方均使用与原研制剂相同的包衣材料(见表3),但释放速率过快可能受包衣材料的来源、型号及包衣工艺等差异的影响。缓释片酸中释放速率极快,与本品采用不加膜包衣的骨架释放工艺有关[3]。
3.1 释放行为—添加表面活性剂的必要性
上述酸中释放行为考察表明:原研制剂在未添加吐温80的pH1.2介质中几乎不释放;添加后释放量显著增加。因此,原研标准添加表面活性剂的目的是为增加酸中释放量,减小分析誤差。国产制剂酸中释放量几乎不受表面活性剂添加的影响,但质量标准却仿照添加,酸中释放行为同原研制剂差异显著。揭示了国产制剂“只仿标准,未仿品种”,未掌握原研核心技术的问题。
原研制剂在pH4.0、水(pH5.5~5.8)两种介质中释放缓慢,国产制剂释放行为与原研差异较大,均不相似( 2<50),释放速率普遍偏快(见图3、4)。
如图5所示,原研制剂在pH6.8介质中释放速率加快(几乎呈零级释放),厂家2、厂家3及厂家6释放行为与原研相似( 2>50)。
3.2 释放行为—剂量倾泻试验
针对pH6.8介质中与原研相似的3家国产制剂开展剂量倾泻试验,采用桨板法/200rpm进行释放行为考察。
如图6所示,释放机理相同的厂家2、厂家3仍与原研相似;缓释片释放量显著增加,与原研不相似( 2<50)。
4 结 论
与原研释放机理一致的厂家2、厂家3仅在pH6 . 8条件下与原研相似,其他条件下均差异较大;释放机理不同的国产制剂差异更为显著。国产制剂在消化道前端(pH1.2、pH4.0 、水)释放速率普遍过快,可能会影响主成分在十二指肠和小肠处的吸收,从而导致有效血药浓度与原研制剂不同。对于释放度,缓释胶囊多数采用小杯法,通用性差;缓释片规避酸性介质检查,缺乏合理性;释放量限度范围过于宽泛,建议修订标准。对于处方工艺,包衣用高分子材料来源、型号不同,可能影响体内释放,缓释片不加膜包衣的骨架释放工艺导致酸中释放量高,建议深入处方工艺研究,提高制剂水平。
参考文献
杨颖,伍良涌,谭文非.盐酸坦索罗辛缓释片含量和释放度测定方法研究[J].今日药学,2013,23(1):26-29.
柴佩华,张涛,高申.盐酸坦索罗辛缓释制剂的研究进展[J].药学实践杂志,2016,34(6):493-496.
戴红连,江坤,王思明,等.盐酸坦洛新缓释胶囊制备工艺及其体外释放度的考察研究[ J ] .中国药学杂志,2016,51(18):1586-1591.
作者简介
王卓琰,本科,主管药师,研究方向为药品检验。
高莹莹,本科,副主任药师,研究方向为质量管理。
商丽丽,本科,副主任药师,研究方向为药品微生物检验。
(责任编辑:刘宪银)
