Ⅲ型代谢型谷氨酸受体在痛觉调控中的作用
2023-04-01王静高进贤高琲葛斌吴树金宁夏医科大学药学院银川750004甘肃省人民医院药剂科兰州730000兰州大学药学院兰州730000
王静,高进贤,高琲,葛斌,吴树金,3*(1. 宁夏医科大学药学院,银川 750004;. 甘肃省人民医院药剂科,兰州 730000;3. 兰州大学药学院,兰州 730000)
谷氨酸(glutamate,Glu)是哺乳动物中枢神经系统中主要的兴奋性神经递质,存在于整个大脑、脊髓和外周,并在伤害性刺激和组织、神经损伤时释放增多,参与痛觉的传递及慢性疼痛相关的中枢敏化。谷氨酸通过激活两类受体来介导其作用,分别是离子型谷氨酸受体(ionic glutamate receptor,iGluR)和代谢型谷氨酸受体(metabotropic glutamate receptor,mGluR)[1]。
关于iGluR类的药物因为不良反应多,研究受到限制。如氯胺酮具有强大的镇痛特性,然而,由于其潜在的拟精神作用,对氯胺酮这类iGluR药物的使用仅限于可以进行临床监测的环境[2]。近年来对mGluR在疼痛中作用的研究日益深入。mGluR是C家族G蛋白偶联受体,参与调节整个中枢神经系统的突触传递和神经元兴奋性,在整个神经系统的突触前膜和突触后膜表达。根据氨基酸序列同源性、胞内G蛋白偶联信号转导机制及配体选择等药理学特性(见图1),将mGluR分为Ⅰ型、Ⅱ型和Ⅲ型共计8种(见表1),其中Ⅲ型包括mGluR4、mGluR6、mGluR7和mGluR8。除mGluR6仅在视网膜内存在外(与疼痛无明显相关性),其他Ⅲ型mGluR都在外周和中枢神经系统中广泛表达,在不同的解剖区域具有一定的亚型特异性[3]。本文就近年Ⅲ型mGluR在不同脑区的分布、突触的定位及可能的突触前受体调节模式在痛觉调控中的作用进行综述,以期为Ⅲ型mGluR痛觉调控的相关研究提供参考。

图1 mGluR介导的化学和分子信号通路示意图Fig 1 Signaling downstream pathways of mGluR
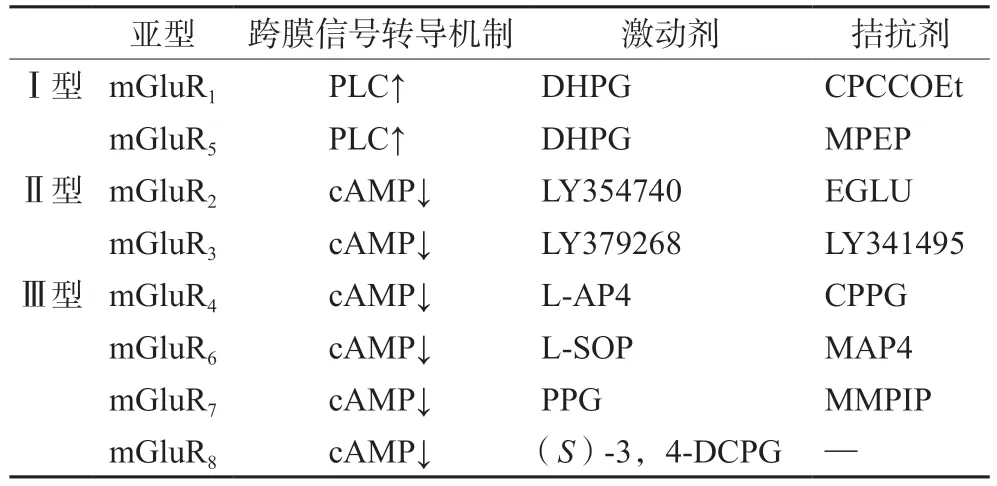
表1 代谢型谷氨酸受体分型Tab 1 Classification of mGluR
1 Ⅲ型mGluR的结构和生理功能
1.1 mGluR的结构
mGluR由1个大的细胞外亲水性N端(N-terminal)结构域、7个跨膜结构域(hepatahelical domain,HD)和1个大的细胞内C端(C-terminus)组成。N端包含1个配体结合区域,并包含1个高度保守的富半胱氨酸区域(cysteine-rich domain,CRD)。N端配体结合域类似于金星捕蝇器的嘴,称为金星捕蝇器结构域(venus flytrap domain,VFD),它包含谷氨酸结合位点。VFD通过CRD与HD相连。这7个跨膜结构域由胞内和胞外环连接,随后是1个可变长度的细胞内C端(见图2)[4-5]。
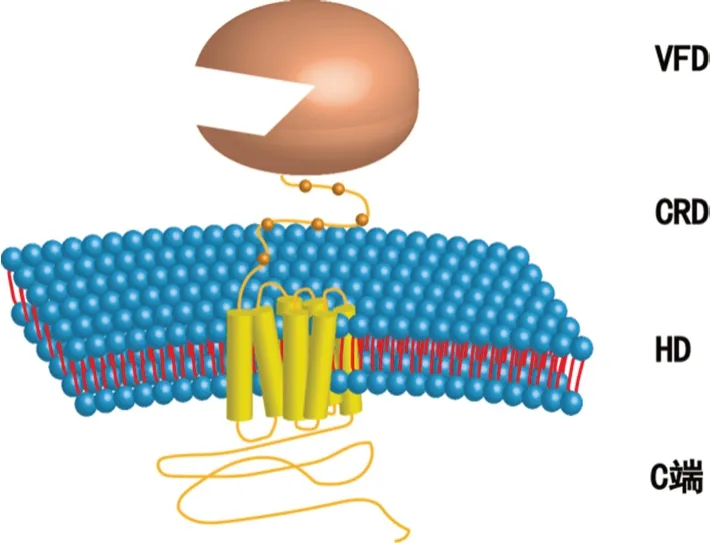
图2 mGluR的结构Fig 2 Structure of mGluR
1.2 Ⅲ型mGluR的生理功能
一般情况下,Ⅲ型mGluR定位于突触前。在突触前位置,mGluR4和mGluR8通常位于突触外位置,而mGluR7则高度定位于活性区。Ⅲ型mGluR活化后,通过抑制突触前钙离子内流来抑制谷氨酸或γ-氨基丁酸(gamma-aminobutyric acid,GABA)的释放。在突触后末端,谷氨酸与谷氨酸门控离子通道N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)、α-氨基-3-羟基-5-甲基-4-异噁唑丙酸(α-amino-3-hydroxyl-5-methyl-isoxazole-4-prorionate,AMPA)和红藻酸盐(kainate,KA)结合后,使细胞内钠离子或钙离子增加,促进细胞兴奋性(见图3)[5]。

图3 Ⅲ型mGluR细胞定位和细胞功能Fig 3 Cell localization and function of group Ⅲ mGluR
2 Ⅲ型mGluR在中枢及外周神经系统中的表达
Ⅲ型mGluR在整个痛觉上行及下行调控神经轴中都有表达。在中枢神经系统中表达情况如下:在丘脑、杏仁核、前额叶皮层中有mGluR4、mGluR7和mGluR8表达;在导水管周围灰质中有mGluR7和mGluR8表达;在脊髓中有mGluR4和mGluR7表达。除此之外,在外周痛觉感受器中,mGluR4、mGluR7和mGluR8都有表达[6]。近期研究表明,mGluR8在脊髓中也有表达(见图4)[7]。
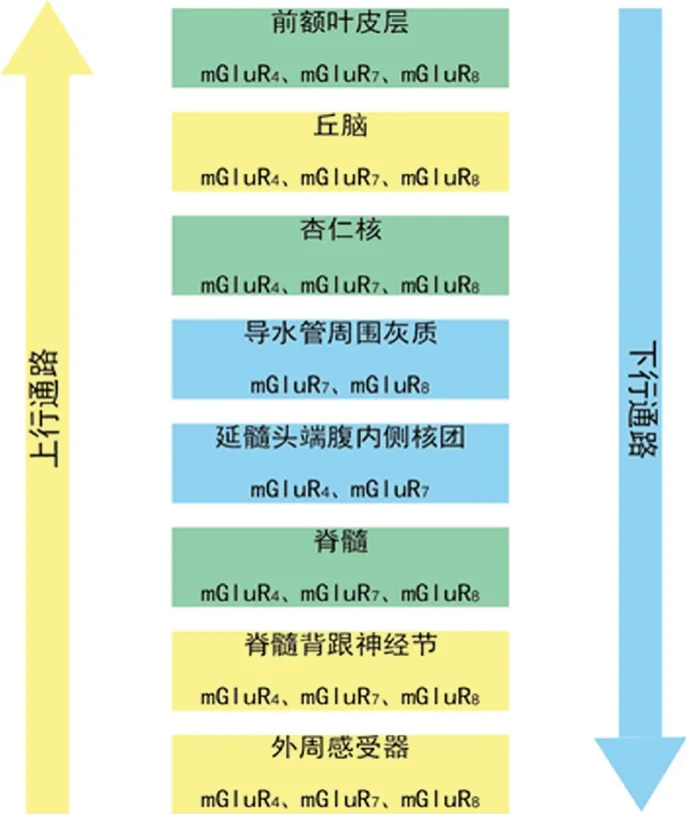
图4 Ⅲ型mGluR在疼痛通路中的表达示意图Fig 4 Schematic representation of the expression of group Ⅲ mGluR within the pain pathways
3 中枢神经系统Ⅲ型mGluR在痛觉调控中的作用
3.1 杏仁核中Ⅲ型mGluR调节疼痛的作用
中央杏仁核(central amygdala,CeA)是情绪认知活动的整合中心,CeA突触前Ⅲ型mGluR可能是缓解深层组织炎症病变引起疼痛的潜在治疗靶点。
有研究将mGluR7激动剂AMN082注射到正常大鼠CeA中,结果大鼠的后肢屈肌反射阈值显著降低了,增加了对无害和有害刺激的超声波发声时间,并增加了焦虑样行为,提示mGluR7激动剂在正常大鼠中具有促伤害性作用和焦虑样作用;但在关节炎大鼠中则无以上改变,这表明关节炎相关的变化可能阻断了mGluR7介导的作用[8]。给予mGluR8选择性激动剂DCPG则显示,在关节炎大鼠中,显著提高了大鼠的脊髓后肢屈肌反射阈值,部分逆转了机械超敏反应,显著降低了对无害和有害刺激的超声波发声时间,逆转了关节炎的影响,同时显示出一定的抗焦虑作用,但对正常大鼠则无上述影响,提示mGluR8选择性激动剂在疼痛模型中具有抗伤害性和抗焦虑样作用。综上表明,CeA中的mGluR7和mGluR8在痛觉调控中发挥着相反的作用[8]。
上述情况产生的机制可能是AMN082增加了正常大鼠脑切片中的单突触兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)和动作电位,但对疼痛模型无此作用;此外,还与AMN082降低了正常大鼠单突触和多突触抑制性突触后电流(inhibitory postsynaptic currents,IPSCs)有关。因此,在正常大鼠中,激动突触前 mGluR7,抑制了CeA中抑制性突触传递,促进兴奋性传递,增加了谷氨酸能在CeA脑区的投射,从而产生促伤害性作用,但在疼痛时对突触传递没有影响。与之相反,DCPG在关节炎大鼠脑切片中比在正常大鼠脑切片中更有效的抑制EPSCs的峰值,而对抑制性突触的传递无影响。因此,激动疼痛模型突触前 mGluR8产生的抗伤害性作用是通过抑制CeA中疼痛相关的兴奋性突触传递发挥的[9]。
3.2 导水管周围灰质中 Ⅲ型mGluR调节疼痛的作用
导水管周围灰质(periaqueductal grey,PAG)是痛觉下行调控的重要处理中心,谷氨酸和GABA在PAG水平上的痛觉处理中发挥着至关重要的作用[10]。
有研究表明,在福尔马林炎症性疼痛大鼠模型中,全身给药或腹外侧导水管周围灰质(ventrolateral periaqueductal grey,VL PAG)内局部注射mGluR8选择性激动剂(S)-3,4-DCPG,能显著减少福尔马林诱导的双相伤害性行为;mGluR7拮抗剂MMPIP进行VL PAG内局部注射,也能产生与(S)-3,4-DCPG相同的镇痛效应,但全身给药无效。在角叉菜胶炎症性疼痛大鼠模型中,全身给药或VL PAG内局部给药(S)-3,4-DCPG均显著增加了热刺激诱发的缩足潜伏期和机械刺激诱发的缩足阈值(paw-withdrawal mechanical threshold,PWMT)。将Ⅲ型mGluR拮抗剂MSOP注射入VL PAG时,则可以抑制上述镇痛效应[10-11]。在坐骨神经结扎(spare nerve injury,SNI)神经病理性疼痛大鼠模型中,注射MMPIP 到VL PAG中相比假手术组显著增加了SNI组的甩尾潜伏期。而当全身给药时,未显示出镇痛作用[10]。在另一项研究中,SNI损伤3 d后腹腔内注射(S)-3,4-DCPG显著增加了热刺激诱发的缩足潜伏期和机械刺激诱发的缩足阈值,7 d后注射(S)-3,4-DCPG则没有改变[11]。以上结果表明,激动mGluR8受体可缓解炎性及早期神经病理性疼痛大鼠的痛觉过敏,而对于持续性神经病理性疼痛,其效果较差。在正常小鼠中,VL PAG内注射(S)-3,4-DCPG增加了其甩尾潜伏期,注射AMN082则降低了其甩尾潜伏期[12]。以上研究结果提示在PAG中激动mGluR7和mGluR8起着相反的作用。
近期有研究显示,在糖尿病神经病变小鼠模型中,潜在的mGluR8激动剂Homo-AMPA注射入VL PAG增加了小鼠的甩尾潜伏期和缩足阈值;降低了延髓头端腹内侧核团(rostroventromedial medulla,RVM)ON细胞的持续活性、爆发的频率和爆发的持续时间。在对照组中,Homo-AMPA增加了其甩尾潜伏期,降低了ON细胞的持续活性、爆发的频率和爆发的持续时间;还增加了RVM OFF细胞持续活性,减少并延迟了OFF细胞的暂停[13]。以上研究表明,PAG的镇痛作用主要是通过调节RVM内的神经元产生的,其对脊髓背角的投射抑制了伤害性神经元的活动和疼痛反应[13]。
3.3 脊髓中Ⅲ型mGluR调节疼痛的作用
3.3.1 Ⅲ型mGluR选择性激动剂L-AP4 在脊髓神经损伤大鼠模型中,鞘内注射Ⅲ型mGluR选择性激动剂L-AP4可以显著提高机械刺激诱导的缩足阈值,降低了大鼠的机械痛觉敏化;而鞘内注射Ⅲ型mGluR的选择性拮抗剂MAP4则可以抵消这个作用,双向证实了在脊髓水平激动Ⅲ型mGluR受体后对病理性神经痛发挥着镇痛的作用。然而鞘内注射L-AP4并不能改变正常大鼠的痛阈值,但是鞘内注射MAP4却可以诱发正常大鼠出现痛觉过敏和痛觉超敏,降低伤害性刺激痛觉阈值,相关机制尚不十分清楚,或许与正常情况下谷氨酸释放的基础水平相关,从而限制了Ⅲ型mGluR的作用[14]。其他研究也证实,鞘内给予Ⅲ型mGluR激动剂ACPT-Ⅰ或mGluR4激动剂PHCCC对正常大鼠机械或热刺激后的伤害性感受阈值没有影响,但显著降低了炎症性疼痛和神经性疼痛大鼠的机械痛觉过敏,使用MAP4消除了ACPT-Ⅰ对以上两个模型的抗痛觉过敏作用。此外,ACPT-Ⅰ和mGluR4选择性激动剂PHCCC仅逆转了炎症和神经性疼痛动物模型的痛觉过敏,并未起到完全镇痛的作用。ACPT-Ⅰ的抗痛觉过敏作用可能是通过激活mGluR4来发挥的[15]。
在坐骨神经慢性压迫性神经损伤(chronic constriction injury,CCI)大鼠模型中,L-AP4鞘内注射既降低了假手术组的痛觉伤害性反应,也降低了CCI组大鼠福尔马林诱导的痛觉伤害性反应。在完全弗氏制剂(complete Freund’s adjuvant,CFA)炎症大鼠模型中,L-AP4鞘内注射不影响辣椒素诱导的伤害性反应,但降低了正常大鼠对辣椒素诱导的伤害性反应。这些结果与L-AP4降低了福尔马林诱导的CCI大鼠脊髓谷氨酸释放的增加,但不影响辣椒素诱导的CFA大鼠谷氨酸释放的增加相类似。因此L-AP4可缓解神经病理性或福尔马林诱导的炎症性大鼠的痛觉过敏,但不影响CFA炎症性大鼠的伤害性反应[16]。使用L-AP4对福尔马林炎症性疼痛绵羊模型机械痛觉过敏没有影响,这与在大鼠中使用L-AP4的结果不同,其原因尚不清楚,可能与剂量或物种相关[17]。
在一项对脊髓损伤的大鼠电生理研究中,由初级传入神经诱发的谷氨酸能EPSCs的基线振幅显著大于对照组,但神经损伤大鼠的 GABA 能和甘氨酸能IPSCs基线频率远低于对照组大鼠。注射L-AP4后对神经损伤大鼠EPSCs 振幅的抑制作用大于对照组,然而,L-AP4对GABA能和甘氨酸能 IPSCs 的抑制作用并无显著差异。该研究表明,神经损伤增加了来自初级传入神经的谷氨酸能输入,但减少了脊髓背角神经元的GABA能和甘氨酸能输入。Ⅲ型mGluR激动剂对神经病理性疼痛发挥抗伤害性作用的原因可能是激活Ⅲ型mGluR会减弱神经损伤大鼠初级传入的谷氨酸能输入[18]。
L-AP4可以激活mGluR4和mGluR7,抑制伤害性刺激诱发的浅背角神经元的动作电位,从而抑制炎性和神经病理性疼痛,但是L-AP4不改变正常动物的痛阈值[14]。Wang等[19]研究了mGluR4选择性激动剂VU0155041和mGluR7激动剂AMN082,发现鞘内注射 VU0155041减弱了神经病理性疼痛模型大鼠的机械痛觉过敏和热痛觉过敏,而鞘内注射AMN082并没有该作用。此外,与L-AP4的作用相似,VU0155041和AMN082均未能在正常大鼠中诱导任何抗伤害性感觉。这些观察结果表明,体内脊髓mGluR4(而非mGluR7)可能与神经性痛觉过敏相关。mGluR4的mRNA表达在脊髓背角呈现弥散性分布,包括灰质和白质,主要在非伤害神经元和背角中间神经元,但在Ⅰ、Ⅱ板层表达很少。因此它可能参与非伤害性信息在脊髓传递过程中递质释放的调控。
3.3.2 mGluR7激动剂AMN082 虽然AMN082并没有抑制神经病理性疼痛模型大鼠的痛觉过敏,但在另一项研究中,鞘内注射AMN082可以抑制福尔马林炎症性疼痛绵羊模型患肢机械痛觉过敏,对健侧肢没有影响。这是因为使用AMN082增强了脊髓内源性mGluR7受体活性,抑制炎症性绵羊的急性伤害性感受处理和痛觉过敏[17]。还有研究表明,鞘内注射AMN082对角叉菜胶和爪切口诱发的炎症大鼠的热痛觉过敏有显著的抑制作用,且在诱发炎症前后均能抑制热痛觉过敏,但对机械痛觉超敏没有影响[20]。
上述对神经病理性疼痛研究结果表明,脊髓mGluR可能在调节脊神经结扎所致神经病理性疼痛中发挥重要作用。然而,另一项研究结果显示,Ⅰ型mGluR拮抗剂、Ⅱ型或Ⅲ型mGluR激动剂在脊髓神经结扎大鼠中均未表现出任何抗神经性疼痛的活性,表明脊髓mGluR并没有直接参与脊髓神经结扎后神经性疼痛的发展。脊髓损伤后,周围神经表现出自发的和持续的传入放电,导致脊髓的敏化,从而驱动神经性疼痛的发展。在此研究中虽然单独使用Ⅲ型mGluR激动剂ACPT-Ⅲ没有抗神经病理性疼痛的活性,但是增加了吗啡的镇痛作用,使吗啡的用量大幅下降,其具体机制尚不明确[21]。
3.3.3 Ⅲ型mGluR拮抗剂CPPG 近期有研究显示[7],在福尔马林炎症性大鼠模型中,Ⅲ型mGluR拮抗剂CPPG减弱了大鼠炎症性阶段的伤害感受行为和脊髓背角Ⅰ-Ⅱ板层兴奋性神经元中fos细胞的表达[7]。而L-AP4对福尔马林炎症性大鼠模型则无作用,这与之前的Ⅲ型mGluRs激动剂具有镇痛作用的研究结果不一致[14-20]。该研究发现,mGluR4和mGluR8mRNA优先表达于pax2阳性抑制性神经元,而非lmx1b阳性兴奋性神经元。鉴于这些结果和正常条件下这些受体的细胞内信号(Gi/o),mGluR4和mGluR8的作用可能为抑制抑制性神经元,导致兴奋性神经元的反应性增加。这些结果表明,Ⅲ型mGluR的拮抗剂有可能是抑制了mGluR4和mGluR8,触发了抑制性神经元的去抑制,抑制了脊髓背角Ⅰ-Ⅱ板层兴奋性神经元的兴奋性,从而产生了抗伤害性行为的作用[7]。
综上,多数研究表明,Ⅲ型mGluR激动剂具有一定的镇痛作用。但仍有相反的研究结果,即Ⅲ型mGluR激动剂单独使用无镇痛作用,还有研究表明是Ⅲ型mGluR拮抗剂而非激动剂有镇痛作用,因此需要进一步的研究。
3.4 背侧纹状体中Ⅲ型mGluR调节疼痛的作用
背侧纹状体(dorsal striatum,DS)作为基底神经节的一部分可能在痛觉处理过程中发挥作用。向假手术大鼠DS微量注射AMN082,促进了机械痛觉超敏和热感受反应,增加了RVM ON细胞的活性,抑制了RVM OFF细胞的活性;增加了DS网状核中总伤害性OFF神经元的活性。相反,AMN082则抑制SNI大鼠的痛觉超敏和甩尾潜伏期,抑制了RVM ON细胞的活性,增加了RVM OFF细胞的活性;抑制了DS网状核中总伤害性OFF神经元的活性。但AMN082既降低了假手术组大鼠的谷氨酸水平也降低了SNI组谷氨酸水平。此外,在DS外1 mm处微注射AMN082未能改变假手术和SNI大鼠的机械刺激诱发的缩足阈值。AMN082对机械痛觉超敏和谷氨酸释放的作用均可以被mGluR7选择性拮抗剂ADX71743阻断。通过向丘脑下核显微注射利多卡因来阻断间接通路(苍白球外段-丘脑下核-苍白球内段-黑质网状部)后,利多卡因消除了AMN082对假手术大鼠总伤害性OFF神经元的影响,而对SNI大鼠则没有影响[22]。因此,激活mGluR7在生理条件下促进疼痛的作用可能是由基底神经节的间接途径介导的,在病理条件下抑制疼痛的作用可能是由基底神经节的直接途径介导的[22]。
DS内微注射选择性mGluR8激动剂(S)-3,4-DCPG,没有改变假手术大鼠的甩尾潜伏期和机械刺激诱发的缩足阈值,也对其ON和OFF细胞的活性没有影响;但(S)-3,4-DCPG增加了SNI大鼠的甩尾潜伏期和机械刺激诱发的缩足阈值,抑制了ON细胞活性,同时增加了OFF细胞的活性。而DS内注射选择性mGluR4激动剂VU0155041,则对正常生理状态和SNI大鼠的热痛敏和ON、OFF细胞活性方面均无效[23]。这些结果表明,在神经病理性疼痛模型中刺激mGluR8可抑制热感受反应和机械性痛敏,该作用与抑制RVM内的ON细胞和刺激OFF细胞有关,但在正常大鼠中激动mGluR8没有改变疼痛反应的作用[23]。
4 外周系统中Ⅲ型mGluR调节疼痛的作用
外周神经元是感觉传感器和传递器,在各种生理和病理条件下通过释放谷氨酸与外周环境相互作用。强烈的有害刺激或炎症条件导致初级传入神经终末释放谷氨酸到外周组织。动物研究的结果显示,通过调节外周谷氨酸能系统,可以起到镇痛作用[24]。
有研究显示,在蜂毒诱发的大鼠足底炎症性疼痛模型中,足底注射选择性Ⅲ型mGluR激动剂L-AP4具有镇痛作用,与对照组相比,对炎症性疼痛模型大鼠的撤足次数产生了剂量相关的抑制作用,而选择性Ⅲ型mGluR拮抗剂MSOP预处理则消除了这种抑制效应。但L-AP4对蜂毒诱导的机械性痛觉过敏没有抑制作用,不能抑制缩足阈值的降低[25]。在角叉菜胶关节炎疼痛大鼠模型中,诱发疼痛期间和疼痛维持期间,用L-AP4治疗,增加了大鼠的缩足阈值和负重值,表明 L-AP4激活Ⅲ型mGluR对角叉菜胶诱导的关节炎疼痛具有抗痛觉过敏作用[26]。在CFA关节炎疼痛模型中,大鼠膝关节注射高剂量L-AP4也能使负重值增加,还能抑制因为膝关节上的机械压力造成的外周感觉神经末梢的神经元兴奋性。但是,在非炎症状态下没有显著的抑制作用。因此,激活外周Ⅲ型mGluR可以抑制CFA炎症大鼠神经末梢的神经元放电速率,从而在负性调节伤害性行为和疼痛传递中发挥重要作用[27]。近期有研究显示,在福尔马林炎性疼痛大鼠模型中,足底注射Ⅲ型mGluR激动剂减弱了炎症性阶段的伤害感受行为和脊髓背角fos蛋白的水平,降低了脊髓中促炎因子肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)和白细胞介素-1β(interleukine-1β,IL-1β)的水平。该研究表明,外周Ⅲ型mGluR通过减少外周感觉输入和中枢敏化参与痛觉的传递[28]。
5 结论
mGluR在中枢、脊髓、外周痛觉感受器中广泛表达,使得mGluR调节疼痛的机制和作用位点尚不清楚。目前的研究表明,在CeA、PAG中选择性mGluR7拮抗剂和mGluR8激动剂均可发挥镇痛效应;而应用AMN082激活mGluR7对正常动物则产生了促伤害反应。在DS中mGluR7和mGluR8激动剂在神经病理性疼痛模型中产生了相同的镇痛效应,但是应用AMN082激活mGluR7对正常动物则产生了促伤害反应,这提示在生理病理条件下mGluR7是通过不同机制、途径参与痛觉的调控。脊髓上的mGluR4与神经病理性痛觉过敏有关,这表明mGluR4在疼痛处理中的作用也很重要。综上,关于Ⅲ型mGluR在痛觉调控中的作用尚不完全明确,目前的相关研究结果也存在一定的争议,尚需要在生理和各种不同的病理情况下,在不同的痛觉调控水平上,进行深入的研究。
