芦荟大黄素通过激活Caspase-3/GSDME焦亡通路发挥抗胶质瘤作用
2023-04-01方兴刚汪嫚陈卓张思思罗杰湖北中医药大学中医临床学院武汉40065胚胎干细胞研究湖北省重点实验室湖北医药学附属太和医院湖北十堰44000湖北医药学院药护学院湖北十堰44000
方兴刚,汪嫚,陈卓,张思思,罗杰*(. 湖北中医药大学中医临床学院,武汉 40065;. 胚胎干细胞研究湖北省重点实验室,湖北医药学附属太和医院,湖北 十堰 44000;. 湖北医药学院药护学院,湖北 十堰 44000)
神经胶质细胞瘤,简称胶质瘤,是颅内最常见的恶性肿瘤,约占全部颅内恶性肿瘤的 80%[1]。其中胶质母细胞瘤(glioblastoma,GBM)为第Ⅳ级胶质瘤,约占胶质瘤总数的54%,具有高发病率、高复发率、高病死率和低治愈率的特点[1]。GBM的浸润性生长方式决定其恶性生物学行为,手术难以完全切除。由于血脑屏障(bloodbrain barrier,BBB)以及脑-肿瘤细胞屏障(brain tumor cell barrier,BTB)的存在以及化疗抗性,化疗的疗效也不尽理想[2-5],且因GBM免疫抑制的微环境,目前蓬勃发展的PD-1等免疫检查点抑制剂效果欠佳[6-8]。因此,从治疗的角度来看,需要其他治疗途径和治疗靶点来改善预后。
焦亡是由GSDM家族(GSDMs)介导的具有免疫原性的程序性的细胞死亡,在活化的Caspase家族及颗粒酶B的作用下,GSDMs被活化,释放具有细胞膜成孔功能的N端结构域,诱导细胞内外渗透压失衡,导致细胞肿胀、死亡[9]。由于GSDME途径的焦亡会诱导乳酸脱氢酶(LDH)和HMGB1细胞外释放而和适应性免疫相联系,在抗肿瘤治疗中日益受到重视。GSDME途径的焦亡依赖于GSDME在组织中的表达水平,TCGA数据库(http://ualcan.path.uab.edu/analysis.html)显示,GBM特异性高表达GSDME,故我们认为GSDME是抗GBM治疗的良好靶点。而激活GBM高表达的GSDME,促进GSDME途径的焦亡进而激活适应性免疫,可能为GBM治疗提供新的策略。
芦荟大黄素(aloe-emodin,AE)是一种蒽醌衍生物,是从大黄、虎杖、何首乌、芦荟、决明子等传统中药中提取的有效成分,具有较好的血脑屏障通透性。近年来,AE已被证明具有广泛的药理作用,如抗病毒、抗菌、抗过敏、抗骨质疏松、抗糖尿病、免疫抑制、神经保护和肝保护活性以及抗肿瘤作用[10]。既往研究显示AE通过多种机制作用于肿瘤细胞,如诱导DNA损伤[11],阻滞细胞周期[12-14],抑制肿瘤细胞迁徙[15]。AE可以通过诱导线粒体功能障碍及激活Caspase-9/3/GSDME轴诱导Hela细胞焦亡,显示AE具有诱导肿瘤细胞焦亡的潜力[16]。本研究以AE作为候选药物,应用于GSDME特异性高表达的GBM细胞(U87MG、GL261),以明确AE对GBM细胞的抑制作用及焦亡诱导作用。目前,AE通过激活CASP3/GSDME通路促进GBM细胞焦亡发挥抗胶质瘤作用的研究尚未见任何报道。本研究可能为临床胶质瘤的治疗提供一种新的选择。
1 材料和方法
1.1 细胞株与试药
U87MG、GL261细胞均来源于本实验室(胚胎干细胞湖北省重点实验室,冻存细胞);芦荟大黄素(规格:100 mg,纯度:98%,成都埃法生物科技有限公司,结构式见图1);重组Anti-Cleaved Caspase-3抗体、重组Anti-DFNA5/GSDME抗体[EPR19859]-N-terminal、重组Anti-cleavedN-terminal GSDMD抗体(Abcam公司);ABScriptⅡReverse Transcriptase(ABclonal);蛋白酶和磷酸酶抑制剂混合液、高敏ECL化学发光试剂盒(新赛美);MTT细胞增殖及细胞毒性检测试剂盒、2×PCR Master Mix、SDSPAGE凝胶配制试剂盒、LDH释放检测试剂盒、β-Tubulin Rabbit Monoclonal Antibody、辣根过氧化物酶标记山羊抗兔IgG(H+L)、FITC标记山羊抗兔IgG(H+L)、顺铂(Cisplatin)、NAC、Caspase抑制剂Z-VAD-FMK(碧云天);PageRuler 预染蛋白Marker(赛默飞);DCFHDA 活性氧(ROS)荧光探针细胞检测试剂盒(索莱宝);Taq-HS Probe qPCR Premix、线粒体膜电位检测试剂盒(JC-1)(兰博利德)。

图1 芦荟大黄素分子结构式Fig 1 Molecular formula of aloe-emodin
1.2 仪器
生物安全柜、CO2恒温培养箱、多功能酶标仪(美国Thermo Fisher 公司);倒置显微镜(德国Leica 公司);超速低温离心机(德国Eppendorf公司);荧光定量PCR仪(美国BIO-RAD公司);流式细胞分析仪(美国Beckman公司)。
2 方法和结果
2.1 AE对GBM细胞活力的影响
选择GBM细胞系U87MG(人)、GL261(鼠)作为实验对象,以浓度梯度的AE作用于胶质瘤细胞系48 h,MTT实验检测细胞存活率:复苏U87MG、GL261细胞,传代至96孔板中,预设每个梯度浓度5孔重复,每孔4000个/100 µL,12 h后给予包含梯度浓度(6.25、12.5、25、50、75、100 µmol·L-1)AE的培养基共培养,其中0.2%DMSO作为对照组(Con),48 h后每孔加入10 µL MTT 液(5 mg·mL-1)避光孵育 4 h,离心,弃上清液,每孔加入100 µL Formazan(甲瓒)溶解液,适当混匀,在细胞培养箱内再继续孵育3 h。光学显微镜下观察发现甲瓒全部溶解。用酶标仪于 490 nm波长处测量各孔的光密度(OD)并计算细胞增殖抑制率,使用Graphpad软件统计细胞存活率。结果显示:AE以浓度依赖的方式抑制U87MG(见图 2A)及GL261(见图2B)的活性,其对U87MG细胞的半抑制浓度(IC50)为24.76 µmol·L-1,对GL261细胞的IC50为43.38µmol·L-1,提示AE对胶质瘤细胞有明确的抑制作用。

图2 AE对U87MG细胞(A)和GL261细胞(B)活性的影响( ±s,n=5)Fig 2 Effect of AE on the viability of U87MG cell(A)and GL261 cell(B)detected( ±s,n=5)
2.2 AE对GBM细胞焦亡的影响
为明确AE对GBM细胞的作用方式,对AE处理的U87MG、GL261细胞在倒置显微镜下进行形态学动态观察:U87MG、GL261细胞铺至24孔板中,每孔4000个/100 µL,细胞贴壁后给予50µmol·L-1的AE共孵育,分别于2、6、12、24、36、48、60 h时间点进行细胞拍照,记录细胞形态。60 h后AE处理的U87MG及GL261(见图 3)细胞出现细胞肿胀、吐泡等焦亡特异性细胞外观(蓝色箭头标识),提示AE可以促进胶质瘤细胞焦亡。

图3 AE处理的U87MG和GL261细胞外观(蓝色箭头指向焦亡细胞,比例尺:×200)Fig 3 Appearance of U87MG and GL261 cells treat with AE(The blue arrows pointed to pyroptosis cells,scale bar:×200)
焦亡的另一特征是细胞膜成孔,细胞内容物如LDH从细胞内释放,为此我们开展了LDH释放实验。U87MG细胞铺至96孔板中,每孔4000 个/100µL,待其密度生长至90%左右,加入梯度浓度AE共孵育24 h,收集各孔上清至新的96孔板中,采用通过乳酸脱氢酶释放检测试剂盒(LDH Release Assay Kit,碧云天)对LDH含量进行检测,采用SpectraMax 190酶标仪检测上清液在490 nm的吸光度进而计算LDH释放水平。结果显示,LDH以浓度依赖的方式实现细胞外释放(见图 4)。结果显示AE对胶质瘤细胞具有明确的抑制作用,这种抑制作用是通过介导胶质瘤细胞焦亡实现的。

图4 AE对U87MG细胞中LDH释放的影响( ±s,n=3)Fig 4 Effect of AE on the LDH release of U87MG cells( ±s,n=3)
2.3 AE对CASP3/GSDME焦亡通路活化的影响
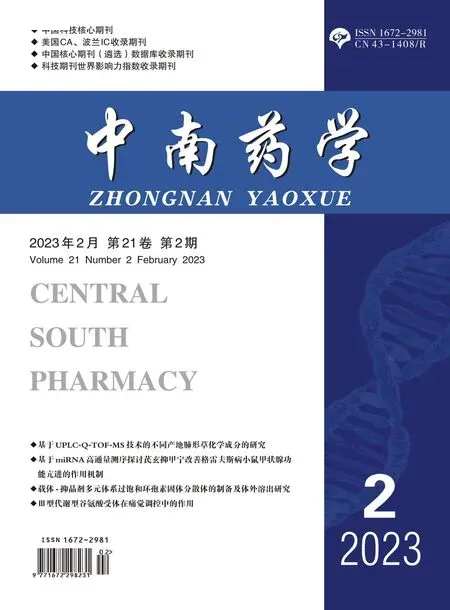
焦亡的发生主要是通过经典的CASP1/GSDMD通路及非经典的CASP3/GSDME通路,为了明确AE通过哪种通路介导GBM细胞焦亡,我们开展了Western blot实验检验了这两条通路的关键蛋白GSDME-N和GSDMD-N:U87MG细胞在6孔板中与浓度梯度AE(按实验需求合用或单用caspase抑制剂Z-VAD-FMK,CASP3途径焦亡阳性对照药物顺铂,抗氧化剂NAC)共孵育48 h,以包含1%PMSF的RIPA裂解液裂解后提取蛋白,BCA法分析蛋白浓度,通过SDS-PAGE凝胶电泳,转膜至PVDF膜上,以5%脱脂奶粉封闭2 h,裁膜后分别给予CASP3、GSDMD-N、GSDME-N、β-tubulin一抗4℃孵育过夜,TBST洗膜3次,每次10 min,加入对应二抗,室温孵育1 h,TBST洗膜3次,每次10 min,ECL显影液显影,运用Image J软件对条带进行灰度分析。结果显示:AE处理的U87MG细胞出现了CASP3、GSDME蛋白活化(C-CASP3、GSDME-N)表达水平上升,而GSDMD蛋白未受影响(未见GSDMD-N表达)(见图5A),这提示AE活化了CASP3/GSDME焦亡通路而非GSDMD通路。为进一步验证这一结果,我们给予CASP3/GSDME焦亡通路阳性对照药顺铂和caspase阻断剂(Z-VAD-FMK)进行处理,结果显示,AE处理组出现和顺铂组类似的GSDME-N的表达,而AE处理组(100 µmol·L-1AE)给予Z-VAD-FMK共处理,GSDME-N的表达明显减少(见图5B),这进一步证明AE可以引起焦亡关键蛋白GSDME的活化,且这种活化依赖于caspase的表达。
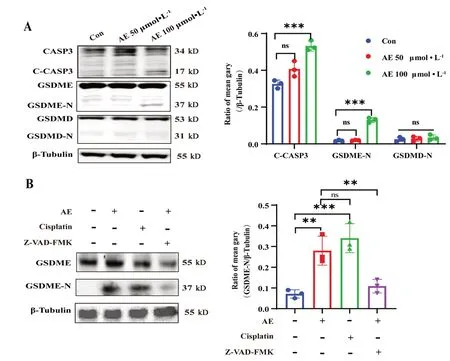
图5 AE激活U87MG细胞CASP3/GSDME焦亡通路( ±s,n=3)Fig 5 AE activate CASP3/GSDME pyroptosis pathway on U87MG cells( ±s,n=3)
蛋白免疫荧光是检测蛋白表达水平的另一种手段,为了进一步证实AE对GSDME活化的影响,我们开展了GSDME-N免疫荧光实验:细胞铺至12孔板中,梯度浓度AE共孵育48 h,去上清,PBS清洗后加入免疫荧光固定液,室温固定30 min,去固定液,PBS清洗三次,每次5 min,加入免疫荧光封闭液,室温封闭30 min,清洗三次。加入1∶200 GSDME-N一抗,4℃摇床过夜,回收一抗,清洗三次;加入FIFC标记山羊抗兔IgG(H+L)二抗,室温避光孵育2 h,回收二抗,清洗3遍;加入DAPI染色液,室温孵育10 min,去染色液,PBS清洗三次,于荧光显微镜下检测GSDME-N的表达。结果显示,AE增强了GSDME-N在U87MG细胞的荧光强度(见图6),这进一步证明AE能增强GSDME蛋白的活化。
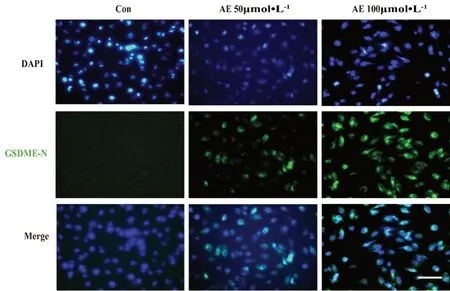
图6 AE对U87MG细胞GSDME-N蛋白表达的影响(比例尺:×200)Fig 6 Effect of AE on the expression of GSDME-N in U87MG cells(scale bar:×200)
2.4 AE对GSDME在胶质瘤细胞mRNA水平的影响
为明确AE对GSDME mRNA表达水平的影响,我们进行了qPCR实验:梯度浓度AE处理U87MG、GL261 细胞48 h,Trizol提取总RNA,测定总RNA浓度及纯度,使用ABScript Ⅱ Reverse Transcriptase(RK21400)试剂盒反转录合成cDNA,使用Taq-HS Probe qPCR Premix预混液进行qPCR实验。条件如下:95℃:2 min,94℃:20 s,58℃:20 s,72℃:20 s,40个循环,最后在72℃下延伸4 min。以β-actin作为内参计算GSDME的相对表达水平,实验相关引物列表如表1,结果采用2-ΔΔCt法进行统计分析。

表1 引物序列Tab 1 Primers used in the experiment
结果显示,无论是在U87MG细胞,还是在GL261细胞中,AE均可促进GSDME在mRNA水平的表达,在U87MG细胞中其差异有统计学意义(P<0.05)(见图7)。

图7 AE对U87MG(A)、GL261(B)细胞GSDME在mRNA水平的表达影响( ±s,n=3)Fig 7 Effect of AE on the expression of GSDME in U87MG(A)and GL261(B)cells at the mRNA level(x±s,n=3)
2.5 AE对胶质瘤细胞线粒体功能及ROS的影响
有研究显示线粒体功能障碍及ROS和CASP3/GSDME 途径的焦亡密切相关[17-18],为了明确AE介导GBM过程中是否发生线粒体功能障碍,我们对AE处理的U87细胞线粒体膜电位和ROS水平进行检测。U87细胞铺入6孔板中,细胞生长至70%~80%分别给予含0.2%DMSO,50 µmol·L-1和100 µmol·L-1AE 的培养液共孵育24 h,除去培养液,PBS洗涤细胞一次,加入1 mL含血清细胞培养液。再加入1 mL JC-1 染色工作液,充分混匀,细胞培养箱中37℃孵育20 min。在孵育期间,按照每 1 mL JC-1 染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),并放置于冰浴。37℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。再加入2 mL含血清细胞培养液,用荧光显微镜进行观察。结果显示(见图8):未经AE处理的U87MG细胞线粒体膜电位处于正常高电位(红色荧光标识),而经AE处理的线粒体膜电位降低(绿色荧光标识)。荧光显微镜活性氧检测显示(见图9A):经AE处理后U87MG细胞ROS荧光明显增强;应用DCFH-DA 活性氧ROS荧光探针对细胞ROS标记,通过荧光显微镜及流式细胞术检测ROS水平。U87细胞铺入6孔板中,细胞生长至70%分别给予含0.2%DMSO,50 µmol·L-1和100 µmol·L-1的培养基共孵育24 h,除去培养基,加入DCFH-DA浓度为5 µmol·L-1的培养基1 mL,37℃培养箱孵育30 min,除去含探针培养基,PBS清洗三次,分别进行荧光拍照及流式细胞分析。结果显示(见图9B),DCFH-DA标识的阳性细胞数量明显增多,这说明AE可提高U87细胞ROS水平。为进一步明确ROS的表达是否会影响GSDME的活化,AE处理的U87MG细胞与抗氧化剂NAC共孵育,显示NAC可以显著减轻AE(100µmol·L-1)所诱导的GSDME的活化(P<0.0001)(见图9C),这提示AE诱导ROS介导了GSDME的活化及细胞焦亡。
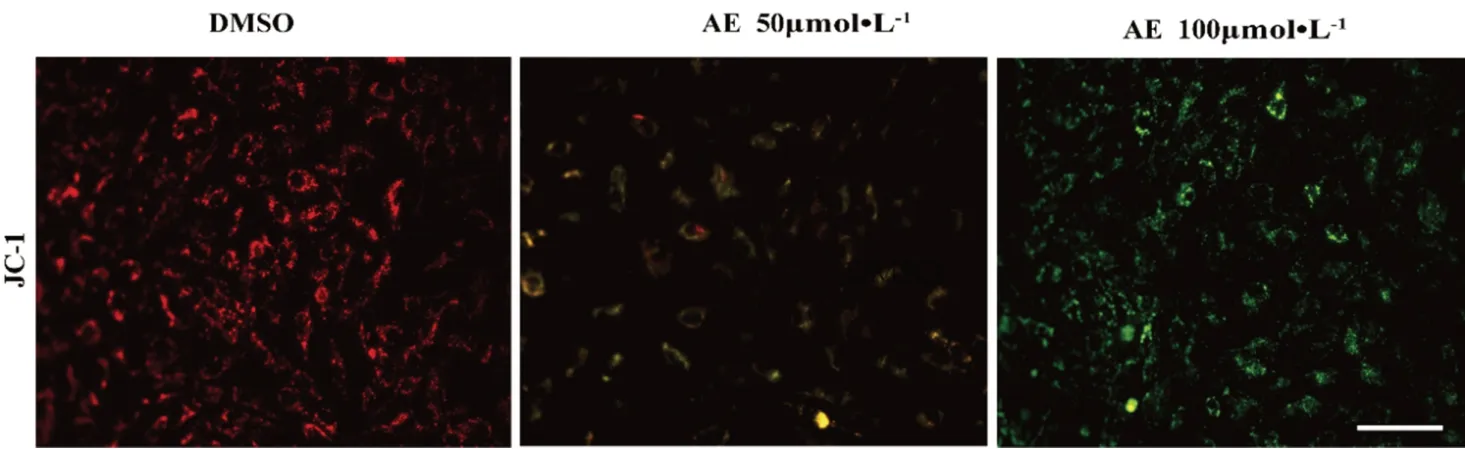
图8 线粒体膜电位检测(比例尺:×200)Fig 8 Detection of mitochondrial membrane potential(scale bar:×200)
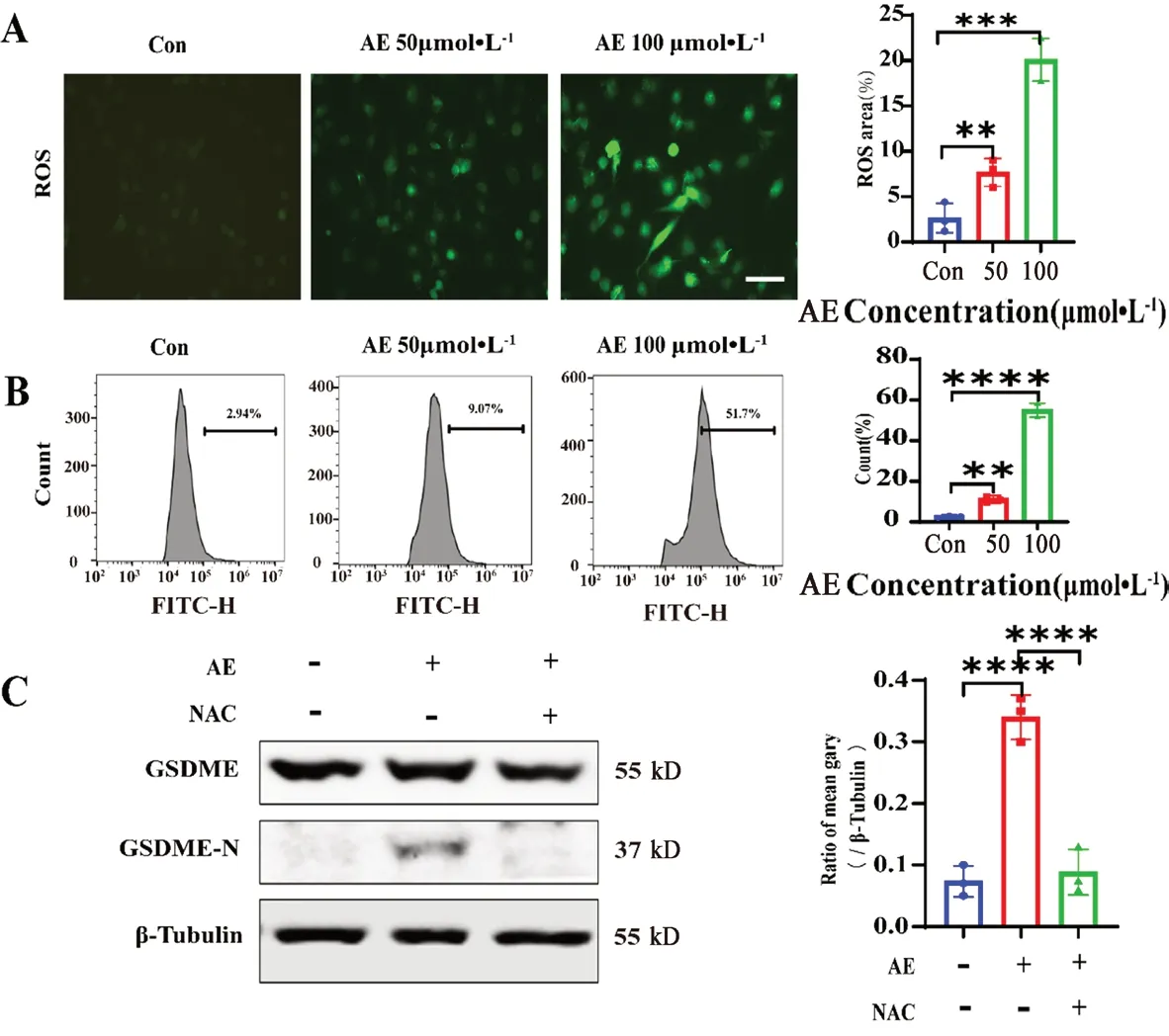
图9 AE诱导U87MG细胞ROS产生及抗氧化剂NAC对GSDME活化的影响Fig 9 AE induced ROS production in GBM cells and the effect of antioxidants NAC on GSDME activation
2.6 统计学方法
所有定量数据均以算术平均值±标准差(±s)表示。采用双尾独立样本t检验比较两组平均值,使用单因素方差分析与Bonferroni的事后分析比较两组以上的平均值。其余数据均采用非参数单向Kruskal-Wallis检验,再进行Dunnett多重比较。P<0.05为差异具有统计学意义。
3 讨论
胶质瘤是中枢神经系统最常见、恶性程度最高、预后最差的恶性肿瘤[2]。Westphal等[19]认为,癌症相关凋亡诱导和执行缺陷是治疗失败的重要原因[20-21]。AE作为一种从天然中草药中提取的单体化合物,可通过多种途径发挥抗肿瘤作用,而AE应用于抗GBM的治疗尚不多见。我们的研究首次发现AE通过激活CASP3/GSDME通路诱导GBM焦亡发挥抗胶质瘤作用,可能为胶质瘤的治疗提供新的策略。
焦亡是新发现的程序性细胞死亡方式,而GSDME途径的焦亡被认为具有良好的抗肿瘤应用前景,是GBM的一个重要的预后预测因子[22]。化疗药物被认为是诱导焦亡发生的重要途径之一,其诱发焦亡是通过激活凋亡关键蛋白CASP3来实现的[23-24]。CASP3是天冬氨酸特异酶切的半胱氨酸蛋白酶,正常状况下以无活性的酶原形式存在于细胞质中,既往研究认为CASP3是凋亡相关关键蛋白,CASP3激活后,细胞进入凋亡途径,近年研究表明CASP3的剪切和活化,可进一步剪切和活化焦亡关键蛋白GSDME,释放的GSDME-N端片段具有细胞膜及线粒体成孔功能,细胞膜的成孔会导致细胞内容物如LDH、HMGB1的释放,细胞内外渗透压失衡,诱导细胞焦亡[25-27]。而HMGB1等抗原物质的释放能激活抗原递呈细胞,进而激活杀伤性T细胞,同时引起肿瘤相关巨噬细胞的活化及浸润,起到免疫放大作用,扩大抗肿瘤效应[28-29]。故GSDME途径的焦亡发挥抗肿瘤效应受到直接的细胞成孔及间接的免疫激活双重作用。目前的研究显示乳腺癌、黑色素瘤、胃癌细胞的焦亡有明显的肿瘤抑制作用[30-31]。
GSDME的表达可促使细胞从凋亡向焦亡转变[23],GSDME在GBM中高表达,使其成为诱导焦亡抗GBM治疗的天然靶点,故筛选合适的焦亡激活药物尤为重要。目前的研究显示多种化学药物如顺铂、阿霉素等具有GSDME途径焦亡诱导作用[29],但血脑屏障的存在及其毒副作用限制了其颅内应用。AE具有血脑屏障能力[32],本研究显示AE具有确切的CASP3、GSDME活化作用及GBM细胞抑制作用,故AE可以作为诱导GBM焦亡抗肿瘤的良好候选药物。中等浓度的AE可明显抑制GBM活性,但未见明显的CASP3与GSDME的活化,这提示诱导焦亡是AE抑制GBM细胞的途径之一,目前有文献显示AE可抑制DNA合成、阻滞细胞周期[11-12],故认为AE抗GBM的机制为包括诱导焦亡在内的多种途径渗入,其焦亡诱导作用也是有限的。GSDME在正常脑组织及机体器官有表达,GSDME的完全激活会引起正常组织损伤,这也被认为与多种化疗药物的毒副反应相关[26],而AE有限的焦亡诱导作用既有利于其发挥对肿瘤的抑制作用,又可避免焦亡过度激活所引起的正常组织损伤,是一种适合临床应用的理想的焦亡诱导药物,当然其更明确的抗GBM作用及安全性有待体内实验进一步明确。
焦亡的发生与线粒体的功能障碍以及ROS产生密切相关[17],Yang等[33]研究显示:ROS产生可激活JNK/Cytochrome C/CASP9/CASP3通路,而诱导高表达GSDME的细胞出现焦亡;An等[18]研究显示:线粒体ROS的产生可激活CASP3/GSDME,进而诱导乳腺癌细胞焦亡。以上研究显示,线粒体功能障碍和ROS产生是CASP3/GSDME 途径焦亡的启动因素之一,我们的研究也显示AE处理的GBM细胞在晚期(60 h)出现细胞焦亡,而在早期(24 h)检测ROS水平,显示ROS表达水平明显升高,而用抗氧化剂阻断ROS可抑制AE所诱导的GSDME的活化,说明AE介导GBM细胞焦亡和诱发线粒体功能障碍和ROS产生相关。
综上,本文以胶质瘤细胞为研究对象,通过体外实验证明AE以浓度依赖的方式抑制GBM细胞活性,诱导GBM细胞出现焦亡特异性外观及LDH释放,介导CASP3、GSDME蛋白水平的剪切活化,上调GSDME在mRNA的表达,诱导线粒体功能障碍和ROS的产生。证实激活CASP3/GSDME通路是AE抗GBM的机制之一,可为胶质瘤的治疗提供一种新的选择。