沙蟾毒精通过Nrf2-HO-1/SLC7A11途径诱导人胃癌SGC-7901细胞铁死亡
2023-04-01王文君刘霞霞陈馨程卉王国凯安徽中医药大学药学院合肥23002新安医学教育部重点实验室合肥230038安徽中医药大学科研技术中心合肥230038
王文君,刘霞霞,陈馨,程卉*,王国凯*(. 安徽中医药大学药学院,合肥 23002;2. 新安医学教育部重点实验室,合肥 230038;3. 安徽中医药大学科研技术中心,合肥 230038)
胃癌(gastric cancer,GC)是全球最常见的恶性肿瘤之一,在消化道恶性肿瘤中排第二位,2020年新增100多万病例,有76.9万人死亡,发病率、病死率均较高[1]。多数患者确诊时已经处于GC中晚期,术后易复发转移[2],化疗有助于延长患者的生存时间,提高患者的生活质量。然而,目前的化疗药物对GC的治疗效果十分有限[3-4],因此亟待发掘新的化疗药物。
天然化合物沙蟾毒精(ArBu)是从中华大蟾蜍的蟾酥和蟾皮提取得到的一种新的潜在抗肿瘤成分[5],分子式为C24H32O6,分子量为416.5,目前已有诸多研究发现ArBu具有广谱抗肿瘤活性,主要通过诱导细胞凋亡、抑制血管生成以及肿瘤细胞的黏附、迁移和侵袭发挥作用[6-8]。
铁死亡(ferroptosis)是一种依赖于铁代谢的新的程序性细胞死亡方式,即在二价铁或脂氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,使活性氧(reactive oxygen species,ROS)积聚导致脂质过氧化,从而诱导细胞死亡[9-11]。越来越多的天然化合物被发现能通过铁死亡途径发挥抗肿瘤作用[12],但未见研究报道ArBu诱导GC细胞铁死亡。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是控制细胞氧化还原、动态平衡和炎症的关键转录因子,与铁死亡氧化应激通路密切相关,Nrf2可以通过调控血红素加氧酶-1(heme oxygenase-1,HO-1)和溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)诱导铁死亡[13-14]。因此,本研究旨在观察ArBu是否能诱导人胃癌细胞系SGC-7901细胞发生铁死亡,并探讨其机制。
1 材料
1.1 肿瘤细胞
人胃癌细胞SGC-7901(中国科学院上海细胞库),在含10%胎牛血清,1%青霉素链霉素混合液的RPMI-1640培养基中于37℃,5%CO2的条件下培养。
1.2 仪器
酶标仪(美国MD公司,iD3);细胞培养箱(美国Thermo Fisher公司,BB150);生物安全柜(浙江苏净净化公司,BSC-1000ⅡA2);离心机(德国Eppendorf公司,5418R);显微镜(德国徕卡公司,DMI6000B);透射电镜(日本日立公司,Hitachi-600);蛋白电泳及转印系统(美国伯乐公司,Mini-PROTEAN);流式细胞仪(美国Beckman公司,FC500);凝胶成像仪(广州博鹭腾生物科技有限公司,GelView6000Plus)。
1.3 试药
ArBu[安徽华润金蟾药业股份有限公司提供,纯度为94.1%,CAS:464-74-4,用二甲基亚砜(DMSO)(终浓度<0.1%)助溶后加入 RPMI-1640培养液配制];Fer-1(批号:#28329,规格:10 mmol·L-1×1 mL,MedChemExpress公司),CCK-8试剂盒(批号:2J226,麦客生物有限公司),谷胱甘肽(GSH)检测试剂盒(批号:20220513)、超氧化物歧化酶(SOD)检测试剂盒(批号:20211124)、丙二醛(MDA)检测试剂盒(批号:20210923)(南京建成科技有限公司),脂质ROS检测试剂盒(批号:2011556,Thermo Fisher Scientific公司),BCA蛋白浓度测定试剂盒(批号:092721220221,碧云天生物技术有限公司),细胞Fe含量检测试剂盒(批号:BC5310,北京索莱宝公司),Nrf2抗体、谷胱甘肽过氧化物酶4(GPX4)抗体(Cell Signaling Technology公司),SLC7A11抗体、铁蛋白重链1(FTH1)抗体(Affinity Biosciences公司),HO-1抗体、β-actin抗体、二抗(正能生物技术有限责任公司),ECL显影发光液(批号:22182599,兰杰柯科技有限公司)。
2 方法
2.1 CCK-8法检测细胞增殖
将SGC-7901细胞接种到96孔板中培养过夜,每孔100 μL(5×103个),每组6个复孔,第2日将原培养基吸出,加入不同浓度的药物培养基(0、0.1、0.2、0.4、0.8、1.6、3.2 μmol·L-1ArBu,5 μmol·L-1Fer-1,0.4 μmol·L-1ArBu+5 μmol·L-1Fer-1)的培养基100 μL继续培养24 h和48 h。每孔加入CCK-8试剂10 μL,继续在培养箱里避光培养2 h。用酶标仪在450 nm波长处测定每孔的吸光度值A,用不含细胞的培养基来校正。将细胞存活率输入GraphPad 6.0 Prism 8.0.2计算IC50。细胞存活率(%)=[(A药物-A空白)/(A对照-A空白)]×100%。
2.2 显微镜和透射电镜观察细胞及线粒体形态变化
将细胞分为对照组(含同浓度DMSO)、ArBu中浓度组(0.4 μmol·L-1)和ArBu联合Fer-1组(0.4 μmol·L-1+5 μmol·L-1)。细胞处理24 h后,分别用显微镜(×200)和透射电镜(×7000)观察细胞及线粒体形态变化。
2.3 GSH、SOD、MDA和总Fe水平的测量
将细胞分为对照组(含同浓度DMSO),ArBu低、中、高浓度组(0.2、0.4、0.8 μmol·L-1)和ArBu(0.4 μmol·L-1)联合Fer-1(5 μmol·L-1)组。细胞处理24 h后,将SGC-7901细胞用胰酶消化收集于PBS中,并于4℃条件下超声破碎成细胞匀浆,按照试剂盒说明书操作,检测GSH、SOD、MDA和总Fe水平。用BCA法对细胞的蛋白水平进行定量。
2.4 脂质ROS水平的测量
细胞分组同“2.3”项下。细胞处理24 h后,弃去含药培养基,加入含有C11-BODIPY581/591荧光探针的培养基,37℃避光孵育30 min,弃去培养基,用无血清培养基洗涤3次,收集细胞后用流式细胞仪检测荧光强度。
2.5 Western blot检测蛋白表达
将细胞分为对照组(含同浓度DMSO)、ArBu低、中、高浓度组(0.2、0.4、0.8 μmol·L-1),细胞处理24 h后收集细胞,提取总蛋白,BCA法进行蛋白定量,加入 5×loading buffer,100℃金属浴煮沸10 min使蛋白变性。采用SDS凝胶电泳将蛋白质分离,上样10 μL蛋白样品,电泳转移至硝酸纤维素膜上。5%脱脂牛奶封闭2 h,孵育相对应的一抗(1∶1000),4℃过夜,二抗(1∶10 000)室温孵育2 h。ECL显影发光液显色,凝胶成像仪拍照,Image J 6.0软件分析条带灰度值,计算相对表达量(%)=(目标蛋白÷参比蛋白β-actin的灰度值)×100%。
2.6 统计学处理
定量研究结果采用GraphPad Prism 8.0.2软件进行分析并作图。所有实验都至少重复了3次。数据比较采用单因素方差分析(One-way,ANOVA)和Dunnett’s检验,P<0.05为差异有统计学意义。
3 结果
3.1 ArBu抑制SGC-7901细胞增殖
ArBu处理SGC-7901细胞24 h和48 h的细胞存活率结果见图1。与对照组相比,SGC-7901细胞的存活率随着ArBu的浓度增大和处理时间的延长逐渐降低,24 h和48 h 的IC50值分别为0.46 μmol·L-1和0.26 μmol·L-1。因此,选择0.2、0.4、0.8 μmol·L-1作为ArBu低、中、高浓度进行后续实验。此外,与0.4 μmol·L-1ArBu处理组相比,ArBu联合Fer-1组(0.4 μmol·L-1+5 μmol·L-1)细胞存活率明显升高(P<0.01),说明ArBu抑制SGC-7901细胞增殖确实有铁死亡参与,且Fer-1能部分逆转铁死亡所导致的细胞增殖的抑制。
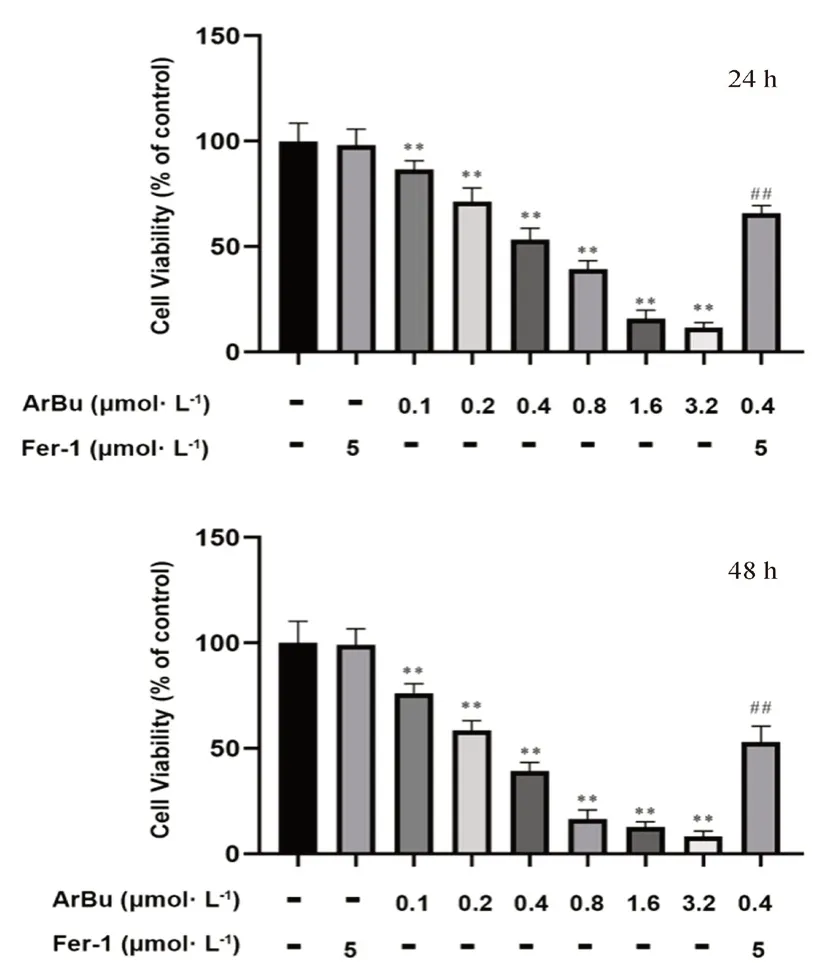
图1 ArBu对SGC-7901细胞存活率的影响Fig 1 Effect of ArBu on cell viability of SGC-7901 cells
3.2 细胞形态变化
ArBu处理SGC-7901细胞24 h后,与对照组相比,ArBu中浓度组(0.4 μmol·L-1)的细胞和线粒体失去正常形态,明显变形皱缩,线粒体嵴消失,线粒体和部分细胞死亡;与0.4 μmol·L-1ArBu处理组相比,ArBu联合Fer-1组(0.4 μmol·L-1+5 μmol·L-1)与对照组细胞形态无明显差异,线粒体并未皱缩变小(见图2)。
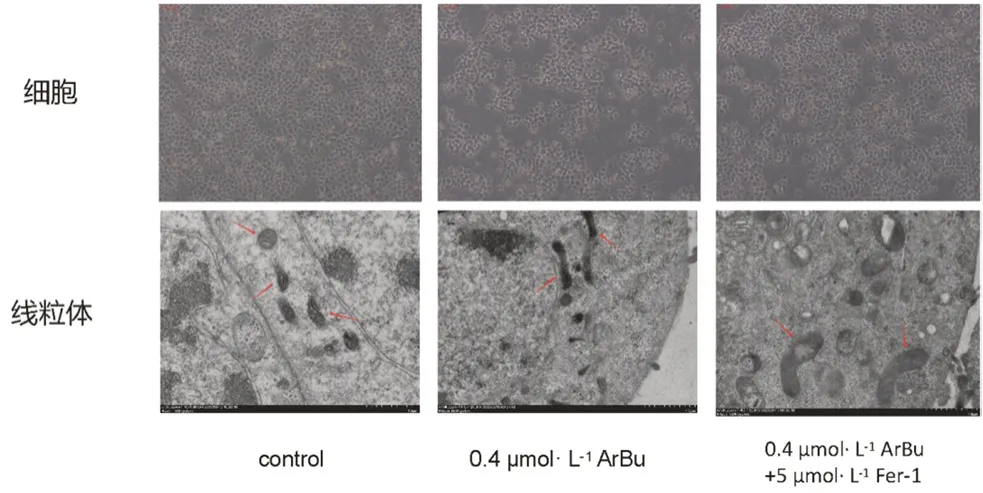
图2 显微镜(×200)和透射电镜(×7000)下0.4 μmol·L-1 ArBu以及联合5 μmol·L-1 Fer-1处理SGC-7901细胞24 h后的细胞和线粒体形态图Fig 2 Morphology of cells and mitochondria of SGC-7901 cells treated with 0.4 μmol·L-1 ArBu or combined with 5 μmol·L-1 Fer-1 for 24 h under microscope(×200)and transmission electron microscope(×7000)
3.3 ArBu对SGC-7901细胞GSH、SOD、MDA和总Fe水平的影响
ArBu处理SGC-7901细胞24 h后,与对照组相比,细胞内GSH和SOD水平明显降低(P<0.01),MDA和总Fe水平明显升高(P<0.05,P<0.01),且都呈现出浓度依赖性;与0.4 μmol·L-1ArBu组相比,ArBu联合Fer-1组(0.4 μmol·L-1+5 μmol·L-1)细胞内GSH和SOD水平显著升高(P<0.05),MDA和总Fe水平显著降低(P<0.01)(见图3)。

图3 ArBu对SGC-7901细胞GSH、SOD、MDA和总Fe水平的影响Fig 3 Effect of ArBu on GSH,SOD,MDA and total Fe levels in SGC-7901 cells
3.4 ArBu对SGC-7901细胞脂质ROS水平的影响
ArBu处理SGC-7901细胞24 h后,与对照组相比,峰显著右移,荧光更强,且呈浓度依赖性,与0.4 μmol·L-1ArBu组相比,ArBu联合Fer-1组(0.4 μmol·L-1+5 μmol·L-1)峰明显左移,荧光较弱(见图4A)。细胞内脂质ROS水平变化见图4B,与对照组相比,ArBu处理组细胞内脂质ROS水平明显升高(P<0.01),且呈浓度依赖性。与0.4 μmol·L-1ArBu组相比,0.4 μmol·L-1ArBu联合Fer-1(5 μmol·L-1)组细胞内脂质ROS水平显著降低(P<0.05)。
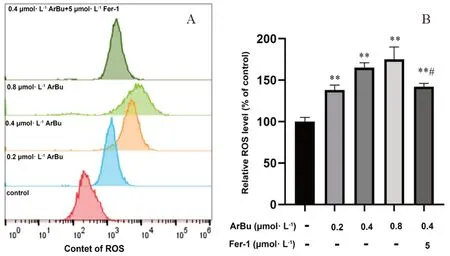
图4 ArBu对SGC-7901细胞脂质ROS水平的影响Fig 4 Effect of ArBu on lipid ROS levels in SGC-7901 cells
3.5 ArBu对SGC-7901细胞Nrf2-HO-1/SLC7A11途径相关蛋白表达的影响
与对照组相比,ArBu处理SGC-7901细胞24 h后,Nrf2、HO-1、SLC7A11、FTH1和GPX4的表达水平均降低(P<0.05),且呈浓度依赖性(见图5)。说明ArBu能通过Nrf2-HO-1/SLC7A11途径诱导SGC-7901细胞铁死亡。
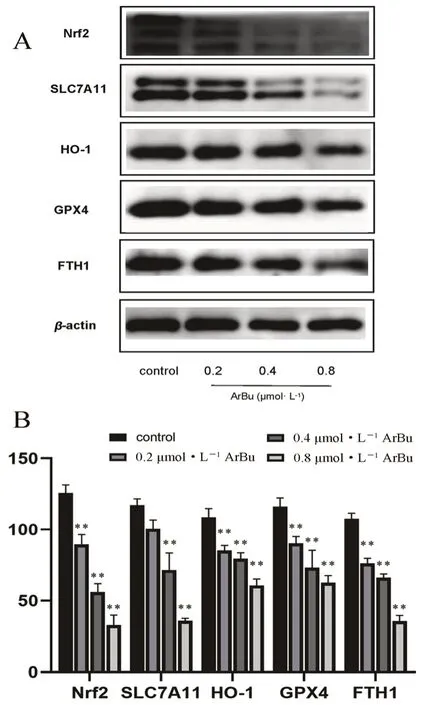
图5 ArBu对SGC-7901细胞Nrf2-HO-1/SLC7A11途径相关蛋白表达的影响Fig 5 Effect of ArBu on the expression of Nrf2-HO-1/SLC7A11 pathway-related proteins in SGC-7901 cells
4 讨论
GC占全球新发肿瘤病例的6%,我国是GC患者最多的国家,在2020年有47.85万新发病例,37.38万死亡病例,占全球GC新发病例和死亡病例的44.0%和48.6%[1]。寻找有效、安全、低毒的抗GC药物已成为应对这一威胁的主要策略。
近年来越来越多的天然药物单体被发现有治疗GC的潜力。蟾蜍毒的主要活性成分ArBu是一种天然甾体化合物,已被证明能在体内外抑制多种细胞和肿瘤增殖,显示出了良好的广谱抗肿瘤活性。ArBu可作用于非小细胞肺癌(NSCLC)PC-9细胞和A549细胞,可引起染色质固缩、核碎裂和凋亡小体的形成[15-16]。ArBu还可通过干扰信号通路诱导细胞凋亡和抑制血管生成,Zhang等[17]发现ArBu能通过PI3K/AKT/mTOR信号通路诱导肝癌细胞HepG2凋亡,Li等[18]发现通过VEGFR-2信号通路,ArBu可以抑制VEGF介导的血管生成,抑制血管内细胞迁移和侵袭以及人脐静脉内皮细胞(HUVECs)的形成。本研究通过CCK-8法发现,ArBu能显著降低SGC-7901细胞的存活率且具有时间和浓度依赖性,24 h和48 h的IC50值仅为0.46 μmol·L-1和0.26 μmol·L-1,显示ArBu具有良好的抗肿瘤细胞活性。
铁死亡领域自从被发现以来就被联想到与肿瘤相关,铁死亡的化学诱导剂也是在寻找新的抗肿瘤化合物过程中发现的[19-20]。铁死亡的起始和执行与氨基酸、脂质和铁代谢调节都有联系,受到多种分子机制的调控。
当0.4 μmol·L-1ArBu与5 μmol·L-1铁死亡特异性抑制剂 Fer-1联用时,24 h和48 h的细胞存活率明显升高(P<0.01),说明ArBu抑制SGC-7901细胞增殖可能与铁死亡相关。用显微镜和透射电镜观察细胞和线粒体的形态变化时发现,与对照组相比,ArBu处理SGC-7901细胞24 h后,细胞和线粒体明显变形皱缩,部分细胞死亡,线粒体嵴消失;但当Fer-1联合ArBu处理SGC-7901细胞24 h,细胞形态与对照组无明显差异,线粒体并未皱缩变小;并且氧化应激相关指标GSH、SOD、MDA、总Fe和脂质ROS的水平的变化,也证实了ArBu能诱导SGC-7901细胞发生铁死亡。
Nrf2是控制细胞氧化还原、动态平衡和炎症的关键转录因子,同时与铁死亡氧化应激通路密切相关,Nrf2作为转录因子促进SLC7A11和GPX4的表达,还调控下游的靶基因HO-1和FTH1[14,21-22]。GPX4对铁死亡起到至关重要的调控作用,GPX4和细胞膜上的胱氨酸/谷氨酸转运受体(System Xc-)以及各种铁死亡相关蛋白是通过影响ROS代谢发挥其功能的,GSH是GPX4催化脂质过氧化物还原过程的主要辅助因子[23]。System Xc-由SLC7A11和 SLC3A2组成,能够使细胞内谷氨酸和细胞外胱氨酸进行1∶1交换[24],进入细胞内的胱氨酸可被还原成半胱氨酸,参与GSH的合成。抑制System Xc-会导致GSH耗竭并间接诱导GPX4失活,最终导致ROS聚集,诱发铁死亡[9]。Western blot结果显示,ArBu处理细胞24 h后,Nrf2、SLC7A11和GPX4的表达水平明显下降,可能是ArBu抑制了Nrf2的表达,Nrf2又下调了SLC7A11和GPX4的表达,而下调SLC7A11的表达会耗竭GSH,进一步抑制GPX4,GSH的试剂盒检测结果也显示ArBu能显著降低GSH水平。
HO-1是一种重要的抗氧化酶,主要催化血红素分解代谢成亚铁、一氧化碳和胆绿素:一方面,血红素基团的降解有利于阻止其促氧化作用;另一方面,副产物胆绿素及其还原型胆红素具有有效ROS清除活性[25-27]。HO-1是细胞铁离子的重要来源,在铁死亡诱导剂erastin诱导的细胞死亡中,可以使膜脂质过氧化诱导细胞发生铁死亡[28]。铁蛋白轻链(FTL)和FTH1可以将细胞中多余的铁储存在胞质中[29],FTL和FTH1的失活会导致细胞内铁离子浓度因代谢失衡而升高。本研究结果显示ArBu处理细胞24 h后,HO-1和FTH1的表达水平显著降低,Nrf2表达的抑制可能下调了下游HO-1和FTH1的表达,从而导致铁稳态失衡,细胞内亚铁离子浓度升高发生芬顿反应。
GPX4的抑制和芬顿反应都会产生大量ROS,HO-1的抑制导致无法有效清除ROS,进一步加剧了ROS的大量蓄积,流式细胞术也证实了ArBu处理SGC-7901细胞24 h后,脂质ROS水平显著升高,而ROS的蓄积最终诱发细胞铁死亡。
综上,ArBu能抑制Nrf2-HO-1/SLC7A11途径,破坏SGC-7901细胞的抗氧化应激系统,使细胞内铁代谢和GSH代谢失衡,亚铁的大量存在导致芬顿反应发生,GSH的耗竭使GPX4失活,HO-1的抑制使ROS无法有效清除,最终导致ROS蓄积,诱发铁死亡,抑制SGC-7901细胞增殖。本研究表明ArBu对SGC-7901细胞具有良好的抗肿瘤活性,为ArBu治疗GC提供了实验依据。
