TNNT1 在晚期非小细胞肺癌中的表达及与患者预后的关系
2023-03-29朱洪斌
邓 浩,朱洪斌,朱 楠,王 瑞
(安徽医科大学附属巢湖医院呼吸与危重症医学科,安徽 巢湖 238000)
肺癌(lung cancer)是近年来世界范围内发病率和死亡率高居首位的恶性肿瘤,而大部分的肺癌患者为非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC 是肺癌的主要组织学类型,包括肺腺癌、肺鳞癌等[1]。近年来肺癌的诊治技术不断进步,靶向治疗及免疫治疗在肺癌诊治中得到广泛应用,但是NSCLC 的5 年生存率仍然低于20%[2]。这主要是由于肺癌具有极其复杂的生物学特性,而且因为缺乏早期诊断,患者在确诊时多已处于病程的晚期,寻找有效的治疗靶点一直是临床工作的重点[3]。肌钙蛋白T1(slow skeletal muscle troponin T,TNNT1)已经被报道在宫颈癌、卵巢癌、结肠癌等多种癌症组织中存在过度表达[4],并且已被证实与肿瘤细胞的增殖和迁移能力等相关[5],然而目前还没有与NSCLC 相关的研究。本研究首先通过对公共数据库中NSCLC 的数据进行挖掘,分析TNNT1mRNA在在NSCLC 中的表达情况及其与预后的关系;进一步通过免疫组化方法检测我院2018 年1 月-2019年9 月收治的80 例晚期NSCLC 患者TNNT1蛋白的表达水平,分析其与患者临床病理参数和预后的关系,以期为NSCLC 患者的治疗和预后研究提供理论依据和思路。
1 资料与方法
1.1 肿瘤基因组计划(The Cancer Genome Atlas,TCGA)数据库分析 登录Ualcan 数据库(http://ualcan.path.uab.edu/)在线分析网站,选择“TCGA”选项,在检索框中输入关键词“TNNT1”:点击“expression”得到TNNT1 mRNA 在各种肿瘤中的表达数据,切换至“Lung adenocarcinoma”选项导出TNNT1 mRNA 在肺腺癌中的表达情况,切换至“Lung squamous cell carcinoma”选项导出TNNT1mRNA 在肺鳞癌中的表达情况;点击“survival”进行生存分析,切换至“Lung adenocarcinoma”选项导出TNNT1 表达与肺腺癌患者预后的生存曲线图,切换至“Lung squamous cell carcinoma”选项导出TNNT 表达与肺鳞癌患者预后的生存曲线图。
1.2 一般资料 选取安徽医科大学附属巢湖医院2018 年1 月-2019 年9 月收治并经病理诊断确诊的80 例晚期NSCLC 患者为研究对象,其中鳞状细胞癌38 例(47.50%),腺癌42 例(52.50%);男57 例(71.25%),女23 例(28.75%);年龄53~86 岁;高分化40 例(50.00%),中低分化40 例(50.00%);Ⅲ期32 例(40.00%),Ⅳ期48 例(60.00%);无淋巴结转移者22 例(27.50%),转移至淋巴结者58 例(72.50%)。纳入标准:①初次诊断,入院前未经放化疗,未经手术治疗,经临床和病理诊断确诊为晚期NSCLC;②临床资料完整,病理分型分期及随访信息完整;③未经靶向治疗及免疫治疗,基因检测结果为阴性。排除标准:①继发性肿瘤;②数据不完全的患者;③失访患者。本研究所选取的组织均通过病理学认证,对照组织来源于同期我院心胸外科手术切除的良性肺部病变组织,共20 例。
1.3 免疫组织化学染色法检测TNNT1 蛋白在肺癌及正常组织表达
1.3.1 免疫组化步骤与方法 ①石蜡切片常规脱蜡、水化;②煮沸EDTA 抗原修复液至沸腾,将功率调至最小进行保温,将切片置于耐高温染片架上,放入已沸腾的修复液中,盖上锅盖,继续加热20 min 后,离开热源,自然冷却10 min;自来水冲淋不锈钢锅外壁使之冷却,待锅中液体冷却至室温后取出切片;蒸馏水冲洗及PBS 溶液冲洗;③阻断内源性过氧化物酶:加100 μl 内源性过氧化物酶阻断剂,室温下孵育10 min;PBS 溶液冲洗;④加一抗:加100 μl 的一抗,室温下孵育10 min;PBS 溶液冲洗;⑤加酶标聚合物:加100 μl 酶标羊抗小鼠/兔IgG 聚合物,室温下孵育15 min;PBS 溶液冲洗;⑥显色:加100~200 μl新鲜配制的DAB 显色液,孵育3~5 min,光镜观察染色结果;⑦复染:自来水冲洗,苏木素染色液孵育10~30 s;⑧脱水封片。
1.3.2 免疫组化评分 由我院病理科经验丰富的两位病理诊断医师进行双盲阅片。在光学显微镜下观察切片,以细胞染色强度及阳性细胞的百分比进行评分。出现黄色或棕褐色为阳性染色:无着色为0 分,浅黄色1 分,棕黄色2 分,棕褐色3 分。阳性细胞数≤10%为1 分,10%~50%为2 分,>50%为3 分。两组评分结果相乘结果≥3 分即为高表达,<3 分即为低表达。
1.4 统计学方法 使用SPSS 26.0 软件对数据进行统计学处理,计数资料采用[n(%)]表示,行χ2检验;计量资料采用(±s)表示,行t检验,采用Kaplan-Meier生存曲线进行生存分析,Cox 回归模型进行单因素和多因素分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 TCGA 数据库分析TNNT1 mRNA 在NSCLC 中的表达及与预后的关系 Ualcan 在线网站分析TCGA数据库中肺腺癌和肺鳞癌数据集,其中肺腺癌数据集包含515 例癌组织和59 例癌旁正常组织,肺鳞癌数据集包含503 例癌组织和52 例癌旁正常组织,NSCLC 组织的TNNT1 mRNA 表达水平均较癌旁正常组织水平升高(P<0.05),见图1、图2;进一步利用TCGA 数据库中的临床资料进行生存分析,结果显示在肺腺癌患者中,TNNT1 mRNA 高表达组总生存时间较TNNT1 mRNA 中低表达组的总生存时间短(P<0.05),见图3、图4。

图1 TNNT1 在肺腺癌及癌旁组织中的表达水平

图2 TNNT1 在肺鳞癌及癌旁组织中的表达水平

图3 TCGA 数据库中肺腺癌患者生存曲线图

图4 TCGA 数据库中肺鳞癌患者生存曲线图
2.2 免疫组织化学染色检测TNNT1 蛋白在晚期NSCLC 中的表达情况 TNNT1 蛋白在癌组织中主要呈现高表达,在正常组织中主要呈低表达;在80例晚期NSCLC 组织中,TNNT1 蛋白高表达共54 例(67.50%),低表达为26 例(32.50%);在20 例正常肺组织中,TNNT1 蛋白高表达共5 例(25.00%),低表达共15 例(75.00%)。TNNT1 蛋白定位于细胞浆,阳性表达呈黄色或棕褐色弥漫染色,见图5。

图5 免疫组织化学染色检测TNNT1 蛋白在肺腺癌、肺鳞癌和正常组织中的表达情况(×200)
2.3 TNNT1 蛋白的表达水平与临床病理参数特征的关系 TNNT1 蛋白的表达与患者淋巴结转移、TNM分期相关,而与年龄、性别、病理类型、肿瘤分化程度、肿瘤大小无关,见表1。
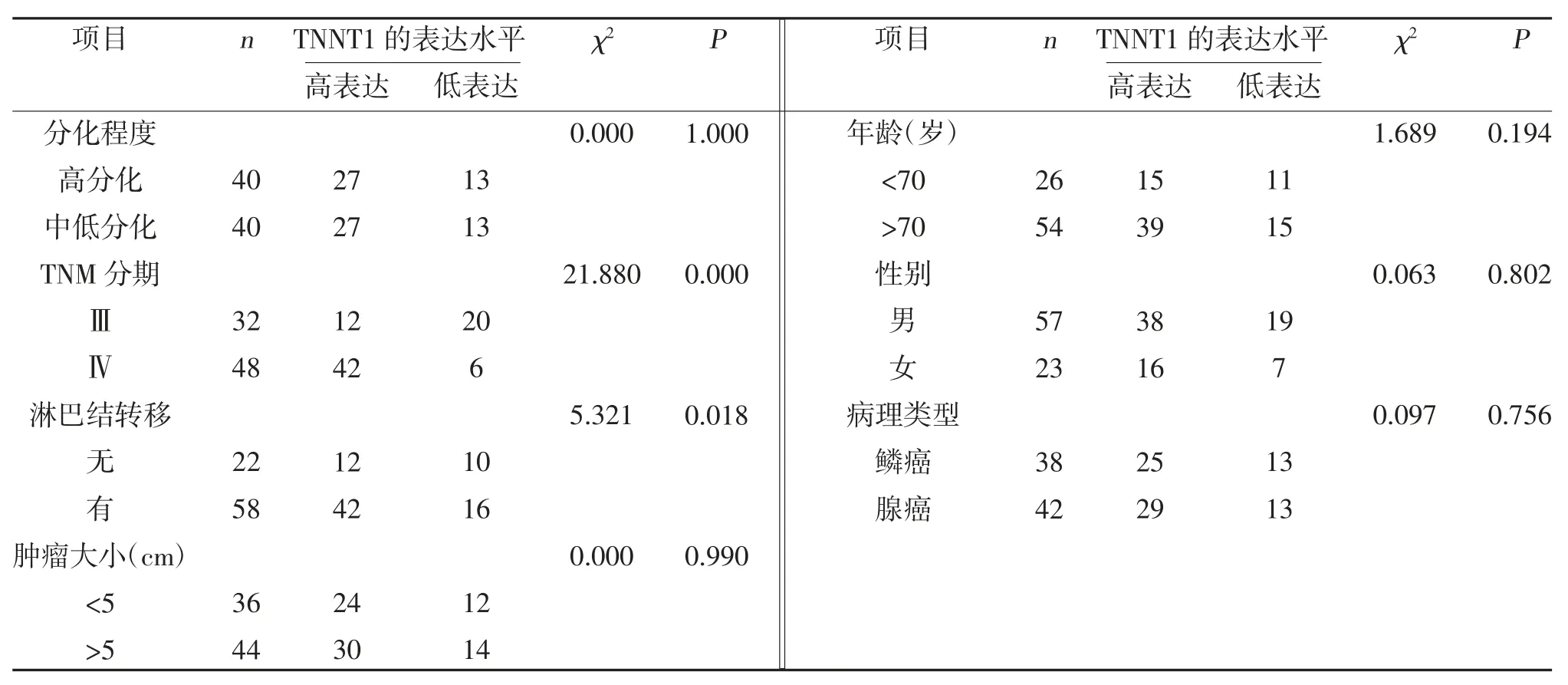
表1 TNNT1 表达与晚期NSCLC 患者临床病理参数特征的关系(n)
2.4 TNNT1 蛋白的表达水平与晚期NSCLC 患者预后的关系 Kaplan-Meier 生存曲线分析表明,TNNT1蛋白高表达的晚期NSCLC 患者其3 年总生存期及3 年无进展生存期低于TNNT1 蛋白低表达患者;TNNT1 高表达组的mOS 为9.5 个月,mPFS 为4.5 个月;TNNT1 低表达的mOS 为34.5 个月,mPFS 为10.9 个月。TNNT1 蛋白高表达的患者的总生存期及无进展生存期更短,预后较差,见图6 和图7。

图6 TNNT1 表达与晚期NSCLC 患者OS 的关系

图7 TNNT1 表达与晚期NSCLC 患者PFS 的关系
2.5 Cox 单因素和多因素回归分析 单因素分析表明,TNNT1 蛋白的表达水平和TNM 分期是影响晚期NSCLC 患者总生存期的重要因素;多因素分析表明,TNNT1 蛋白的表达水平和TNM 分期是晚期NSCLC 患者总生存期的独立危险因素。单因素分析表明TNNT1 蛋白的表达水平和TNM 分期是影响晚期NSCLC 患者无进展生存期的重要因素;多因素分析同样表明TNNT1 蛋白的表达水平和TNM 分期是晚期NSCLC 患者无进展生存期的独立危险因素,见表2。

表2 单因素及多因素分析TNNT1 的表达与晚期NSCLC 患者总生存期和无进展生存期的关系
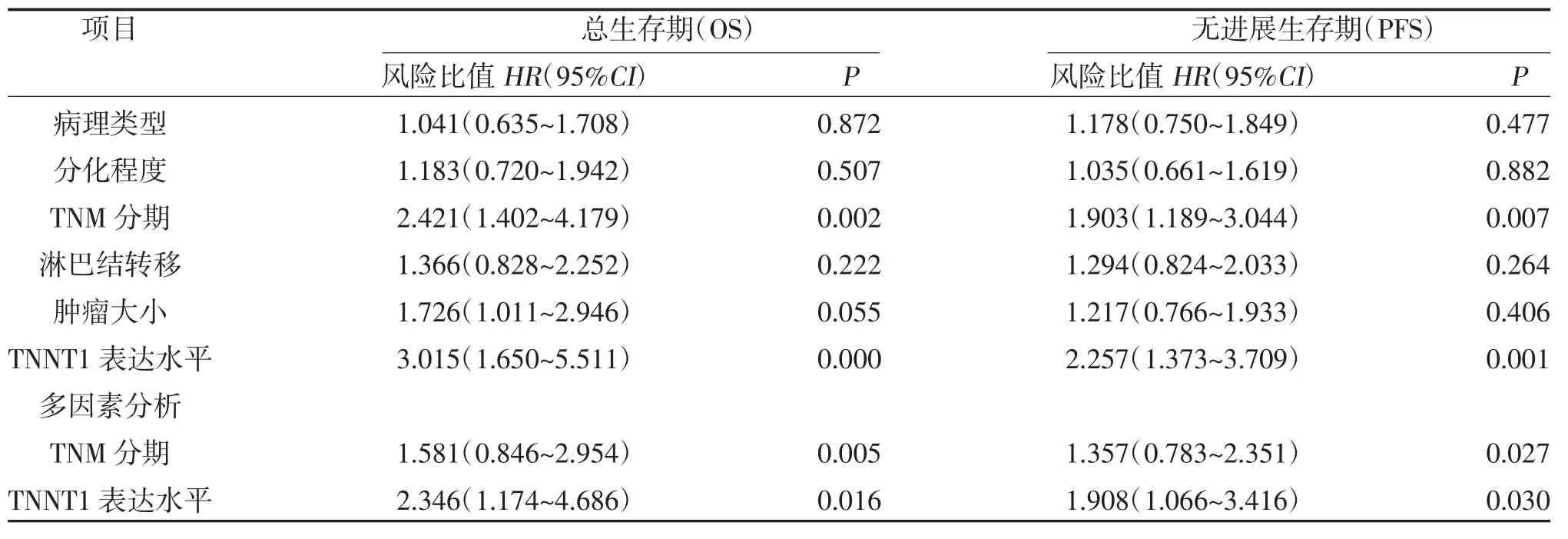
表2 (续)
3 讨论
肌钙蛋白T(Troponin T,TnT)是一种分子量大小为30~35 kDa 的蛋白质,其包含220~300 个氨基酸单位,脊椎动物存在3 种类型特异性的同源TnT亚型:TNNT1、TNNT2 和TNNT3[6]。该蛋白家族成员在结构上都具有保守的C 端区域,但也具有特异的N 端区域[7]。研究表明[8],这3 种同源基因在不同的组织区域中存在差异表达,TNNT1 在慢骨骼肌中表达,TNNT2 在心肌中表达,而TNNT3 在快骨骼肌中表达,TnT 的3 种亚型都通过钙调节机制在肌肉收缩和舒张的生理过程中起重要作用。TNNT1 是包括杆状体肌病(Nemaline myopathy)在内的多种神经肌肉疾病的重要致病基因[9]。值得注意的是,近年来TNNT1 在肿瘤发生中的作用也开始逐渐成为研究的热点,TNNT1 已被证实在乳腺癌[10]、结肠癌等多种癌症组织中存在高表达,并与肿瘤的细胞学行为以及预后和生存等相关。
本研究结果显示,TNNT1 mRNA 在肺腺癌和肺鳞癌中存在高表达,而在癌旁组织中低表达(P<0.05),生存分析结果显示,TNNT1 mRNA 高表达组相比于低表达组的总生存时间缩短(P<0.05),这初步提示TNNT1 可能在NSCLC 的发生和进展中发挥作用。免疫组化实验结果表明,TNNT1 蛋白在晚期NSCLC 组织中存在高表达,而在正常组织中低表达。TNNT1 的表达水平与患者的淋巴结转移及TNM分期相关,而与年龄、性别、病理类型、肿瘤分化程度、肿瘤大小无关,说明TNNT1 与晚期NSCLC 的发生发展有一定关系。生存分析结果表明,TNNT1 高表达组患者的总生存期和无进展生存期较低表达组短(P<0.05),预后较差。有研究[11]通过免疫组化证实TNNT1 在结肠癌组织中高表达,高表达TNNT1 的结肠癌患者与低表达组的患者相比,总生存时间缩短,TNNT1 可作为结肠癌的不良预后指标。本研究在晚期NSCLC 中也得到了相同的结果。Cox 单因素和多因素回归分析结果表明,TNNT1 的表达水平和TNM 分期是晚期NSCLC 患者不良预后的独立危险因素(P<0.05),TNNT1 高表达及TNM 分期更晚的NSCLC 患者的预后较差,总生存期更短,并且更早发生肿瘤进展,这进一步表明TNNT1 可能在晚期NSCLC 的发生发展过程中发挥重要作用。
肿瘤细胞的生长是由细胞周期稳态的破坏和维持肿瘤细胞的慢性增殖引起的。在真核细胞中,细胞周期由G1、S、G2、M 期4 个连续阶段组成[12]。TNNT1的过表达可以促进细胞周期蛋白D 和细胞周期蛋白E 的表达,进而增强细胞周期的G1/S 过渡,促进肿瘤细胞的进展,可作为乳腺癌治疗的新的靶点[10]。上皮细胞-间充质转换(EMT)在肿瘤发生中起重要作用,EMT 通过调节细胞-细胞粘附、迁移和侵袭能力与癌症转移相互作用[13]。发现TNNT1 的过表达可使肿瘤细胞中E-钙粘蛋白的表达显著升高,而TNNT1 的表达下调则会产生相反的作用[14]。TNNT1的缺失和功能获得证实了TNNT1 可通过调控EMT相关因子,包括E-钙粘蛋白、N-钙粘蛋白的表达促进细胞增殖、迁移和侵袭。Gu X 等[15]报道胆囊癌的术后复发与TNNT1 的表达水平相关,高表达TNNT1的患者的术后复发率上升,同时TNNT1 的表达水平与血清CA199 的水平存在正相关,TNNT1 已被确定为该疾病良好预后的生物标志物。本研究结果同样显示了TNNT1 在晚期NSCLC 中的预后价值,高表达TNNT1 患者存在不良预后。研究表明[16,17],TNNT1可能参与TGF-β 通路的信号调节,该通路是肿瘤已被证实是肺癌等多种癌症进展的关键通路,提示了TNNT1 在肺癌肿瘤机制中的潜在作用。
TCGA 数据库目前广泛用于癌症相关基因的高通量基因组分析,筛选癌症相关基因[18]。已有多位学者的生信研究将TNNT1 筛选为尤因氏肉瘤[19]、胰腺癌[20]等癌症的预后相关基因,本研究前期通过数据挖掘筛选出了目标基因TNNT1,发现TNNT1mRNA在肺癌中存在高表达并与不良预后相关。进一步通过免疫组化实验证实TNNT1 蛋白在晚期NSCLC 组织中存在高表达,高表达组患者的总生存期和无进展生存期较低表达组短,并且与患者的临床病理参数特征相关,COX 回归分析结果表明TNNT1 的表达水平和TNM 分期是晚期NSCLC 患者不良预后的独立危险因素。
综上所述,TNNT1 可能作为NSCLC 治疗的新靶点。但研究仍有许多不足,纳入研究的样本量较小,并且仍局限在mRNA 和蛋白水平对TNNT1 在NSCLC 中的临床价值进行探讨,TNNT1 在NSCLC中的具作用机制研究仍有待基础实验证实。
