急性秋水仙碱中毒致多器官功能不全1例
2023-03-24王军辉张明西李振国李超赵麦良
王军辉,张明西,李振国,李超,赵麦良
秋水仙碱是提取自百合科植物秋水仙的一种亲脂性生物碱,主要用于抗痛风和抗肿瘤。近年来,也用于治疗慢性活动性肝炎、肝硬化、sweet综合征等疾病。秋水仙碱治疗窗窄,不良反应大,无有效的救治方法,一旦发生严重中毒,预后极差。大剂量秋水仙碱中毒的临床病例报道较少,为交流经验,现将我院收治的1例口服秋水仙碱中毒致多器官功能损害的患者诊治经过报道如下。
1 病例资料
患者,女,24岁,体质量50 kg,主因口服秋水仙碱120片5.5 h于2019年4月26日14:50入院。患者于入院前5.5 h口服秋水仙碱120片(0.5 mg/片),4.5 h前出现频繁呕吐、腹泻,大便呈水样,量较多,不伴头晕头痛、呼吸困难、意识丧失;家属发现后急呼120,送至我院;3 h前到达我院急诊,查体:T 37 ℃,P 66次/min,R 21次/min,BP 140/90 mmHg,SpO2100%,神志清楚,精神差,两肺呼吸音稍粗,未闻及干湿性啰音,心音有力,心律齐,各瓣膜听诊区未闻及杂音,腹平软,无压痛反跳痛肌紧张,肝脾肋下未触及,叩鼓音,肠鸣音存在,四肢肌张力正常,双侧巴氏征阴性;考虑“急性药物中毒”,建议洗胃治疗,患者坚决拒绝,给予心理疏导后,勉强同意,给予温水20 000 ml洗胃,过程顺利,洗胃结束给予20%甘露醇250 ml加30 g药用炭胃管注入促进毒物排出。既往“抑郁症”2年,间断口服“利培酮”治疗。平素月经规律,初潮14岁3-5/28-30,末次月经2019年4月26日。血常规:白细胞(WBC) 4.52×109/L,中性粒细胞百分比(N%)48.5%,血红蛋白(Hb)135 g/L,血小板(PLT)298×109/L。凝血功能:凝血酶原时间(PT)11.8 s,活化部分凝血活酶时间(APTT)25.7 s。血液生化:门冬氨酸氨基转移酶(AST)18.7 U/L,丙氨酸氨基转移酶(ALT)13 U/L,总蛋白(TP)56.8 g/L,白蛋白(Alb)33.2 g/L,总胆红素(TBil)2.5 μmol/L,直接胆红素(DBil)1.8 μmol/L,肌红蛋白(MYO)51.6 μg/L,肌酸激酶(CK)87.2 U/L,肌酸激酶同工酶(CK-MB)18.5 U/L,肌钙蛋白Ⅰ(CTNⅠ)0.1 μg/L,乳酸脱氢酶(LDH)209.7 U/L,羟丁酸脱氢酶(HBDH)177.2 U/L,尿素(BUN)4.17 mmol/L,血肌酐(SCr)66.4 μmol/L,钾离子(K+)4.0 mmol/L,钠离子(Na+)137.1 mmol/L,氯离子(Cl-)104.4 mmol/L。心电图:正常心电图。胸腹CT平扫:未见明显异常。为进一步治疗,以“急性秋水仙碱中毒”收住我科。
治疗经过:入院后给予急性药物中毒常规护理,重症监护,特级护理,禁食,多参数监测,留置胃管,温水洗胃,药用炭鼻饲,兰索拉唑保护胃黏膜,甲硫氨酸维B1解毒护肝,甲泼尼龙500 mg静脉滴注每天1次减轻组织损害,积极血液灌流(HP),补液促进毒物排出,营养支持,维持水电解质及酸碱平衡等治疗。血液毒物分析:检出秋水仙碱成分6.1 mg/L(治疗量<0.5 mg/L)。调整血液净化模式为CVVH+HP,依据患者凝血及PLT情况,先后采用枸橼酸抗凝、无抗凝。入院后第12小时患者BP 106/76 mmHg,P 95 次/min,考虑容量不足,加快补液。第18小时患者自觉全身疼痛,胃部烧灼、胸闷,查体可见颜面及结膜水肿。入院后第20小时BP 82/56 mmHg,积极补液联合多巴胺泵入维持血压于120/70 mmHg左右。第42小时患者自觉胸闷较前加重,查体结膜下可见出血点,右侧锁骨下中心静脉穿刺置管处可见渗血,建议机械通气治疗,家属拒绝;血液生化:WBC 12.14×109/L,PLT 75×109/L,给予重组人血小板生成素、重组人粒细胞刺激因子,升高血小板预防粒细胞缺乏;PT 32.6 s、APTT 56 s,较入院时明显延长,给予新鲜冰冻血浆400 ml输注改善凝血。入院第51小时患者自觉呼吸费力,胸闷明显,监测SpO295%,家属仅同意使用无创呼吸机辅助呼吸。第57小时复查PT 25.1 s、APTT 45 s较前略好转,患者右侧锁骨下中心静脉置管处渗血无明显减少,给予新鲜冰冻血浆400 ml及冷沉淀10 U输注治疗;入院第73小时股静脉穿刺置管处出现渗血,复查Hb 70 g/L,输注去白悬浮红细胞2 U;第79小时患者神志恍惚,家属仍不同意气管插管及有创呼吸机辅助通气。第87小时患者月经量显著增多,间断有抽搐发作,持续5~10 s,可自行缓解。入院后患者T、WBC、Hb及PLT变化趋势见图1~图4,AST、CK、CK-MB演变趋势见表1。入院第90小时自动出院。在诊疗过程中患者每天有数次至十数次黄色水样便。随访患者于出院当日15:00时(即服毒后100 h)死亡。
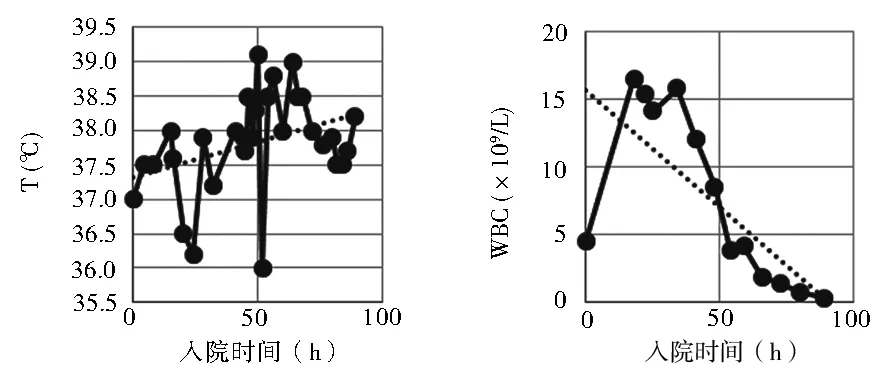
图1 T变化趋势 图2 WBC变化趋势
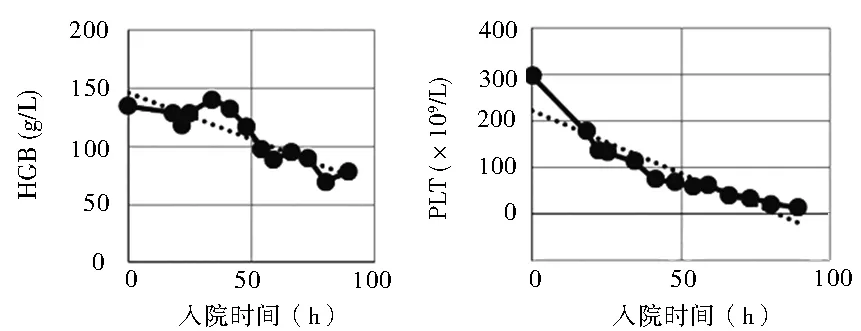
图3 Hb变化趋势 图4 PLT变化趋势
2 讨 论
秋水仙碱是从百合科植物秋水仙中提取的一种生物碱,主要应用在抗痛风、抗肿瘤领域。近年来,也用于治疗活动性肝炎、肝硬化、Sweet综合征等。随着临床应用领域的扩大,人们获取秋水仙碱的机会增多,而秋水仙碱治疗窗狭窄,中毒事件时有发生。目前国内中毒的主要原因是进食含秋水仙碱的鲜黄花菜、藏红花等及痛风患者口服秋水仙碱剂量掌握不准或应用不当,还有少数轻生者自购药物口服[1]。本文报道的是自购药物口服的病例,这种患者往往中毒严重,预后极差。
2.1 秋水仙碱的药物代谢[2]、中毒表现和临床病程 秋水仙碱口服后在胃肠道迅速吸收,30~120 min血药浓度达峰值,体内分布广,表观分布容积(Vd)2.2 L/kg,血浆蛋白结合率低,为30%~50%。秋水仙碱主要在肝内代谢,大部分从胆汁排泄。由于秋水仙碱排泄过程存在明显的肝肠循环,血药浓度反复升高,对机体毒害作用持久。文献报道秋水仙碱的致死量为0.8 mg/kg,但国内外均有文献报道低于上述剂量的致死病例,尤其是庄耘等[3]报道1例口服秋水仙碱5 mg(<0.1 mg/kg)即死亡的患者。本例患者口服剂量为1.2 mg/kg,远超文献报道的致死量。
秋水仙碱在体内代谢成毒性更强的二秋水仙碱,阻止细胞有丝分裂,尤其在细胞分裂旺盛的胃肠道、骨髓等表现明显。秋水仙碱中毒的早期临床表现为呕吐、腹泻、腹痛等胃肠道症状,易合并水电解质紊乱,随着疾病进展出现手足麻木、肌肉酸痛无力、上行性神经麻痹等,引起呼吸衰竭、休克,甚至多脏器功能不全,血液系统则表现为急性期WBC升高之后,迅速出现PLT、WBC减少,若能渡过抑制期,骨髓造血功能可恢复,还有心悸、发热、少尿、血尿等临床症状。此患者入院后持续发热,最高体温为39.1 ℃,且对临床常用的物理、药物等降温措施效果不理想。
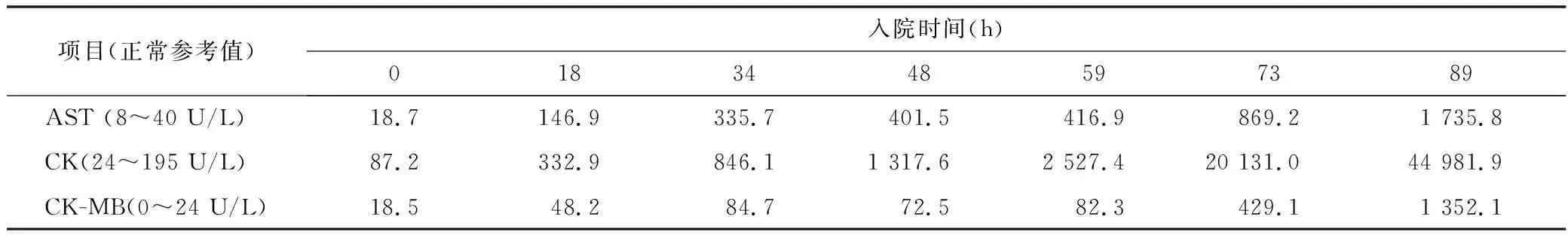
表1 AST、CK、CK-MB演变趋势
口服秋水仙碱中毒临床上可分为3个连续且通常重叠的阶段[4]:第一阶段为服药1 d内,表现为消化道症状及外周血WBC增高;第二阶段为服药2~3 d,多发生严重的并发症,包括休克、呼吸衰竭、骨髓抑制、神经肌肉损害、肝肾功能受损等,多数患者死于此阶段,一般持续5~7 d;7~10 d后进入第三阶段,即恢复阶段,特点为WBC升高和脱发。本例患者服毒后1 h出现明显呕吐、腹泻等消化道症状,5 h体温升高,18 h WBC显著升高,24 h出现休克及全身肌肉疼痛、胸闷等神经肌肉损害,48 h出现PLT减少等骨髓抑制,56 h呼吸费力、胸闷明显。本例患者症状典型,存在休克、呼吸衰竭、骨髓抑制、肌肉损害、肝肾功能受损等多器官功能不全,临床演变符合疾病自然进程。
2.2 口服秋水仙碱治疗的思考
2.2.1 关于胃肠道洗消:对经口服毒的患者,清理胃肠道内未被吸收的毒物是减轻临床症状、挽救生命的重要措施。一般认为在服毒6 h内清理胃肠道,患者能从中获益,且时间越早获益越大。宋牡丹等[5]报道2例秋水仙碱中毒的患者,口服剂量相近0.55 mg/kg、0.5 mg/kg,分别于服药后3 h、6 h进行洗胃治疗,虽然2例患者最终均死亡,但3 h洗胃病例的存活时间明显长于6 h洗胃的病例,提示患者可从早期洗胃中获益。对服毒时间短尤其是1~2 h的患者,推荐使用5%碳酸氢钠溶液或0.5%活性炭混悬液洗胃。氧化剂可将秋水仙碱氧化成毒性更强的二秋水仙碱,故应避免使用高锰酸钾等洗胃。对于服毒超过6 h的患者,虽然洗胃治疗的临床获益降低,仍应进行洗胃,尤其是口服多种药物或掺杂了抑制胃肠动力的药物,如镇静安眠药。秋水仙碱中毒后腹泻症状明显,是否进行导泻治疗出现了不同。
孙玉霞等[6]使用乳果糖口服液对1例服药剂量为1.19 mg/kg的秋水仙碱中毒患者进行导泻治疗,取得了理想的效果。蒋启鑫等[7]使用大黄泡水液导泻成功救治了1例服药剂量为1.04 mg/kg的秋水仙碱中毒患者。而更多的学者未对住院患者进行导泻治疗。秋水仙碱中毒无特效解毒剂、后果严重,应积极清理毒物,进行导泻治疗是可取的。本例患者就诊时已出现明显的呕吐、腹泻等胃肠道症状,为清除肠道内未被吸收的药物,洗胃后给予甘露醇药用炭进行全胃肠洗消,入院后多次间断口服少量活性炭减少肝肠循环,促进毒物排出。有多名学者在秋水仙碱中毒患者中观察到麻痹性肠梗阻,因此在使用导泻剂、活性炭时应严密观察患者腹部体征[6-7]。秋水仙碱中毒后出现的呕吐、腹泻、发热等症状及治疗时的洗胃导泻等操作易导致机体内环境紊乱。因此在治疗上应维持酸碱度平衡、做好容量管理及纠正电解质紊乱,稳定患者生命体征及内环境,防止并发症出现。
2.2.2 血液净化:秋水仙碱口服后在胃肠道迅速吸收,30~120 min达血药浓度高峰,扩散至全身各组织,但红细胞内的药物浓度比血浆高5~10倍。体外实验表明,活性炭对秋水仙碱具有很强的清除作用,但多数学者认为秋水仙碱表观分布容积大,血液灌流和血液透析对清除体内毒物无明显作用。秋水仙碱中毒后导致肝、肾、肌肉等组织器官损害,多种细胞因子和炎性递质含量异常升高,结合秋水仙碱在红细胞内浓集的特点,对此类患者应尽早行全血置换,同时联合血液滤过、血浆置换等以清除毒物,稳定内环境,减轻组织器官损伤。于汝等[8]对于1例口服37.5 mg秋水仙碱5 h的患者进行10 h的CRRT和1次血浆置换,成功解除了秋水仙碱对骨髓的抑制。
2.2.3 糖皮质激素:张飞等[9]使用甲泼尼龙成功救治1例口服剂量0.818 mg/kg的秋水仙碱中毒患者。杜文秀等[10]也使用甲泼尼龙成功治疗1例口服秋水仙碱0.5 mg/kg的患者。两位学者总结经验时,均认为在疾病早期给予激素治疗是成功救治的关键。
张飞等[9]分析糖皮质激素治疗秋水仙碱中毒的可能机制:(1)糖皮质激素能对抗炎性反应,稳定溶酶体膜,减轻组织细胞损害;(2)可增强心肌收缩力、增加心排量、扩张痉挛血管、增加肾血流;(3)刺激骨髓造血功能,使红细胞、PLT增多。本例患者早期使用甲泼尼龙500 mg静脉滴注每天1次效果不明显,可能与服毒量过大、就诊时间较晚有关。
2.3 关于骨髓抑制及月经 秋水仙碱显著抑制中毒患者的骨髓系统。图2、3、4分别为本例患者外周血WBC、Hb、PLT随时间变化的情况,由图可知WBC在中毒急性期短暂升高后迅速下降,PLT、Hb进行性下降,且PLT下降速率更显著,这些改变与骨髓穿刺[11]的结果相符:骨髓增生不良、粒系核右移、红系增生下降、未见巨核细胞。
杜忠彩等[12]、蒋启鑫等[7]采用粒细胞刺激因子和积极的成分输血分别成功救治服毒量为1.2 mg/kg、 1.04 mg/kg的2例患者。本例患者在WBC 12.14×109/L,PLT 75×109/L即给予重组人血小板生成素、重组人粒细胞刺激因子,未能阻止WBC、PLT进行性下降,住院期间输注新鲜冰冻血浆800 ml,冷沉淀10 U ,去白悬浮红细胞2 U,亦未能阻止病情恶化。考虑与干预时机相对较晚有关。因此,当患者WBC出现峰值后下降时,及早给予血小板刺激因子、粒细胞刺激因子,适当放宽输血指征,积极成分输血,可能有助于改善预后。对于女性患者应详细询问月经周期情况,可能在服毒10 d内月经来潮的应采取措施推迟月经,以避免血液成分丢失。本患者服毒日即月经来潮,无有效干预方法,部分血液经此丢失,也是疾病加重的一个因素。
2.4 机械通气 罗慧敏等[13]报道了1例连续8 d(每天服用2 mg)服用秋水仙碱致四肢乏力、肌肉压痛、肌酶谱显著升高的以肌病为主要表现的秋水仙碱中毒患者。蒋启鑫等[7]成功救治1例秋水仙碱中毒(剂量1.04 mg/kg)后出现严重全心舒张功能障碍的患者,陆丽丽等[14]在1例秋水仙碱(剂量0.81 mg/kg)中毒患者中发现其左室心肌运动普遍减弱,心脏射血分数明显减低,为26%。
由此可见,秋水仙碱不仅损害骨骼肌,心肌损伤也很明显。如表1所示,本例患者的AST、CK、CK-MB进行性升高,提示肌肉损伤明显。本例患者服毒24 h即出现全身肌肉疼痛、胸闷,肌酶谱、BNP显著升高,虽此时无二氧化碳潴留,也无低氧血症,为保护呼吸肌及心肌,缓解症状,建议早期有创机械通气,直至服毒后56 h患者胸闷明显加重,呼吸费力,家属才勉强同意无创通气;患者呼吸肌心肌得不到支持保护是导致预后不良的又一重要因素。
2.5 死亡原因 本例患者由于摄入秋水仙碱剂量过大,且就医时机晚,失去了最佳抢救时机,是预后不良的主要原因。患者家属配合程度差,也是导致患者死亡的重要原因。服毒后月经来潮造成一定程度的血液丢失也是一个因素。
综上所述,秋水仙碱中毒无特效解毒药及有效的救治手段,一旦发生,预后极差。在临床使用及市场流通过程中,应加强对该药物的管制,对于必须使用的患者需加强教育,使其了解秋水仙碱过量或中毒的临床表现,一旦中毒及时就医,积极救治。
利益冲突:所有作者声明无利益冲突。
