不同溶栓时间窗rt-PA治疗急性缺血性脑卒中后神经血管功能的变化特征
2023-03-22何肖君戴雅玲李钻芳陈乐文林华伟贾微微杨敏光梁胜祥柳维林陶静
何肖君 戴雅玲 李钻芳 陈乐文 林华伟 贾微微 杨敏光 梁胜祥 柳维林 陶静
(福建中医药大学 1康复医学院,福州 福建 350122;2康复产业研究院)
缺血性脑卒中也称脑梗死,是临床最常见的脑卒中类型,由于脑血管某一分支发生较长时间或永久性堵塞,导致脑组织持续性缺血、缺氧而发生坏死、软化,引起局灶性神经功能缺损或永久性丧失〔1〕。脑卒中导致全球范围内每年616.73万人死亡〔2〕,中国每年新增250万脑卒中病例,年龄标化后患病率为1.12%,运动功能障碍高达70%~80%〔3〕。脑卒中后患者功能障碍严重影响其生活质量,急性发作期间及时有效治疗与预后功能密切相关。溶栓治疗被认为是迄今为止最有效的治疗手段,1996年美国FDA批准重组化织型纤溶酶原激活剂(rt-PA)用于脑卒中发病后3 h内静脉溶栓的药物,其通过溶解血管梗死的血栓从而恢复缺血脑组织的血液供应,并促进神经功能恢复〔4〕。但是受限于狭窄的治疗时间窗,只有3%~5%的患者接受溶栓治疗〔5〕。颅内出血是溶栓治疗最常见的并发症,超时间窗静脉溶栓治疗易造成缺血再灌注损伤和神经毒性〔6〕。2008年欧洲合作组急性脑卒中研究(ECASS)-Ⅲ试验明确,急性缺血性脑卒中静脉溶栓治疗时间窗扩展至4.5 h〔7〕,2016年发表的ECASS-Ⅳ试验研究发现运用磁共振灌注成像(PWI)结合磁共振弥散加权成像(DWI)筛选缺血半暗带不匹配患者,4.5~9.0 h静脉溶栓组较安慰剂组可有效提高血管再通率和改善神经功能,提示rt-PA静脉溶栓时间窗有望延长〔8〕。2019年《新英格兰医学杂志》临床研究表明,脑卒中发生后4.5~9.0 h或者带着脑卒中症状醒来时(脑卒中发生时间不明)在磁共振成像(MRI)灌注成像引导下开始rt-PA静脉溶栓治疗对患者有益〔9〕。
本研究开展rt-PA静脉治疗不同时间窗的临床前实验,从神经血管功能的角度揭示rt-PA在不同时间窗的病理学特征。
1 材料与方法
1.1实验动物 8周龄SPF级健康雄性C57BL/6J小鼠,购自上海斯莱克实验动物责任有限公司〔SCXK(沪)2012-0002〕,体重22~26 g。由福建中医药大学实验动物中心饲养,模拟标准日夜系统,自由摄食饮水。
实验过程所有动物的处理均严格按照实验动物使用指南进行。
1.2主要实验试剂和仪器 7.0 T小动物磁共振仪(德国布鲁克公司);阿替普酶溶栓药(德国勃林格殷格翰公司);激光散斑血流仪(瑞典帕瑞医学公司)。
1.3小鼠缺血再灌注模型 采用改良线栓法〔9〕制备小鼠缺血再灌注模型:小鼠异氟烷全麻后,仰卧固定于37℃手术台上,小心剃去颈部正中毛发,碘伏酒精分别消毒颈部皮肤,颈部正中纵向切开长约1.5 cm,暴露左侧颈总动脉(CCA)、颈内动脉(ICA)及颈外动脉(ECA)。首先分离CCA于其上挂线1;然后分离ECA血管及其分支,在其头尾端挂上线2和3;分离ECA与ICA分支,于ICA穿线4。在ECA上距分叉1.0~1.5 mm用显微剪剪一切口,将标记好的线栓由此切口插入CCA中,剪断ECA远心端的血管,将线栓从CCA拔出至分叉稍尾侧,右手将线栓转向滑入ICA,插入深度1 cm左右,到达大脑中动脉与前交通之间。最后将线3打紧以固定线栓,松开线1。待缺血60 min后,缓慢拔出线栓,术后缝合切口。术中和术后保持室温25℃左右,使其体温维持在(37±1)℃,直到恢复活动。手术结束后,动物放置于室温25℃环境下苏醒,正常饮食。
1.4分组与给药 在动物模型制备完成后将小鼠随机分为3组,每组6只。①缺血性脑卒中模型组:在缺血再灌注后不予药物治疗;②rt-PA治疗4.5 h给药组:在缺血再灌注后4.5 h尾静脉注射rt-PA(0.9 mg/kg);③rt-PA治疗9.0 h给药组:在缺血再灌注后9.0 h尾静脉注射rt-PA(0.9 mg/kg)。
1.5神经功能缺损评估 每组小鼠在注射rt-PA 30 min后进行改良神经功能缺损评分(mNSS)。mNSS主要包括:运动、感觉、平衡和反射4个方面评估,正常得0分,每得1分代表无法完成测试或者无反射活动,总分为18分。
1.6脑血流量测定 每组在注射rt-PA 1 h后,采用激光散斑成像系统监测小鼠脑血流量,小鼠异氟烷全麻后固定于脑立体定位仪上,剃去小鼠头部的毛后,从头部正中沿矢状缝剪开头皮和筋膜,将镜头光纤固定于小鼠头颅上方约11 cm处,设置采样频率5帧/s,获取640×480像素图像,然后通过系统将原始散斑图转化成血流图。计算梗死侧脑血流量(ΔCBF)=〔右侧感兴趣区脑血流(RrCBF)-左侧感兴趣区脑血流(LrCBF)〕/RrCBF。
1.7H-MRS检测 在注射rt-PA 18 h后使用7.0 T小动物磁共振扫描仪进行小鼠脑部扫描,小鼠经3%异氟烷麻醉后置于立体支架上,扫描期间用1.5%异氟烷持续麻醉,利用水循环加热系统使小鼠体温保持在37℃左右,并实时监控呼吸频率。先行常规定位扫描,而后进行T2加权扫描(T2WI),扫描参数重复时间(TR)=4 200 ms,回波时间(TE)=35 ms,最后基于T2WI图像选取梗死侧初级运动皮层为感兴趣区域进行波谱扫描。扫描面积为1.5×1.5×1.5 mm3,匀场、压水,使其半高峰宽值低于20 Hz,后选择点分辨波谱脉冲序列(PRESS)进行数据采集,扫描参数TR=1 500 ms,TE=144 ms。最后通过Topspin3.0软件计算出各代谢产物峰下面积,以肌酸浓度值作为参照标准,各代谢产物峰下面积与Cr比值即为代谢物浓度。
1.8尼氏染色 各组小鼠在注射rt-PA 24 h后进行灌注取脑,制备5 μm冠状切片。经二甲苯脱蜡,梯度酒精脱水后按照尼氏染色试剂盒进行操作。首先在脑片上滴加尼氏染色试剂A,置于56℃水浴箱孵育1 h;用磷酸盐缓冲液(PBS)将脑片上试剂洗去,滴加试剂B分化10 s,在显微镜下观察背景接近无色为止。纯水洗5 min后晾干,中性树脂封片,光学显微镜下拍片成像。
1.9免疫组化 组织切片后用柠檬酸钠进行组织抗原修复,滴加50 μl过氧化酶阻断溶液,室温下孵育10 min,PBS冲洗3次;滴加 50 μl正常非免疫动物血清,室温下孵育10 min;滴加50 μl一抗血管内皮生长因子受体VEGFR-1+VEGFR-2 (1∶300),4℃过夜;室温下复温30 min,PBS冲洗3次;每张切片滴加50 μl二抗,室温孵育10 min,PBS冲洗3次;滴加50 μl链霉菌抗生物素-过氧化物酶溶液,室温下孵育10 min,PBS冲洗3次;滴加新鲜配制的DAB 显色剂,室温孵育10 s,自来水冲洗,苏木素复染10 s,自来水冲洗返蓝后封片。
1.10统计学方法 采用SPSS25.0软件进行方差分析,两两比较采用LSD法。
2 结 果
2.1不同时间窗rt-PA给药治疗急性缺血性脑卒中对血管功能的影响 结果显示,与模型组ΔCBF/%〔(31.42±4.24)%〕比较,rt-PA治疗4.5 h给药组ΔCBF/%〔(25.23±4.63)%〕明显上升(P<0.05),rt-PA治疗9.0 h给药组ΔCBF〔(32.68±4.12)%〕差异无统计学意义(P>0.05);与rt-PA治疗9.0 h给药组比较,rt-PA治疗4.5 h给药组ΔCBF有显著改善P<0.001)。见图1。
梗死侧初级运动皮层VEGFR表达情况,免疫组化染色结果表明,模型组和rt-PA治疗9.0 h给药组可见少量VEGFR-1和VEGFR-2表达阳性细胞;rt-PA治疗4.5 h给药组免疫阳性细胞数量增多。见图2。
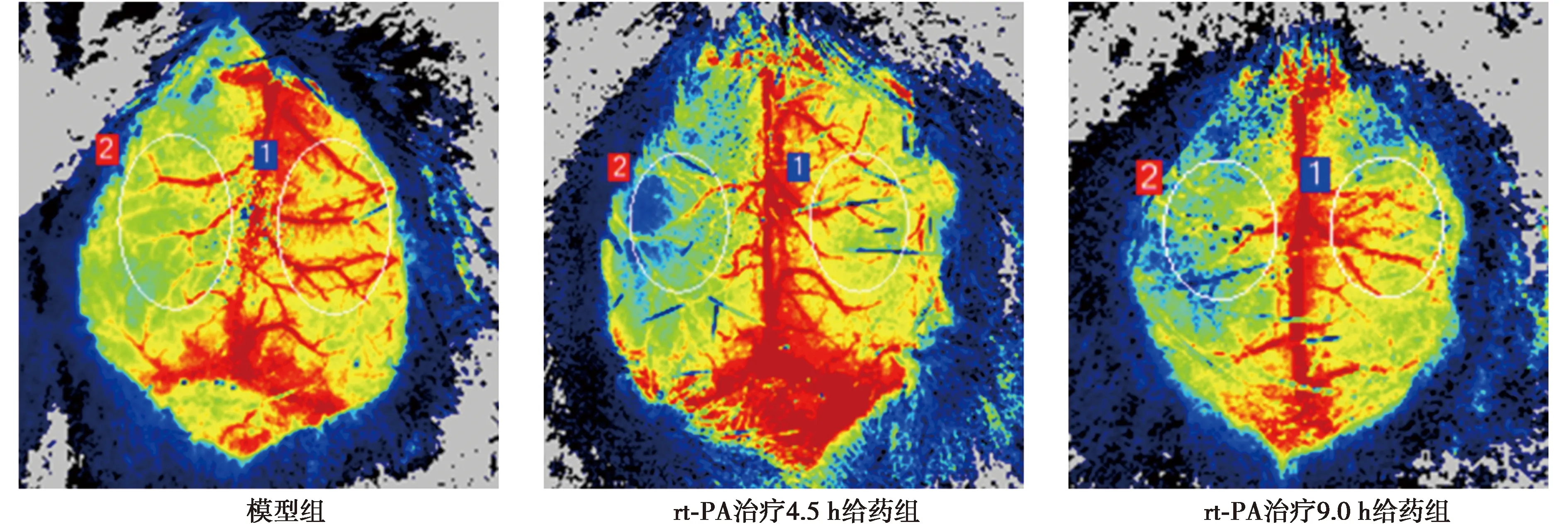
图1 激光散斑成像系统监测各组脑血流量变化
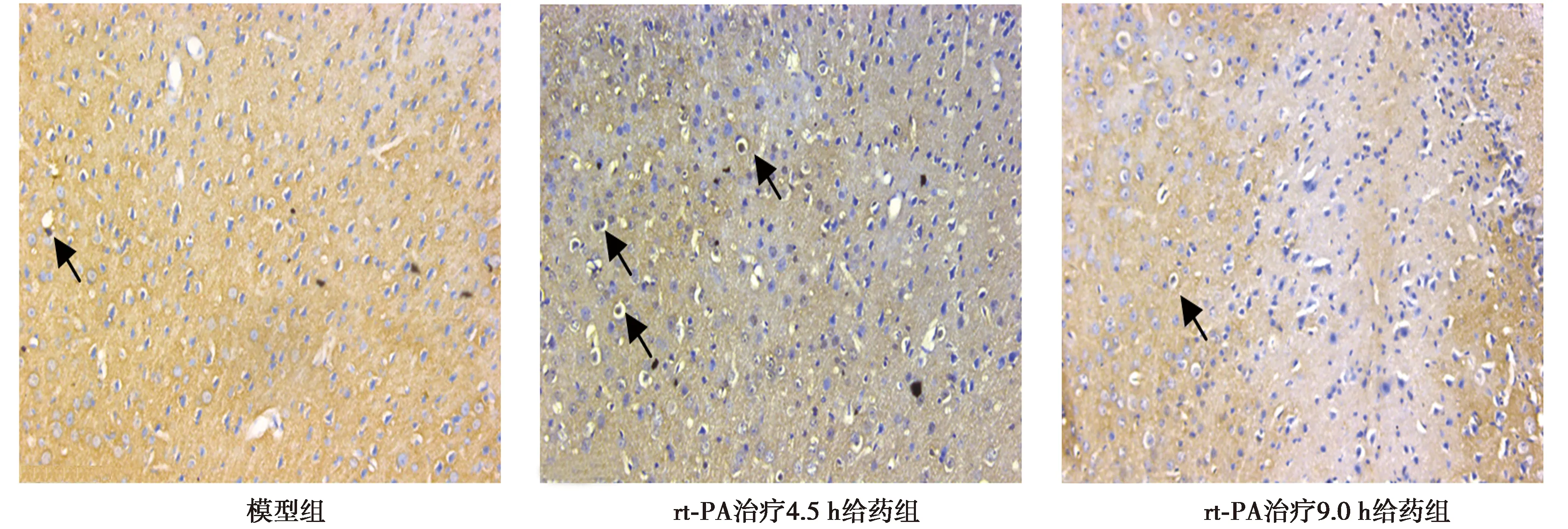
图2 免疫组化法标记各组VEGFR-1+VEGFR-2阳性细胞数量(×200)
2.2不同时间窗rt-PA给药治疗急性缺血性脑卒中对神经功能的影响
2.2.1梗死侧初级运动皮层神经元形态的变化 模型组iM1脑区神经元出现空泡样变性;rt-PA治疗4.5 h给药组iM1脑区神经元排列相对整齐致密,胞体较大,尼氏体也较丰富;rt-PA治疗9.0 h给药组iM1脑区组织结构松散,神经细胞萎缩,核固缩。见图3。
图3 尼氏染色观察各组神经元形态(×200)
2.2.2梗死侧初级运动皮层神经代谢物质Cho、NAA相对含量比较 rt-PA治疗4.5 h给药组的Cho相对含量较模型组和rt-PA治疗9.0 h给药组显著升高(P<0.001),rt-PA治疗4.5 h给药组NAA相对含量较模型组、rt-PA治疗9.0 h给药组明显升高(P<0.05,P<0.001)。见表1,图4、5。
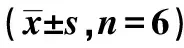
表1 各组梗死侧M1区神经代谢物质Cho、NAA相对 含量比较
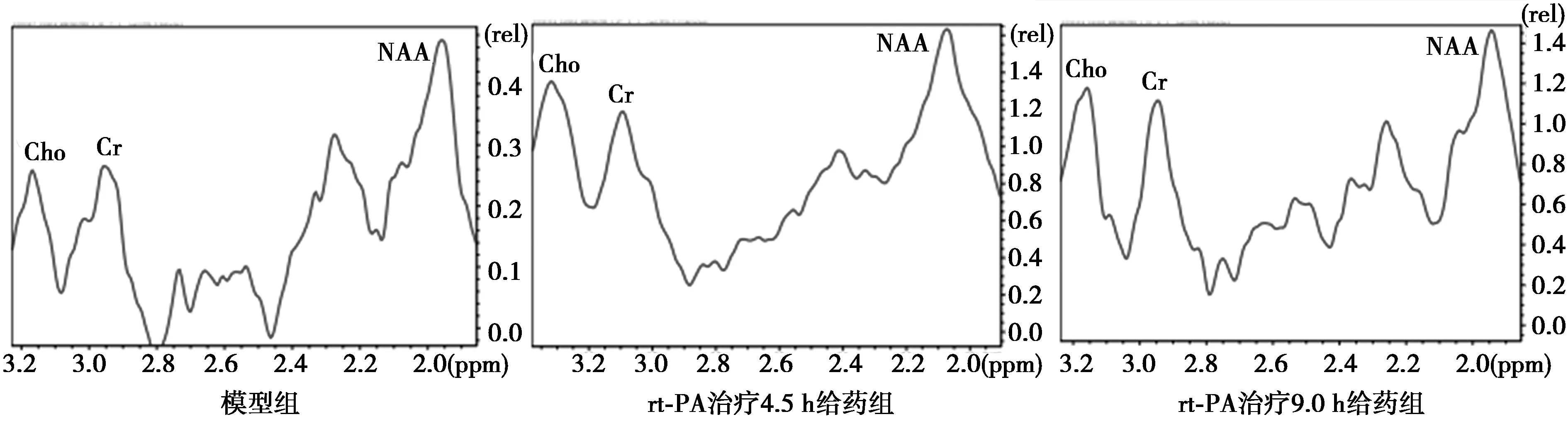
图4 磁共振波谱成像峰值图
2.3不同时间窗rt-PA给药治疗急性缺血性脑卒中对mNSS的影响 模型组mNSS(5.50±1.38)分、rt-PA治疗4.5 h给药组(6.00±1.41)分和rt-PA治疗9.0 h给药组(6.33±2.34)分,3组mNSS差异无统计学意义(F=0.338,P>0.05)。
3 讨 论
缺血性脑卒中指脑供血突然中断,导致脑组织因缺血缺氧造成不可逆神经元坏死,而在梗死周边区存在缺血程度较轻的潜在可逆性损伤区域为缺血半暗带,尽快恢复缺血半暗带血供对减轻脑组织的损伤至关重要〔10〕。临床研究表明,单独的神经保护治疗不足以恢复血流灌注和保护血管完整性〔11〕。2002年NINDS提出了“神经血管单元”这一脑卒中治疗的概念模型,神经血管单元是一个功能上和结构上相互依存的多细胞复合物,包括内皮细胞、基底膜、周细胞、星形胶质细胞和神经元等〔12〕。已有研究表明,神经血管单元是脑卒中后分子事件的靶标,并参与脑卒中病理机制发生〔13〕。
VEGF具有促进血管内皮细胞增殖作用,其在生理状态下,仅在血管内皮细胞有低水平表达。脑梗死后梗死灶和缺血半暗带的VEGF表达增加,可促进血管新生形成〔14〕。VEGFR是VEGF特异性的膜受体,其中VEGFR-1和VEGFR-2主要在血管内皮细胞中表达,是血管新生标志物〔15,16〕。在缺血后数小时至数天内,VEGFR-1和VEGFR-2蛋白在海马和皮质神经元表达增加〔17〕。研究表明,缺血可上调星型胶质细胞的VEGF及其受体的表达,促进脑损伤后的神经可塑性〔18〕。在缺血急性期运用VEGF可以减少脑梗死面积和促进神经元再生〔19〕。对缺血性梗死动物模型在脑梗死后3 h给予rt-PA溶栓治疗,其梗死周边区VEGF和突触素表达增加,促进神经血管重塑〔20〕。进一步发现,rt-PA通过激活ERK2/p38信号通路,上调血管内皮细胞VEGF的表达〔21〕。另有研究表明,脑中动脉缺血模型(MCAO)大鼠在梗死后4 h以上,10 mg/kg tPA对其失去了效力,反而增加了梗死体积及加重出血性转化〔22〕。
大脑皮层神经元需要持续的氧供和摄取葡萄糖来满足它们的代谢需求,因此皮层神经元的存活依赖于感知和适应低氧和低葡萄糖浓度的机制激活〔23〕。磁共振波谱(MRS)通过检测脑缺血后的代谢产物反映脑缺血损伤的严重程度。NAA仅存在于神经元和神经轴突内,NAA的降低反映神经元的丢失和损伤,可预测脑卒中神经功能结局;Cho主要包括甘油磷酸胆碱、磷酸胆碱和胆碱等,是神经递质乙酰胆碱的前体分子,参与神经细胞膜构成,神经元数量增多可表现为Cho峰值增高〔24〕。运用MRS观察MCAO 模型小鼠在术后3、8、24 h的脑代谢物质变化,发现NAA含量呈下降趋势,表明脑缺血造成神经元损伤〔25〕。有研究表明,tMCAO模型小鼠自身可释放内源性tPA或运用重组组织型tPA治疗,通过激活神经元中mTOR细胞信号传导途径增加对葡萄糖摄取利用,起到保护神经元作用〔26〕。但是,rt-PA同时具有神经毒性作用,主要取决于治疗时间、剂量、神经元类型等因素〔27〕。
有研究对MCAO模型大鼠在脑梗死后2、6 h两个时间点给予rt-PA治疗,发现2 h给药组较模型组脑梗死面积显著减小,而6 h给药组约50%大鼠出现出血性转化,并伴随着多形核白细胞的累积产生神经毒性作用〔22〕。此外,对MCAO模型大鼠在梗死后5 h以10 mg/kg剂量给予rt-PA,治疗组较安慰剂组具有神经血管保护作用〔28〕。本研究结果与以上研究基本相符。而本实验结果可能与既往研究报道的神经症状发生3 h后静脉注射rt-PA,神经功能的改善作用不能即刻体现有关〔29〕,未来研究应延长评估神经功能的时间,以更全面观察溶栓疗效。
溶栓时间窗是脑卒中患者的生命窗,近来已有许多研究着力于rt-PA联合其他治疗方式来延长溶栓时间窗,以为更多患者争取治疗时机。有研究在缺血性脑卒中大鼠梗死后6 h运用rt-PA溶栓治疗联合脑梗死后30 min神经保护药物2-BFI,结果表明联合治疗下调促凋亡蛋白B细胞淋巴瘤(Bcl)-2相关X蛋白(Bax)表达和上调抗凋亡蛋白Bcl-2表达,并且减少脑梗死面积,减轻神经功能缺损,保护神经血管单元完整性〔30〕。此外,也可通过联合其他药物,如他克莫司〔31〕和溴抑他汀〔32〕等,可抑制基质金属蛋白酶激活,保护微血管内皮细胞完整性以降低血脑屏障通透性,减轻出血转化,延长溶栓时间窗至6 h。因此,要延长rt-PA溶栓时间窗还需要联合其他神经血管单元保护药物。
