miR-7-5P在口腔鳞癌中表达及其调控CDK-10信号通路对细胞增殖、凋亡与周期的影响
2023-03-22刘倩峰杨佩璇庞超李庆星周金阔
刘倩峰 杨佩璇 庞超 李庆星 周金阔
(河北医科大学第一医院 1口腔科,河北 石家庄 050031;2病理科)
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤。手术是OSCC患者的一线治疗方法。然而,外科治疗使患者出现严重的口腔功能障碍,导致吞咽困难和构音困难〔1〕。因此,OSCC探索早期诊断和治疗方法成为近年来研究的重要方向。研究发现,一些肿瘤基因和抑癌基因可能在促进或启动OSCC的发展中起着关键作用〔2〕。因此,阐明基因组和表观基因组参与多步骤癌变和OSCC进展的机制具有重要意义。MicroRNA-7-5P(miR-7-5p) 由具有发夹结构的单链前体RNA-7-5P经过Dicer酶加工后生成〔3〕,其在OSCC中的研究较少,研究表明miR-7在癌细胞中会发生启动子甲基化〔4〕。也有研究提出miR-7的异常表达参与了舌鳞状细胞癌的增殖和凋亡〔5〕。但这些研究证据尚不充足,尤其是miR-7-5p在OSCC中的作用,有待进一步探究。
周期素依赖性激酶(CDK)-10,是细胞分裂周期蛋白(Cdc)2激酶家族的一员,在细胞周期从G2期向M期发展过程中起重要作用〔6〕。研究发现CDK-10在多种肿瘤组织中的表达升高,提示CDK-10是一种抑癌基因〔7〕,然而,CDK-10在OSCC中表达模式及miR-7-5p对CDK-10调控作用尚不清楚。本研究重点探索miR-7-5p在OSCC中的表达及其调控CDK-10对细胞增殖、凋亡与周期影响。
1 资料与方法
1.1临床标本 收集河北医科大学第一医院病理科68例OSCC患者的OSCC样本组织和匹配的邻近组织(距肿瘤边缘至少2 cm)。OSCC患者术前均未接受放疗或化疗。另收集临床健康志愿者50例,获取OSCC患者术前及健康志愿者的空腹血清样本。样本均由病理学专家验证,立即在液氮中冷冻。本研究获得医院伦理审查委员会批准,所有患者知情同意。
1.2血清miR-7-5p和CDK-10蛋白表达检测 采用RT-qPCR分析血清miR-7-5p表达,酶联免疫吸附试验(ELISA)分析血清CDK-10蛋白表达。RNA分离与RT-qPCR分析,用QIAzol试剂(德国Duesseldorf,Qiagen)提取总RNA,用cDNA逆转录试剂盒(文氏酵母,Waltham,MA)合成cDNA。按商品说明书,使用SYBR-绿色PCR试剂盒(Invitrogen,Carlsbad,CA)进行RT-qPCR。U6 snRNA用于miR-7-5p的正常对照,GAPDH用于OXR1 mRNA的正常对照。ELISA检测CDK-10蛋白参照试剂盒说明书进行。
1.3细胞系与细胞培养 OSCC细胞株SCC-25细胞在含10%胎牛血清(FBS)的DMEM中培养。收集对数期细胞,接种于6孔板(1×10/孔)中。当细胞达到80%汇合时,按照制造商的程序,使用脂质体2000(Invitrogen)将miR-7-5p-模拟物(mimics)(100 nmol/L)、miR-7-5p-抑制剂(inhibitor,100 nmol/L)和空白质粒(100 nmol/L)转染细胞,分别作为miR-7-5p过表达组、miR-7-5p抑制组、空白对照组,转染48 h后取细胞。
1.4Western印迹分析 用细胞裂解试剂(Sigma-Aldrich,St.Louis,MO)裂解细胞,提取总蛋白。蛋白质浓度用Bradford法测定。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶分离蛋白质,并将其电转移到聚偏氟乙烯(PVDF)膜(GE Healthcare,Little Chalfont,Buckinghamshire,UK)上,在5%脱脂牛奶中室温孵育1.5 h。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)3/8/9抗体,CDK-10抗体、B淋巴细胞瘤-2基因(Bcl-2)相关X蛋白(Bax)抗体、Bcl-2抗体和GAPDH(Sigma-Aldrich,目录号:SAB2701826)在1∶1 000稀释,然后在4℃下与膜一起孵育过夜。第2天将辣根过氧化物酶(HPR)-结合的二级抗体添加到膜中并孵育1 h。使用融合SL成像系统(Viber Lourmat,法国)显色,以GAPDH为内对照。胶片拍照,用凝胶图像处理系统分析目标带的光密度(OD)值。
1.5双荧光素酶报告分析 miR-7-5p和CDK-10的结合位点使用网站http://www.Target Scan.org预测,利用PmiRGLO双荧光素酶miRNA靶向表达载体(E1330;Promega,Madison,WI)构建miR-7-5p-CDK-10报告基因。分为空白对照组(转染miR-7-5p NC)和miR-7-5p过表达组(转染miR-7-5p mimics),用Lipidosome2000(Invitrogen)共转染HEK293T细胞用双荧光素酶报告系统(Promega)测定荧光素酶活性。
1.6MTT法和乳酸脱氢酶(LDH)活性检测 细胞转染48 h后,收集的细胞种在96孔板(2×10个/孔)。向每个孔中加入20 μl 5 g/L MTT溶液(Sigma,Saint Louis,MO),孵育4 h,然后加入150 μl二甲基亚砜(DMSO),再孵育15 min。在570 nm波长处测量光吸收率。细胞转染48 h后,收集的细胞种在96孔板(2×10个/孔)。根据试剂和说明书,检测LDH活性,在450 nm波长处测量光吸收率。
1.7免疫组化 取OSCC组织切片和癌旁组织切片进行常规二甲苯脱蜡,经各级浓度乙醇水化。取一定量pH6.0柠檬酸盐缓冲液(北京中杉金桥生物技术有限公司),加入微波盒中,医用微波炉中火加热切片3 min×2次进行抗原修复,凉至室温40 min。每张切片加1滴3%过氧化氢(H2O2),室温下孵育10 min。加1滴稀释倍数为1∶100的第一抗体(抗CDK-10突变单克隆兔抗体,美国Cell Signaling Technology公司),4℃冰箱过夜。而后加HPR标记的第二抗体(北京中杉金桥生物技术有限公司),37℃温箱30~40 min。每张切片加1滴新鲜配制的二氨基联苯胺(DAB)液显色20 min,用淡苏木素复染细胞核30 s,各级浓度乙醇快速脱水,二甲苯透明,中性树脂封片,晾干后观察。
1.8统计学方法 采用SPSS21.0软件进行t检验、χ2检验、Spearman相关性分析。
2 结 果
2.1miR-7-5p和CDK-10在OSCC患者中的表达量 与正常志愿者血清比较,OSCC患者血清中miR-7-5p表达量显著下降,CDK-10表达量显著升高(P<0.05)。见表1。CDK-10在OSCC组织中细胞阳性率〔83.8%(57/68)〕明显高于癌旁组织〔8.8%(6/68)〕。见图1。OSCC患者血清中miR-7-5p与CDK-10呈负相关(r=-0.682,P<0.05)。见图2。
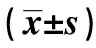
表1 miR-7-5p和CDK-10表达
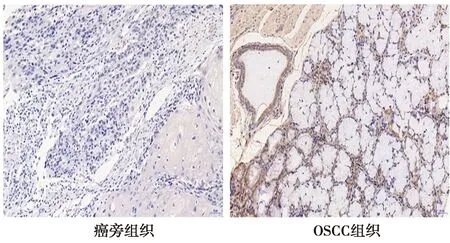
图1 免疫组化法检测OSCC组织和癌旁组织中CDK-10 表达(HE染色,阳性细胞为黄褐色或褐色,×200)
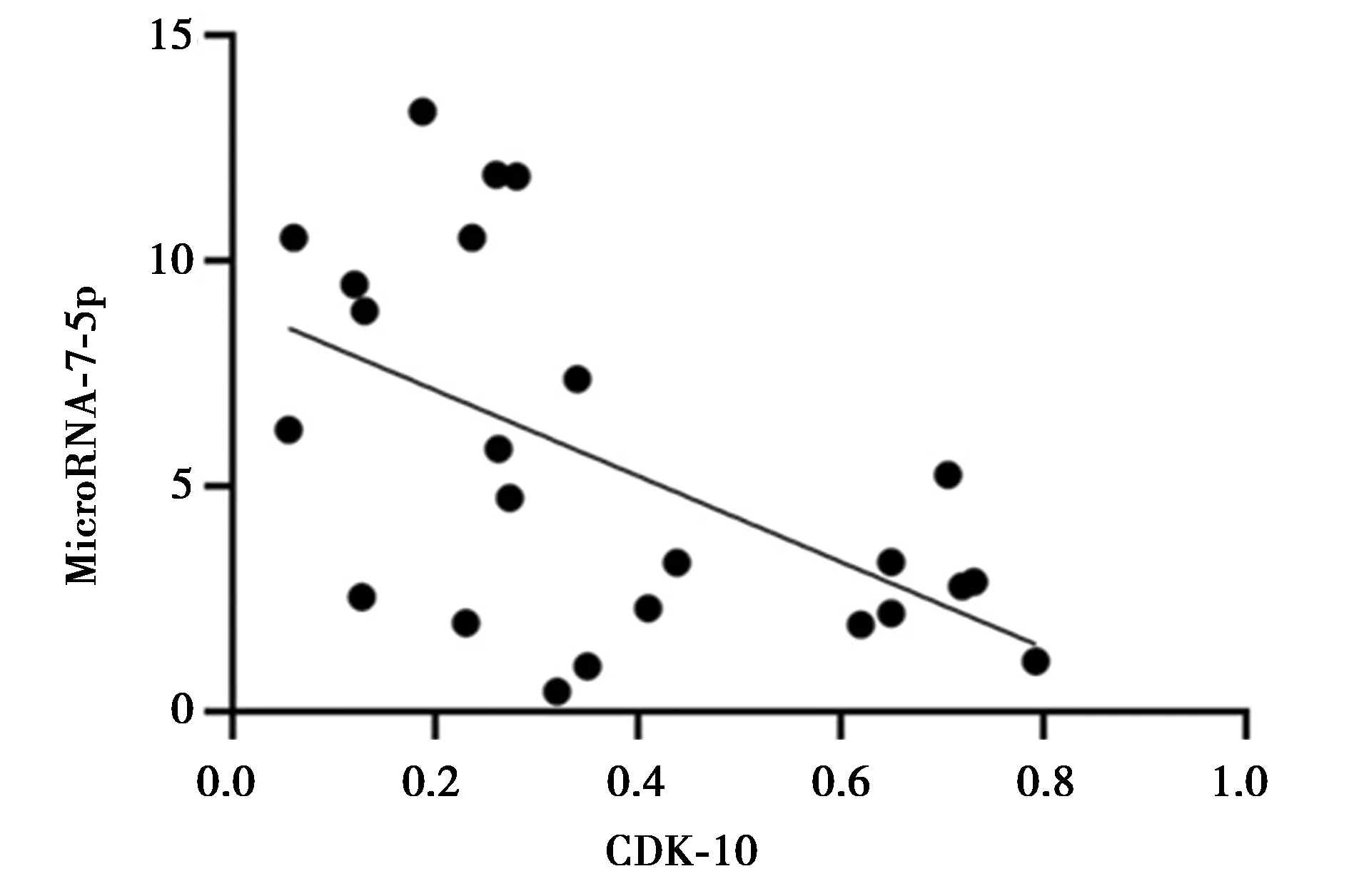
图2 OSCC患者中miR-7-5p与CDK-10呈负相关
2.2miR-7-5p调控OSCC细胞中CDK-10表达量 miR-7-5p与CDK10结合位点见图3。荧光素酶报告基因实验结果显示,与空白对照组(1.02±0.08)相比,miR-7-5p与野生型CDK10 3′UTR共转染后,检测到荧光素酶活性显著降低(0.35±0.13,P<0.01)。而与突变型CDK10 3′UTR共转染后,荧光素酶活性无明显变化(1.00±0.00 vs 0.91±0.06,P>0.05)。体外细胞实验显示,与空白对照组比较,miR-7-5p过表达组miR-7-5p显著升高,CDK-10显著降低(P<0.05)。与miR-7-5p抑制组比较,miR-7-5p过表达组miR-7-5p显著升高,CDK-10显著降低(P<0.05)。见表2。
2.3miR-7-5p调控OSCC细胞周期 与miR-7-5p抑制组比较,miR-7-5p过表达组S期、G2M期显著升高,G0/G1期显著降低(P<0.05)。见表3。
2.4miR-7-5p调控OSCC细胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平 与miR-7-5p抑制组和空白对照组比较,miR-7-5p过表达组caspase-3、8、9及Bax水平显著升高,Bcl-2、CDK-10显著降低(P<0.05)。见图4、表4。

图3 miR-7-5p与CDK-10结合位点
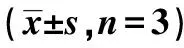
表2 miR-7-5p调控OSCC细胞中 CDK-10表达量

表3 miR-7-5p和CDK-10调控口腔鳞癌细胞 细胞周期(%,n=3)

1~3:空白对照组、miR-7-5p抑制组、miR-7-5p过表达组图4 Western印迹检测各组OSCC细胞蛋白表达
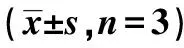
表4 miR-7-5p调控OSCC细胞caspase-3、caspase-8、caspase-9、Bax、Bcl-2和CDK-10的活性水平和光密度值
2.5MTT法和LDH活性检测miR-7-5p调控OSCC细胞 与miR-7-5p抑制组和空白对照组比较,miR-7-5p过表达组LDH水平显著升高,MTT显著降低,(P<0.05)。见表5。
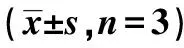
表5 MTT法和LDH活性检测结果
3 讨 论
OSCC是一种在世界范围内高度流行的癌症,转移和放化疗耐受是OSCC致死的主要原因〔8〕,研究表明,miR-7-5p异常表达可促进肿瘤发生发展,miR-7-5p是否发生启动子区域甲基化改变与侵袭性肿瘤的发生和发展有关〔9〕。CDK-10在体外和体内研究中对细胞凋亡和肿瘤发生发展密切相关,其甲基化同淋巴结转移和临床分期相关〔10〕。本研究结果显示,miR-7-5p与CDK-10结合发生结合,CDK-10是miR-7-5p口腔鳞癌重要的靶点。这与miR-7-5p在其他肿瘤中的表达趋势具有一致性;miR-7-5p可能是OSCC患者重要的靶点,其机制可能与CDK-10具有相关性。
研究表明,miRNAs可以作为肿瘤筛查、诊断和预后的生物标志物〔11〕。有研究发现,miR-7-5P的稳定过表达会伴随着DNA甲基化和组蛋白修饰。miR-7-5p甲基化的发生也与患者治疗后的进展生存期和总体生存率有关〔12〕。也有研究表明,miR-7-5p在结直肠癌的肿瘤组织和细胞中也发生高度的甲基化,miR-7-5p可能是诊断结直肠癌的标志物〔13〕。本研究中,在OSCC患者血清中miR-7-5p表达量显著下降,说明miR-7-5p在OSCC的发生中起到重要作用。miR-7-5p主要通过影响细胞周期并促进干细胞分化来调节细胞增殖〔14〕,一项研究表明,miR-7-5p通过靶向Bcl-2调节人乳头状癌细胞的增殖和转移,miR-7通过靶向Bax和Sirt2抑制帕金森病模型中神经元细胞的凋亡〔15〕。也有研究发现,miR-7-5p抑制舌鳞状细胞的增殖,迁移和侵袭〔16〕。本研究结果表明,miR-7-5p可能通过CDK-10调控细胞周期调节细胞增殖与细胞凋亡;miR-7-5p对CDK-10的调节作用,这和通过调节caspase-3及Bax/Bcl2等典型细胞凋亡因子促进细胞凋亡具有相似的作用,miR-7-5p可能是OSCC发生的重要潜在靶点。
CDK-10被证明能促进细胞增殖,具有抑癌作用〔17〕。有研究发现CDK-10在胆管肿瘤和细胞系中的表达均下调,CDK-10过表达或敲除分别抑制或促进细胞增殖、集落形成和迁移〔18〕。研究证实,基因启动子高频甲基化是造成恶性肿瘤中CDK-10表达下调的重要原因〔19〕,也有转录组学和蛋白质组学研究中发现,癌细胞或表现出加剧分裂的细胞中CDK-10的表达上调〔20〕。本研究发现miR-7-5p过表达可以减少OSCC细胞增殖和增加LDH水平,抑制miR-7-5p可以增加OSCC细胞增殖和减少LDH水平,这与miR-7-5p表达与caspase-3、8、9、Bax、Bcl-2、CDK-10之间的关系的结果具有一致性,说明,CDK-10可能是调控miR-7-5p促进OSCC细胞增殖和凋亡的重要靶点。
综上,OSCC患者血清中miR-7-5p表达量显著下降,CDK-10表达量显著升高,CDK-10可能是miR-7-5p调控OSCC细胞增殖、凋亡与周期的重要靶点。miR-7-5p有希望成为OSCC预后和诊断的评定指标。 但本研究也有一定不足,样本量较少,实验方案较为简单,统计可能存在较大误差,我们将在后续研究中继续改进和进一步探究。
