雷米普利与骨髓间充质干细胞对Ⅳ型心肾综合征的治疗效果
2023-03-22马逸群邵丽诗张娅夏春娟时琛王家平宋超王世平万珊杉
马逸群 邵丽诗 张娅 夏春娟 时琛 王家平 宋超 王世平 万珊杉
(1汉中市三二○一医院影像科,陕西 汉中 723000;2昆明医科大学第二附属医院影像科;3云南昆钢医院放射科)
心脏和肾脏疾病可通过不同的机制相互影响,在病理状态下其中一个脏器的损伤会导致另一个脏器的急性或慢性损伤,即心肾综合征(CRS)〔1,2〕。Bagshaw等〔3〕将之分为5种亚型,其中Ⅳ型(慢性CRS)是指在长期慢性肾脏疾病的基础上出现的慢性心脏损伤。CRS在全球的发病率日益提高,目前临床针对CRS主要的治疗方式为药物保守治疗,尚缺乏特异的治疗方法〔4〕。随着再生医学的发展,干细胞研究对慢性肾脏病(CKD)的治疗提供了新的思路,已有的研究表明骨髓间充质干细胞(BMSCs)可对慢性肾脏病起到有效的治疗效果,同时对CRS起到较好的改善效果〔5〕。实验表明经肾动脉移植干细胞的归巢效果优于外周静脉,本实验采用经肾动脉移植BMSCs与雷米普利灌胃对CRS大鼠的治疗效果比较,探索CRS更为有效的治疗方法。
1 材料与方法
1.1实验动物、试剂及仪器 雄性清洁级SD大鼠42只,由昆明医科大学提供。培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、青链霉素、胰蛋白酶-0.25%乙二胺四乙酸(EDTA,美国Gibco公司);雷米普利(北京赛诺菲制药有限公司);离心管、细胞培养瓶(无锡NEST公司);彩色多普勒超声诊断仪(美国GE公司);CKX41倒置相差显微镜(日本Olympus 公司);透射电子显微镜(日本Hitachi公司);CO2培养箱(美国Thermo公司)。
1.2实验方法
1.2.1BMSCs的培养 选择2只6周龄雄性SD大鼠〔体重(120±10)g〕提取BMSCs。脱颈处死,于75%乙醇中浸泡10 min,取双侧股骨置于含有PBS的培养皿中并剪断干骺端,用DMEM培养基反复冲洗骨髓腔至冲洗液变透亮;收集大鼠的细胞悬液于15 ml离心管中,1 000 r/min离心8 min,弃上清液,用PBS吹打重悬后再以1 000 r/min离心8 min后弃上清液,以10%FBS与1%青链霉素的完全培养液重悬细胞;将细胞悬液接种在塑料培养瓶中并置于37℃、5%CO2恒温培养箱中孵育。24 h后首次换液,此后每3 d换液1次。1 w后于倒置显微镜下观察BMSCs生长融合至80%~90%时按照1∶3传代。取P4-P6 BMSCs备用。
1.2.2模型的制作与分组 将32只10周龄大鼠〔体重(200±15)g〕建立慢性肾脏病模型。用10%水合氯醛(3 ml/kg)腹腔注射麻醉,按照文献所述方法〔6〕建立左侧输尿管梗阻慢性肾脏病模型,此后第8周收集尾静脉血及尿液检测肾功能,以血肌酐、血尿素氮、尿白蛋白升高表示慢性肾脏病模型构建成功。然后随机分为雷米普利治疗组(A组),BMSCs移植组(B组),雷米普利与BMSCs联合治疗组(C组),Ⅳ型CRS对照组(CRS组)各8只;剩余8只健康鼠为生理盐水对照组(N组)。
1.2.3各组的治疗方法 制备雷米普利溶液,A组8只大鼠按照5.0 mg/(kg·d)剂量灌胃。取传代至P4-P6、生长至80%~90%融合的BMSCs,用L-DMEM培养基将BMSCs制成细胞悬液后(3×106/ml)分别收集于16支1.5 ml EP管中,每支0.5 ml,于-4℃保存。B组大鼠麻醉后仰卧位固定,备皮、消毒后,用超声探头沿腹主动脉找到左肾动脉分叉处,在超声引导下以胰岛素针吸取配好的BMSCs分别经皮穿刺至左肾动脉分叉处,确定无外漏后注射BMSCs 0.5 ml,术后将大鼠送回饲养笼中单只饲养;C组在雷米普利灌胃后立即采用上述方法给与肾动脉移植BMSCs;CRS组和N组在每次操作的同时采用等量的生理盐水灌胃。
1.2.4生化指标的收集与检测 各组在治疗后第1周末将大鼠置于单只代谢笼内,收集24 h尿液并行尾静脉采血,用全自动生化仪检测血尿素氮(BUN)、血肌酐(Scr)与24 h尿蛋白。
1.2.5心脏与肾脏的病理检测 脱颈处死大鼠后取心脏和肾脏,用10%的甲醛固定后石蜡包埋,行HE染色和Masson染色,观察心脏及肾脏组织的病理结构改变。每组Masson染色结果随机选择10个视野,采用Image Pro6.0计算心肌组织中胶原容积分数(CVF)。
1.2.6心、肾细胞TUNNEL检测 用石蜡包埋的各组大鼠心、肾组织并切片,按照试剂盒说明严格操作进行细胞凋亡检测,凋亡细胞核呈棕黄色,记为阳性。
1.2.7透射电镜检测 取新鲜肾脏与心脏组织,体积约为1 mm×1 mm×1 mm,迅速放入TEM固定液中常温固定2 h,0.1 mmol/L PBS漂洗3次,每次15 min,再以1%锇酸·0.1 mol/L磷酸缓冲液室温固定2 h,使用丙酮梯度脱水后用渗透过夜并包埋,将样本插入包埋板并置于37℃烤箱过夜,再以60℃烤箱聚合48 h,采用切片机将样本切为60~80 nm切片,并用铀铅双染色,室温过夜后置于TEM下观察。
1.3统计学分析 采用SPSS18.0软件进行方差分析、LSD-t法、秩和检验。
2 结 果
2.1一般状况 各组大鼠在注射ADR后1 w左右均出现不同程度的腹泻伴食欲下降,第5周开始逐渐出现不同程度的腹水及水肿表现。建模过程中B组1只大鼠死亡、C组2只大鼠死亡,剔除后重新建模并补充实验数据。
2.2超声引导下移植BMSCs 于超声引导下沿大鼠腹主动脉下行,找到左侧肾动脉分叉处,用胰岛素针吸取BMSCs,在超声引导下经皮穿刺,针头至左肾动脉分叉处注射BMSCs。见图1。
2.3血、尿生化检测结果 A、B、C、CRS组经治疗后肾功能均有所改善,在治疗后第1周末B组与C组BUN、Scr、24 h尿白蛋白总量均明显低于CRS组(P<0.05),其中C组各检测指标相对A组下降更为明显(P<0.01),而相对于B组虽有下降但无统计学意义(P>0.05)。见表1。
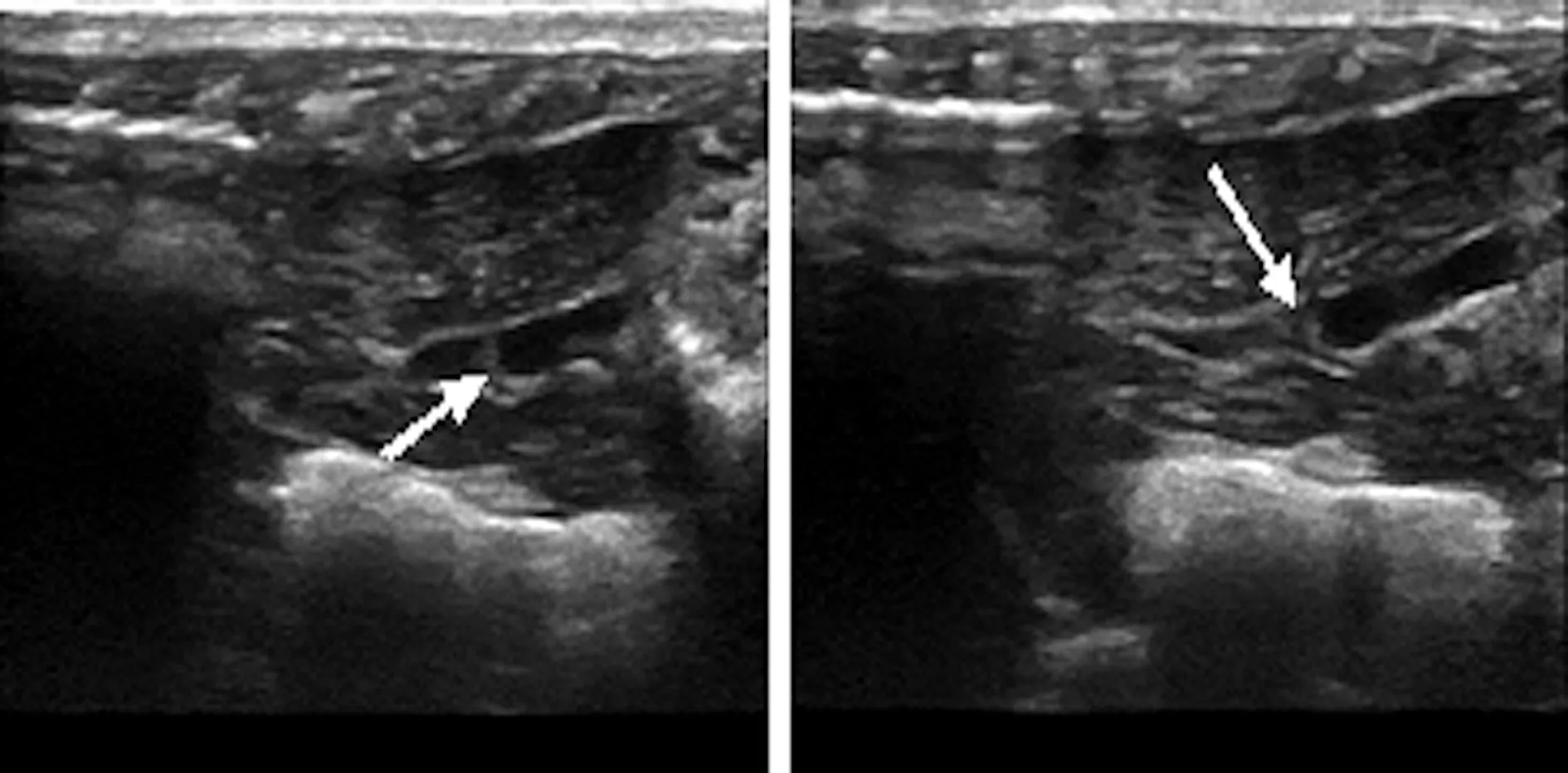
图1 超声引导下穿刺结果(箭头所示为针头位置)
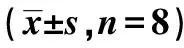
表1 各组治疗后第1周末血、尿生化指标结果
2.4肾脏与心脏的病理检查结果 N组肾固有细胞、肾间质未见明显异常;心肌细胞形态结构完整。CRS组可见肾小球硬化,肾小管上皮细胞空泡变,系膜细胞和基质增生,肾小球毛细血管袢闭塞,间质内可见大量炎细胞浸润;心肌细胞可见大量心肌细胞水肿坏死,基质内见可见大量炎细胞浸润。A组肾小球可见局灶节段性硬化,个别肾小球粘连,部分肾小管上皮细胞再生,间质内炎细胞浸润较CRS组有所减少;心肌细胞排列正常,少数细胞肿胀,间质内炎细胞浸润较CRS组明显减少。B组可见肾小球硬化,肾小管蛋白管型;心肌心态基本正常,心肌间质水肿较轻、炎细胞较少。C组可见部分肾小球毛细血管襻扩张,肾小管萎缩不明显,部分扩张的肾小管内可见蛋白管型,间质内炎细胞较少,呈小灶状浸润;心肌细胞结构完整、个别出现肿胀,基质水肿较轻、其内炎细胞浸润较少。与N组比较,A、B、C、CRS组CVF显著升高(P<0.05);与C组比较,A、B、CRS组CVF显著升高(P<0.05)。见表2、图2。
2.5心脏、肾脏组织的透射电镜检查结果 N组细胞核形态规则,大部分线粒体形态良好,嵴清晰;CRS组细胞核形态欠规则,线粒体变形、溶解;A组相对于CRS组细胞核形态较规则,线粒体肿胀但溶解较少;B组细胞核较规则,线粒体肿胀明显,可见溶解的线粒体;C组细胞核规则,线粒体肿胀程度明显降低,溶解的线粒体较少,嵴可见。N组显示心肌细胞结构完整,细胞核形态规则,呈圆形,核仁清,染色质分布较为均匀,肌节形态整齐、边界较清,线粒体形态正常,呈长椭圆形,无自噬小泡;CRS组肌节排列紊乱,较多肌节断裂溶解,间质纤维化并有大量炎细胞浸润,细胞核形态不规则、部分细胞核破裂,核内染色质呈块状聚集,大量线粒体肿胀或溶解、嵴断裂、空泡化严重,有明显的自噬小泡形成;A组心肌细胞结构稍肿胀、形态结构基本完整,基质中可见少量炎细胞浸润,部分线粒体膜损伤且有较多自噬小泡形成;B组心肌细胞线粒体肿胀、形态结构基本完整,肌节间隙较大,基质中少量炎细胞浸润线粒体损伤较轻,自噬小泡数量降低;C组心肌细胞形态完整、稍肿胀,细胞核形态呈圆形,核仁较清晰,染色质呈团块状分布,线粒体形态稍肿胀,自噬小泡数量较少。见图3。
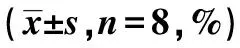
表2 各组心脏及肾脏病理、 心肌CVF及心肌TUNNEL结果
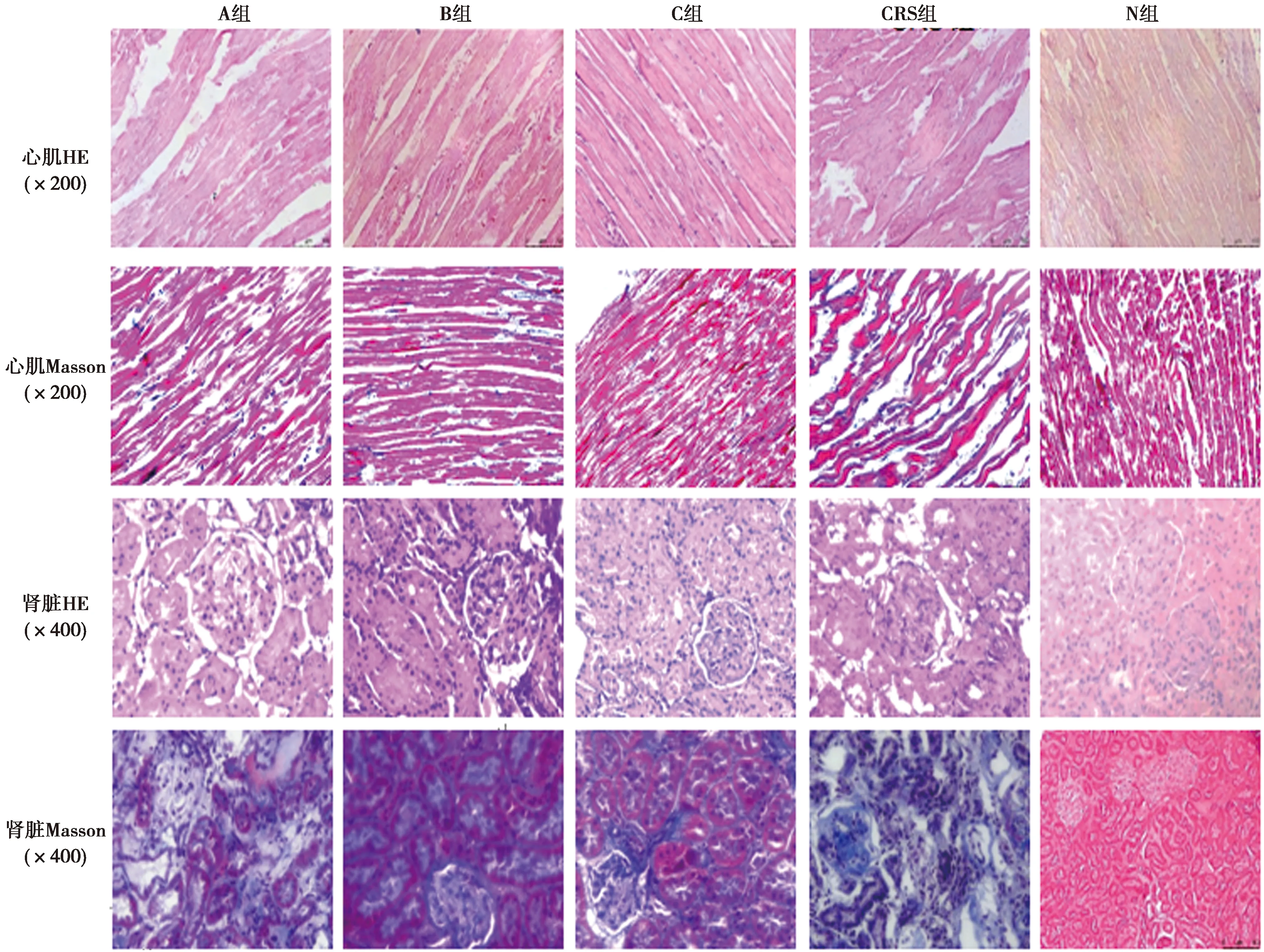
图2 各组心脏及肾脏病理结果及心肌CVF
2.6心脏与肾脏的细胞凋亡检查结果 TUNNEL结果表明,N组肾组织切片可见肾小球肾小管结构完整,几乎未见凋亡细胞;与N组相比,A、B、C组凋亡细胞明显增多,其中A组最多,C组相对较少,B组凋亡细胞数量介于二者之间,且肾组织的凋亡细胞主要分布在肾小管区域。见表2、图4。
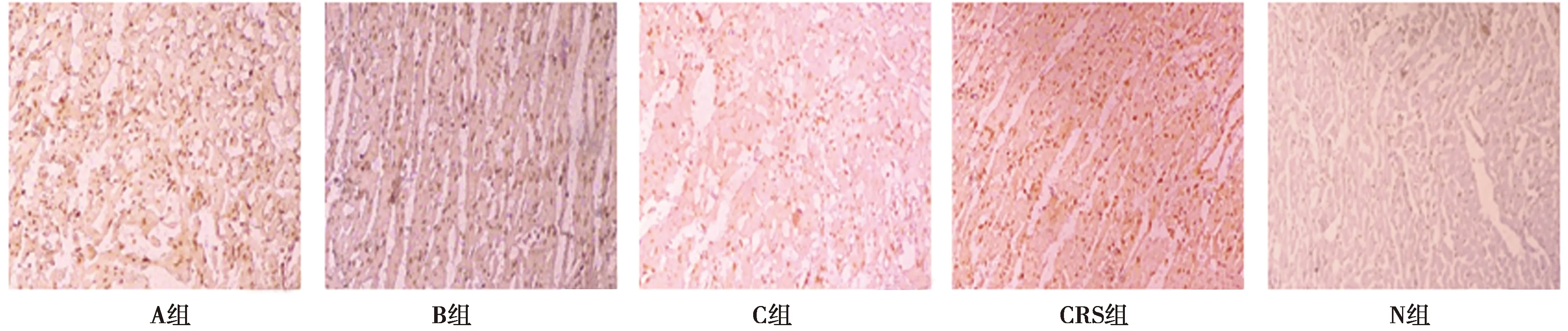
图4 各组心肌TUNEL结果(×200)
3 讨 论
CRS包括心脏和肾脏的多种疾病,指一个器官的功能障碍导致另一器官的急性或慢性功能障碍〔7〕。CRS的发病机制复杂,包括交感神经过度兴奋、肾素-血管紧张素-醛固醇系统(RAAS)过度激活、氧化应激、炎性反应、血流动力学异常等。Ⅳ型CRS又称慢性心肾综合征,其主要特征是由CKD导致心脏的慢性功能不全。随着CKD的进展,高血压、肺水肿等反应可引起心脏负荷增加,同时电解质紊乱、交感神经兴奋、缺血缺氧等进一步加重心肌损伤并最终导致心功能下降〔8〕。目前临床针对CRS常用的治疗方式是利尿、透析、血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)等,雷米普利是常用的ACEI类药物,可有效抑制RAAS的激活,同时增加缓激肽的水平,舒张血管、调节血压,对CKD诱导的心室肥大和心肌纤维化具有较好的修复作用。已有的研究证明5.0 mg/(kg·d)剂量的雷米普利灌胃对大鼠心脏疾病的治疗效果较佳〔9〕,本实验采用5.0 mg/(kg·d)为治疗剂量。随着再生医学的发展,干细胞逐渐被应用于细胞生物学工程。BMSCs作为干细胞家族的主要成员,以其易分离性、多能性和无伦理争议的特点已被应用于组织修复和再生领域〔10〕。现已证明BMSCs可抑制损伤组织中的炎症反应,同时在多种趋化因子的综合作用下向靶器官和靶组织迁移,并定向分化为相应组织细胞,参与受损器官或组织的修复过程〔11,12〕。实验证明,BMSCs对靶器官的修复作用主要表现在移植早期,且移植后第1周末与第2周末的修复作用无显著差异〔13,14〕,故本实验的检测点选择在BMSCs移植后第1周末。
以往研究表明〔15〕经肾动脉移植BMSCs的归巢效果优于外周静脉与肾包膜下直接注射,对CKD的治疗效果更佳,故本实验采用经肾动途径移植BMSCs。BUN和Scr是衡量CRS严重程度的灵敏指标,肾脏受损患者常在早期出现BUN、Scr可显著升高,经有效的治疗后随着肾功能的恢复,二者又可下降。本实验结果推测BMSCs在治疗早期可通过归巢分化及旁分泌等多种机制对CKD大鼠肾脏电荷屏障起到较好的修复作用。
本研究结果证实了BMSCs对CRS的修复作用不仅表现在对心肌本身的修复,同时也体现在对肾脏的修复。Chen等〔16〕证明了间充质干细胞可改善受损的肾脏肾小球肥大,肾小管上皮细胞空泡化等改变,同时减轻肾小球内细胞外基质沉积,减轻肾小球与肾小管间质纤维化并降低受损肾脏肾固有细胞的凋亡率。已有的研究证明间充质干细胞主要通过两种机制起到抗凋亡的作用,分别为:①间充质干细胞分泌各种生长因子,例如胰岛素样生长因子(IGF)-1、血管内皮细胞生长因子(VEGF)和肝细胞生长因子(HGF)等〔17~19〕;②间充质干细胞及其分泌的外泌体增加了抗凋亡基因的表达并促进mRNA转移到受损细胞中〔20,21〕。受损的线粒体可通过激活细胞的自噬过程对心肌造成损伤〔22〕,本研究结果证明,BMSCs可通过抑制凋亡从而对CRS进程中的心脏与肾脏起到较好的修复作用。同样证实了雷米普利对CRS的治疗效果主要通过改善心肌重塑实现,而BMSCs对CRS患者心肌重塑和抑制细胞凋亡与自噬均有作用。
