沉默RORα通过活化Wnt/β-catenin通路靶基因促进人胃癌细胞增殖
2023-03-22裴大兵张翼臻刘芳苏坚夏红苏琦
裴大兵 张翼臻 刘芳 苏坚,3 夏红 苏琦
(1南华大学衡阳医学院肿瘤研究所 湖南省肿瘤细胞与分子病理学重点实验室 湖南省胃癌研究中心,湖南 衡阳 421001;2井冈山大学附属医院普外科;3南华大学衡阳医学院附属第二医院病理科)
胃癌全球发生率与死亡率分别居于恶性肿瘤第五位与第三位,其中约44%的胃癌发生在中国〔1,2〕。因为胃癌早期发现困难,中晚期患者常常侵袭转移,治疗效果较差,5年生存率低〔2〕。因此,探讨胃癌侵袭转移机制是非常关键的问题。维甲酸相关孤核受体(RORs)的家族成员之一RORα,在多种肿瘤中低表达与肿瘤密切相关,并且可能是乳腺癌、黑色素瘤、结直肠癌和胃癌等肿瘤的靶点〔3〕。RORα高表达可抑制人胃癌MGC803细胞Wnt/β-连环素(catenin)信号通路靶基因表达〔4〕。并且,沉默RORα可促进人胃癌细胞上皮细胞-间充质转化(EMT)〔5〕。本文研究敲低RORα是否促进胃癌细胞Wnt信号通路靶基因表达。
1 材料与方法
1.1抗体与主要试剂 二喹啉甲酸(BCA)蛋白定量试剂盒、RNA提取试剂盒与逆转录试剂盒(Promega公司);RORα抗体、基质金属蛋白酶(MMP)-9抗体与β-actin抗体(Abcam公司);β-catenin、p-β-catenin、Wnt-1、转录因子(TCF)-4、Axin、c-Jun、c-Myc抗体与电化学发光(ECL)试剂盒(Santa Cruz公司);细胞核蛋白和胞质蛋白提取试剂盒、羊抗兔IgG-辣根过氧化物酶(HRP)和羊抗小鼠IgG-HRP(凯基生物公司);免疫共沉淀试剂盒(Pierce公司);羊抗小鼠IgG(H+L)(protech生物公司);c-Myc-pGL-3荧光素酶报告质粒由广州赛业生物公司提供。新生牛血清(杭州四季青生物公司);引物由上海生工公司合成。
1.2细胞培养 人胃癌MGC803细胞系(胃低分化黏液癌细胞)由中南大学肿瘤研究所馈赠,沉默RORα的MGC803细胞由本实验室构建〔5〕。在加入10%胎牛血清(FBS)和1%抗生素(青霉素/链霉素)的RPMI1640中培养。分为MGC803组、空载体组和RORα敲低组。
1.3噻唑蓝(MTT)检测检测沉默RORα对MGC803细胞增殖的作用 将对数生长期MGC803细胞,胰酶消化制成单细胞悬液,接种于96孔培养板,每孔设6个重复孔。细胞贴壁8 h后,更换为RPMI1640培养液,每孔加入MTT溶液,培养4 h,吸去全部上清液,再加入二甲基亚砜(DMSO)溶液,振荡摇匀,使结晶充分溶解。置酶联免疫仪检测各孔吸光值,波长光密度(OD570 nm)。
1.4实时定量聚合酶链反应(RT-PCR)检测Wnt/β-catenin通路相关分子 采用试剂盒提取细胞总RNA,AMV 酶逆转录合成 cDNA,PCR引物序列:RORα正义:5′-GTCAGCAGCTTCTACCTGGAC-3'、反义:5′-CAGTTGGGGAAGTCTCGCCG-3′,151 bp。Wnt1正义:5′-TGCACGCACACGCGCGTACTGCAC-3′、反义:5′-CAGGATGGCAAGAGGGTTCATG-3′,400 bp。β-catenin正义:5′-GTTGTACCGGAGCCCTTCAC-3′、反义:5′-TCCCACCCTACCAACCAAGT-3′,729 bp。Axin正义:5′-AGCCGTGTCGGACATGGA-3′、反义:5′-CCTCAAACACCACCCCACAG-3′,254 bp。c-Myc正义:5′-CGTCTCCACACATCAGCACAA-3′、反义:5′-CTGCTTGGACGGACAGGATG-3′,323 bp。c-Jun正义:5′-CGCACCGGTTGTTGAACTTG-3′、反义:5′-ATGCCTCCCGCACTCTTACT-3′,292 bp。MMP-9正义:5′-GTGCTGGGCTGCTGCTTTGCTG-3′、反义:5′-TGGGGTTCGCATGGCCTTCA-3′,255 bp。β-actin正义:5′-TCTACAATGAGCTGCGTGTGG-3′、反义:5′-GGAACCGCTCATTGCCAATG-3′,498 bp。PCR与文献相同〔4〕。
1.5Western印迹检测Wnt/β-catenin通路相关分子 收集细胞,加入细胞裂解液,在冰上通过裂解液彻底裂解1 h后低温离心收集细胞蛋白,利用BCA试剂盒测取蛋白浓度,经过上样缓冲液高温变形后,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)及聚偏氟乙烯(PVDF)膜转膜。脱脂牛奶封闭2 h,TBST清洗后加一抗4 ℃孵育过夜。TBST清洗后二抗孵育1 h,通过ECL获得结果。
1.6免疫共沉淀 按照免疫共沉淀试剂盒说明书收集样本蛋白。将RORα抗体加入细胞裂解物,4℃过夜,加入含蛋白G的旋转柱上,孵育30 min,2 000 r/min离心3 min,弃去滤过液,磷酸盐缓冲液(PBS)洗3次,加洗脱液洗2次,获得抗体复合物,加上样缓冲液,SDS-PAGE,进行Western印迹。
1.7荧光素酶报告基因分析 制备单细胞悬液,细胞计数,以3×104/cm2的细胞数量种入24孔板,c-Myc-pGL-3英光素酶报告质粒用脂质体(Lipofectamine)2000转染入细胞。加入裂解液,离心,加入荧光素酶底物。采用液体闪烁仪检测荧光值,相对荧光素酶活性=荧光素酶活性值/海肾荧光素酶活性值。
1.8统计学分析 采用SPSS13统计软件进行t检验、方差分析。
2 结 果
2.1MTT检测 48 h后,RORα敲低组增殖能力较MGC803组和空载体组(miR/MGC803)明显增强(P<0.05)。见表1。表明敲低RORα可促进MGC803细胞增殖能力。
2.2沉默RORα对Wnt/β-catenin通路的影响 RORα敲低组Wnt1 mRNA(2.90±0.3)较MGC803组(0.71±0.3)与空载体组(0.81±0.2)显著上调(P<0.05);RORα敲低组Wnt1蛋白(1.15±0.31)较MG803组(0.65±0.32)与空载体组(0.70±0.10)显著上调(P<0.05)。但RORα敲低组(1.06±0.31)、MGC803组(1.13±0.28)、空载体组总β-catenin蛋白(1.18±0.25)与RORα敲低组(1.17±0.31)、MGC803组(0.96±0.52)、空载体组β-catenin mRNA(1.18±0.25)没有显著差异(P>0.05)。见图1。免疫共沉淀显示,RORα敲低组(0.42±0.21)较MGC803组(1.53±0.50)与空载体组RORα与β-catenin结合(1.62±0.51)明显减少(P<0.05)。见图2。Western印迹检测显示,RORα敲低组(0.32±0.25)较MGC803组(0.18±0.18)与空载体组核内β-catenin(0.19±0.20)显著增加(P<0.05)。见图3。并且RORα敲低组TCF-4蛋白(1.42±0.53)较MGC803组(0.63±0.42)与空载体组(0.67±0.34)明显上调(P<0.05)。见图4。表明沉默RORα可上调Wnt1,与β-catenin结合减少,从而增加β-catenin入核,继而上调TCF-4表达。
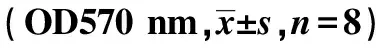
表1 沉默RORα对MGC803细胞增殖的 影响
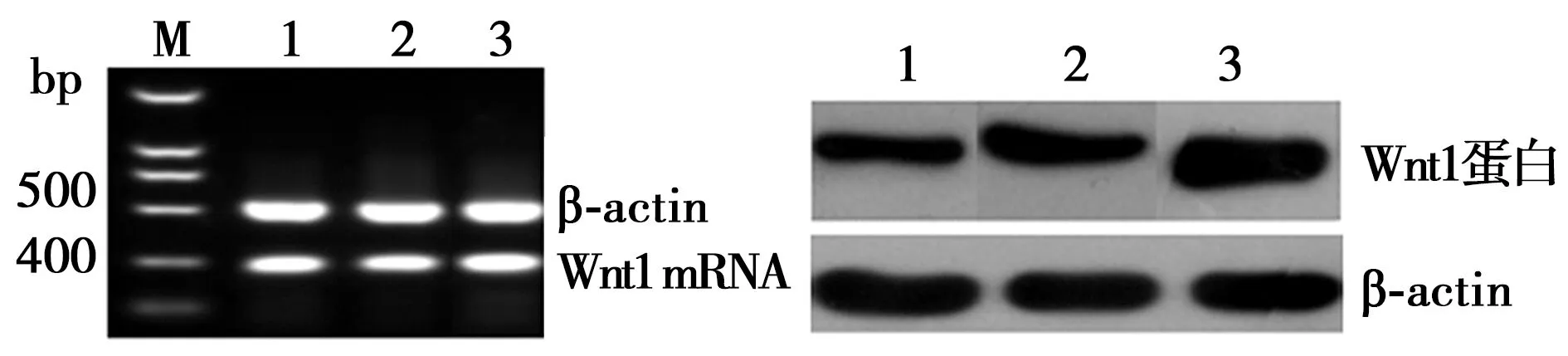
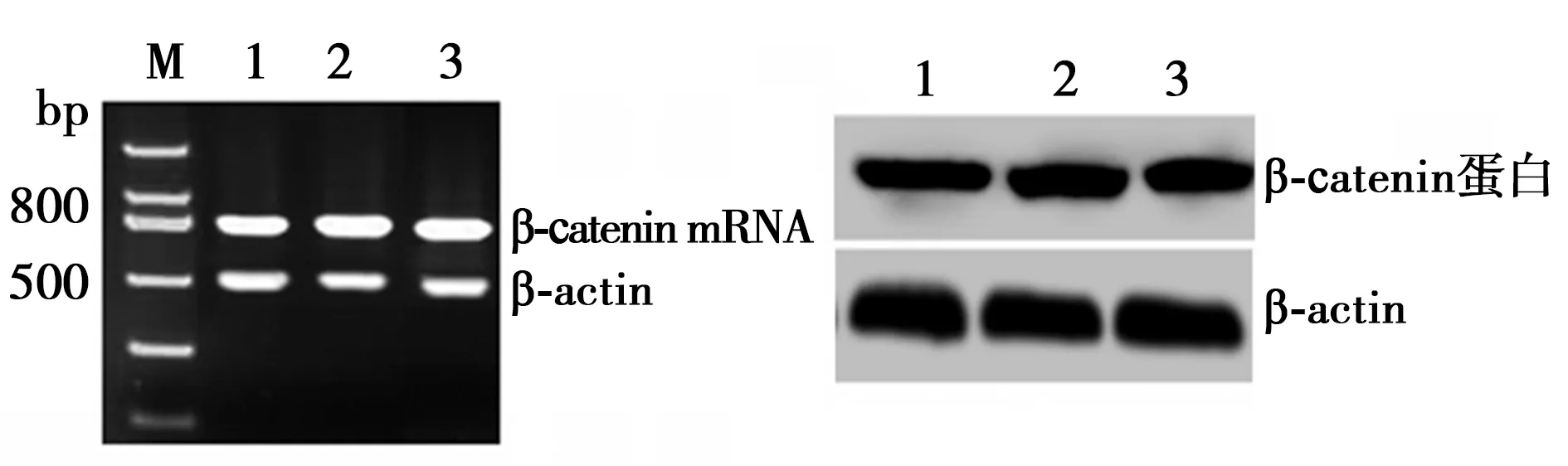
1:MGC803组;2:空载体组;3:RORα敲低组;图3、4、5同图1 沉默RORα对MGC803细胞Wnt1、 β-catenin表达的影响
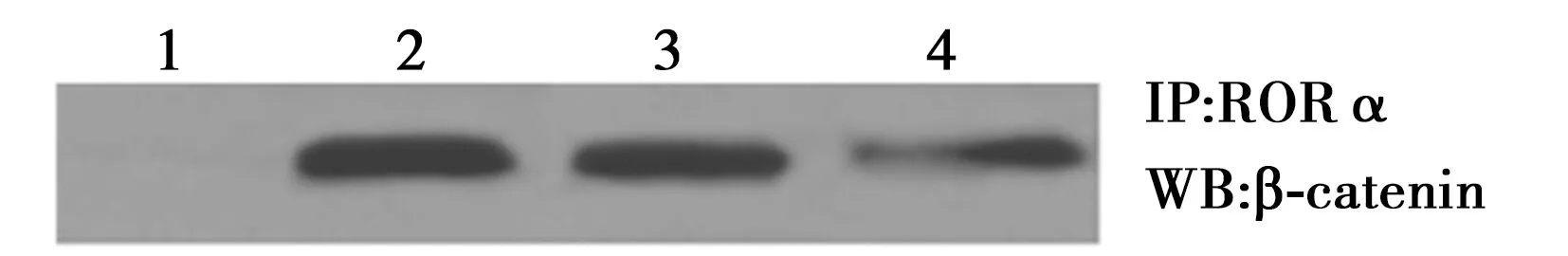
1:IgG;2:MGC803组;3:空载体组;4:RORα敲低组图2 免疫共沉淀检测沉默RORα对MGC803细胞 RORα与β-catenin结合的影响

图3 沉默RORα对核内β-catenin表达的影响
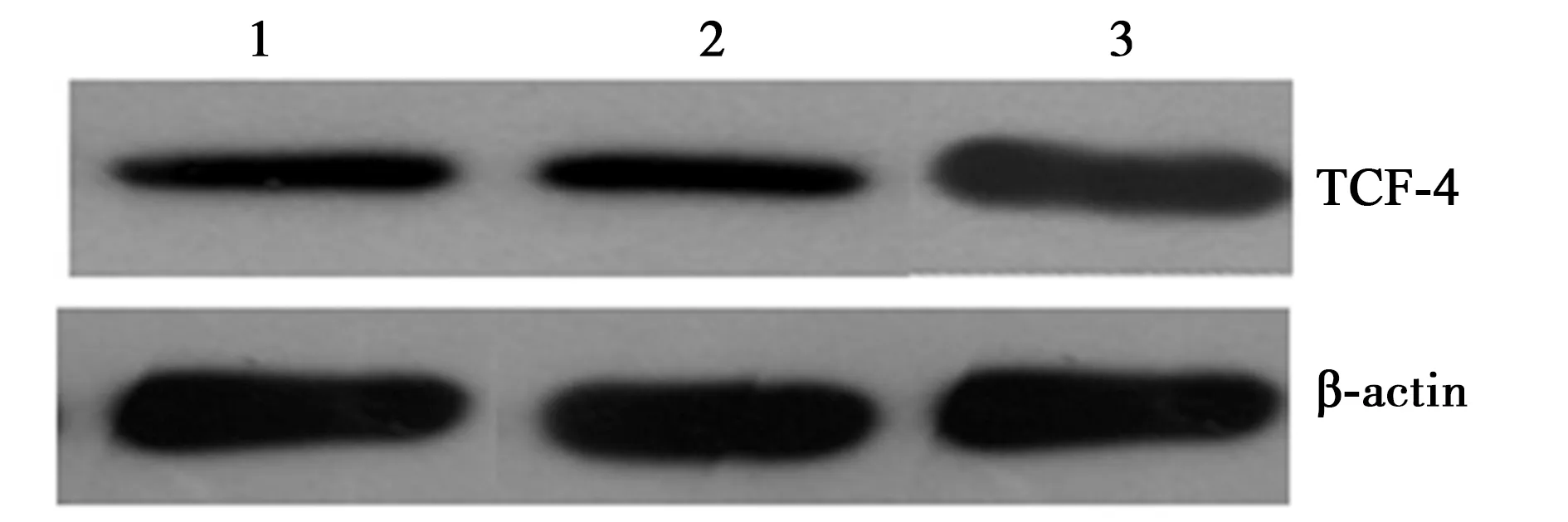
图4 沉默RORα对MGC803细胞TCF-4蛋白表达的影响
2.3沉默RORα促进Wnt/β-catenin通路靶基因表达 RORα敲低组较MGC803组、空载体组c-Myc、c-Jun、Axin、MMP-9 mRNA与蛋白表达明显上调(P<0.05),见图5,表2;提示沉默RORα可促进Wnt/β-catenin通路靶基因表达。
2.4沉默RORα增强c-Myc启动子活性 MGC803组(1 500±0.98)与空载体组c-Myc启动子活性(1 497±0.78)明显低于RORα敲低组(2 536±0.59,P<0.05)。提示敲低RORα能够增强c-Myc启动子活性。
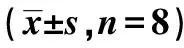
表2 沉默RORα对MGC803细胞Wnt/β-catenin通路靶基因mRNA及蛋白表达的影响
3 讨 论
既往研究发现,RORα在口腔鳞状细胞癌(OSCC)表达明显低于正常上皮细胞,并且与分化程度、临床分期和不良生存率明显有关。沉默RORα可促进OSCC细胞增殖与裸鼠移植瘤生长,下调p53表达与抑制p53磷酸化。相反,RORα高表达可明显抑制增殖与移植瘤生长,上调p53与磷酸化水平〔6〕。在紫外线诱导的皮肤鳞状细胞癌(cSCC)小鼠模型中,发现RORα下调,转录组分析、生物信息学分析和细胞实验证明RORα是cSCC进展过程中的关键转录因子。并且,RORα通过下调S100a9和Sprr2f表达,进而抑制cSCC细胞增殖和迁移〔7〕。研究显示,食管癌组织与细胞中,较正常组织与细胞RORα明显下调,并且发现RORα基因启动子区域被甲基化。采用甲基化抑制剂5aza-2-dc处理后,RORα mRNA与蛋白表达上调,而RORα高表达或激活可抑制肿瘤细胞增殖〔8〕。ROR-α-1高表达可显著抑制肝癌细胞的增殖、迁移和侵袭能力,并下调β-catenin、c-Myc、CyclinD1和N-cadherin水平,提示ROR-α-1具有抑制肝癌的作用〔9〕。
研究证实,Wnt/β-catenin信号通路在胃癌进展中起重要作用〔10〕。Wnt/β-catenin信号转导中的关键因子及其下游效应因子在肿瘤起始、生长、转移和治疗耐药性中的调节过程中发挥作用〔11〕。wnt/β-catenin通路的失调常诱发EMT,导致癌细胞失去上皮表型而获得间充质表型的过程,促进肿瘤迁移和侵袭,可能是肿瘤治疗靶点〔12,13〕。有学者报道,在乳腺癌中RORα低表达,而促进其高表达后,可通过与β-catenin结合下调Wnt/β-catenin 靶基因表达,抑制乳腺癌细胞增殖与侵袭,提示RORα可通过下调Wnt/β-catenin靶基因抑制乳腺癌进展〔14〕。不仅如此,PGE2/蛋白激酶(PK)Cα可磷酸化RORα,从而抑制Wnt信号通路下游基因CyclinD1的转录表达,表明RORα是调控肿瘤细胞增殖的关键因子〔15〕。miR-1246在肝癌中高表达,其靶基因是RORα,miR-1246高表达和RORα低表达是侵袭性肝癌的显著特征。miR-1246高表达或沉默RORα可通过激活Wnt/β-catenin通路在体内外增强肝癌的增殖、侵袭与转移和促进EMT〔16〕。RORα在胃癌中低表达与肿瘤大小、肿瘤分化、TNM分期和淋巴结转移显著有关,其机制是由于腺苷酸活化蛋白激酶(AMPK)活性降低,而AMPK可通过转录与翻译后修饰调控RORα。研究报告,AMPK活化剂AICAR可增强RORα活性与表达,上调p21、SEMA3F等抑癌基因表达。表明AMPK的活化剂可能对治疗胃癌具有价值〔17〕。
结果表明RORα可能是胃癌治疗的靶点。目前,研发RORα的激动剂或有效药物成为治疗肿瘤的新策略〔14〕。研究表明,姜黄素是一种可以抑制Wnt/β-catenin通路,并减缓胃癌发展进程的传统中药单体〔18〕。绿茶中的多酚EGCG也可以通过失活Wnt/β-catenin通路,从而抑制胃癌细胞的增殖生长,并促进其凋亡来抑制胃癌发展〔19〕。研究指出,亚硒酸钠可通过增强SBP1表达来抑制Nrf2和Wnt/β-catenin通路的活性,从而阻碍癌细胞增殖和生长〔20〕。类似的,吴茱萸碱(Evodiamine)可通过干预Wnt/β-catenin通路活性,抑制Sox2、KLF4、Bmi1和Oct4的表达,进而抑制胃癌干细胞的特征从而下调奥沙利铂耐药,并且还可抑制Slug、Twist、Zeb1和Vimentin的水平,逆转EMT进程〔21〕。维生素D羟基衍生物20(OH)D3和1,20(OH)2D3可通过失活Wnt/β-catenin信号通路下调β-catenin核易位抑制OSCC CAL-27的生长〔22〕。并且,维生素D羟基衍生物和RORα激动剂SR1078可抑制卵巢癌的增殖和干性〔23〕。SR1078可通过上调RORα表达抑制人胃癌细胞的增殖和侵袭〔24〕。
研究显示,二烯丙基二硫(DADS)是来自大蒜中的一种脂溶性烯丙基硫化物有效成分,在多种肿瘤中都具有明显的抗癌作用〔25〕。DADS可通过抑制Rac1-Pak1/Rock1/LIMK1通路来阻碍胃癌细胞的EMT〔26〕。在蛋白质组学中,DADS可促进人胃癌MGC803细胞中RORα表达〔27〕。然而,DADS是否也可通过RORα导致Wnt/β-catenin通路失活,从而作为胃癌治疗的潜在靶点尚待深入研究。
