β微球蛋白和花生四烯酸代谢物对老年大鼠慢性肾脏疾病炎症反应的影响
2023-03-22冯静李莉
冯静 李莉
(1海口市人民医院,海南 海口 570208,2海南医学院第一附属医院)
不同程度肾功能损害是慢性肾衰竭的主要病因,炎症细胞可以产生大量的炎症介质,炎症介质又可趋化、激活炎症细胞〔1〕。炎症介质可通过收缩或舒张血管影响肾脏局部的血流动力学,通过影响细胞的增殖、自分泌和旁分泌,从而介导炎症损伤及其硬化病变〔2〕。持续炎症状态会参与慢性肾部疾病的足细胞损伤,随着病情的加重,炎症状态就严重,并且能够增加心血管疾病和感染等并发症的发生的风险。β微球蛋白(β2M)是由100个氨基酸残基组成,是构成细胞膜上组织相容性抗原的一部分〔3〕。相关研究表明炎症、风湿性疾病、肿瘤和肝脏类疾病可能促使β2M合成增加〔4〕。花生四烯酸(AA)是人体分布比较广泛的脂肪酸,生物活性较强,是人体炎症和氧化应激活性物质代谢的主要组成部分。相关研究显示,AA与早期胰岛素抵抗的发生和发展关系密切〔5〕。白三烯(LT)B4与血栓素(TX)A2是较为常见的AA代谢物,目前关于β2M和AA代谢物在肾功能衰竭炎症反应中的相关报道较少,所以本研究深入探讨β2M、LTB4与TXA2对老年大鼠慢性肾脏疾病炎症反应。
1 材料和方法
1.1实验动物 清洁级健康的老龄SD大鼠20只,月龄18 w,体重500~650 g,SPF 级,购自南京君科生物工程有限公司〔SCXK(苏)2019-0001〕,饲养在海南省实验动物中心〔SCXK(琼)2019-0007〕,在消过毒的独立通风系统笼具(IVC)笼内中饲养,光照和黑暗交替12 h,温度40%~55%,湿度21~25℃,每个笼中5只,动物实验方案经过海南医学院动物管理使用委员会批准(IACUC-2019-013-09),在饲养和实验的过程中严格贯彻3R原则。采用随机数字表法分为4组,每组5只,分别为对照组〔注射1 mg/kg脂多糖(LPS)〕、β2M抑制剂组〔注射1 mg/kg LPS+二肽基肽酶(DPP)-4抑制剂5 mg/kg〕、AA抑制剂组(注射1 mg/kg LPS + HET0016 20 mg/kg)和β2M+AA抑制剂组(注射1 mg/kg LPS+DPP-4抑制剂 5 mg/kg + HET0016 20 mg/kg)。
1.2主要试剂和仪器 β2M抑制剂购自北京百奥博科技有限公司;CYP4A 抑制剂(HET0016)购自上海工硕生物技术有限公司;超氧化物歧化酶(SOD)检测试剂盒购自上海语纯生物科技有限公司;谷胱甘肽过氧化物(GSH-PX)酶检测试剂盒、过氧化氢酶(CAT)和丙二醛(MDA)检测试剂盒、活性氧(ROS)初级荧光测定试剂盒检测购自南京建成生物工程研究所;髓过氧化物酶(MPO)检测试剂盒购自宝生物工程(大连)有限公司;鼠抗β2M抗体 、鼠抗LTB4抗体、鼠抗TXA2抗体、兔抗单核细胞趋化蛋白(MCP)-1抗体、兔抗P-P65抗体、磷酸化核因子κB抑制蛋白(P-IKB)α抗体、鼠抗P65抗体和鼠抗磷酸化IκB激酶(P-IKK)β抗体购自美国 Promega 公司;鼠抗白细胞介素(IL)-1β抗体、鼠抗IL-6抗体和鼠抗肿瘤坏死因子(TNF)-α抗体购自北京中杉金桥生物技术有限公司;聚偏氟乙烯(PVDF)膜购自美国Coming Costar公司;蛋白电泳仪美国ABI公司。
1.3实验方法
1.3.1动物模型建立 大鼠腹腔注射LPS,按照体重每天1 mg/kg,连续注射8 w,在第一次注射LPS前2 d,通过腹腔给药DPP-4抑制剂和HET0016,β2M抑制剂组大鼠注射DPP-4抑制剂,按照体重每天5 mg/kg,AA抑制剂组大鼠注射HET0016,按照体重每天20 mg/kg,β2M+AA抑制剂组大鼠注射DPP-4抑制剂5 mg/kg 和HET0016 20 mg/kg,直到第8周处死大鼠,在第8周收集肾皮质组织,进行下一步分析。
1.3.2Western印迹检测β2M 、LTB4、TXA2、MCP-1、P-P65和P-IKBα、P65和P-IKKβ蛋白 取大鼠肾组织,加入蛋白裂解液制成匀浆,然后进行离心处理,提取组织中总蛋白测定浓度,在100 V对总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白样品采用Bradford法定量,将电泳产物转至PVDF 膜上,用10%的山羊血清,封闭0.5 h,分别加入一抗4℃孵育过夜,TBST洗涤,二抗孵育2 h,GAPDH作内参,用 Image J 分析软件检测条带灰度值,检测β2M LTB4 与TXA2、MCP-1、P-P65和P-IKBα、P65和P-IKKβ蛋白表达。
1.3.3PAS染色观察大鼠肾组织病理学变化 取大鼠肾组织,切片、脱蜡,在使用1%高碘酸钠水溶液氧化20 min,PBS冲洗3次后,在使用Shiff 液染色30 min,染色后,经过蒸馏水分化5 min,苏木素染色20 s,以浓度为1%的盐酸乙醇分化10 s,PBS冲洗后,梯度乙醇脱水,二甲苯透明,采用中性树胶进行封固,镜下观察。
1.3.4免疫氧化相关指标SOD、CAT、GSH-PX、ROS、MPO和MDA检测 将大鼠肾组织制备成10%的组织匀浆,采用SOD检测试剂盒检测SOD活性,采用GSH-PX酶检测试剂盒检测GSH-PX活性,采用CAT检测试剂盒检测CAT和MDA活性,采用初级荧光测定试剂盒检测ROS活性,使用MPO检测试剂盒检测MPO含量,所有操作均按照试剂盒的使用说明进行严格操作。
1.3.5免疫组织化学方法检测IL-1β、IL-6和TNF-α蛋白水平 将肾组织脱蜡,进行烤片处理,将热玻片放入二甲苯中处理2次,每次10 min,无水乙醇2次,每次5 min,H2O2阻断20 min,磷酸盐缓冲液(PBS)冲洗3次,将玻片置于0.01 mol/L枸椽酸中修复液,微波修复2次,冷却后,PBS冲洗3次,将非免疫血清滴加于玻片上置37℃恒温箱孵育30 min,抹干切片后,滴加特异性抗体,恒温箱孵育20 min,过夜,滴加标记的二抗,恒温箱孵育,再将二氨基联苯胺(DAB)液体滴加到切片上,直到染色满意后为止,染色后用自来水冲洗,苏木素复染,脱水烘干后用中性树胶封片,光镜下观察切片染色情况并摄影。观察IL-1β、IL-6和TNF-α蛋白表达情况。
1.4统计学方法 采用SPSS23.0软件进行方差分析,两两比较采用LSD-t法。
2 结 果
2.1大鼠肾组织中β2M和AA代谢物水平对比 模型组β2M 、LTB4与TXA2蛋白水平明显高于对照组(均P<0.05),见图1、表1。
2.2β2M和AA代谢物抑制剂对大鼠肾脏病理形态学的影响 PAS染色发现,对照组明显的肾小球硬化,而经过β2M和AA抑制剂处理过的β2M抑制剂组和AA抑制剂组肾小球硬化改善明显,经过β2M和AA抑制剂共同处理后β2M+AA抑制剂组肾小球硬化改善更为显著,见图2。
2.3β2M和AA代谢物抑制剂对大鼠肾脏免受氧化损伤影响 与对照组相比,β2M抑制剂组和AA抑制剂组SOD、CAT和GSH-PX蛋白水平显著升高(P<0.05),与β2M抑制剂组和AA抑制剂组相比,β2M+AA抑制剂组SOD、CAT和GSH-PX蛋白水平升高更为明显(P<0.05);与对照组相比,β2M抑制剂组和AA抑制剂组中的ROS、MPO和MDA蛋白水平显著降低(P<0.05),与β2M抑制剂组和AA抑制剂组相比,β2M+AA抑制剂组中的ROS、MPO和MDA蛋白水平降低更为明显(P<0.05),见表2。
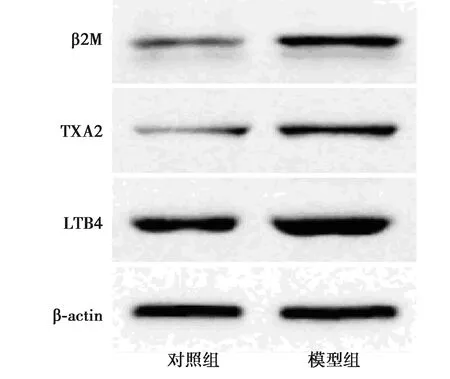
图1 Western印迹检测各组β2M 、LTB4与 TXA2蛋白表达
表1 各组肾组织中β2M、LTB4和TXA2的表达
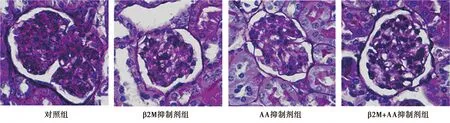
图2 各组肾脏病理形态学情况(PAS染色,×200)
表2 各组肾脏免受氧化损伤各指标水平表达
2.4β2M和AA代谢物抑制剂对大鼠肾脏炎症的影响 与对照组相比,β2M抑制剂组和AA抑制剂组中的IL-1β、IL-6和TNF-α蛋白水平显著降低(P<0.05),与β2M抑制剂组和AA抑制剂组相比,β2M+AA抑制剂组中的IL-1β、IL-6和TNF-α蛋白水平降低更为明显(P<0.05),β2M抑制剂组和AA抑制剂组中的IL-1β、IL-6和TNF-α蛋白水平对比无显著性差异(P>0.05),见表3、图3。
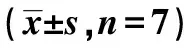
表3 各组肾脏炎症情况对比
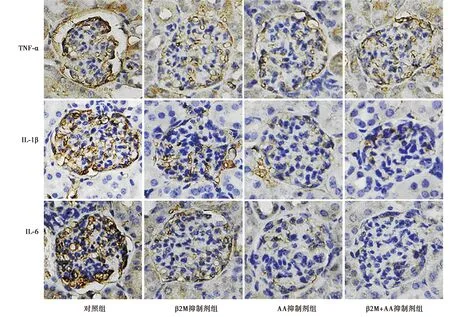
图3 各肾脏炎症情况(免疫组化学染色,×200)
2.5β2M和AA代谢物抑制剂对大鼠肾脏相关蛋白表达 β2M抑制剂组和AA抑制剂组中MCP-1、P-P65和P-IKBα蛋白水平显著低于对照组(P<0.05),β2M+AA抑制剂组中MCP-1、P-P65和P-IKBα蛋白水平明显低于β2M抑制剂组和AA抑制剂组(P<0.05),β2M抑制剂组和AA抑制剂组中MCP-1、P-P65和P-IKBα蛋白水平对比无显著差异(P>0.05);4组P65蛋白水平无显著差异(P>0.05);β2M抑制剂组和AA抑制剂组P-IKKβ蛋白水平明显高于对照组(P<0.05),β2M+AA抑制剂组中P-IKKβ蛋白水平明显高于β2M抑制剂组和AA抑制剂组(P<0.05),见图4、表4。
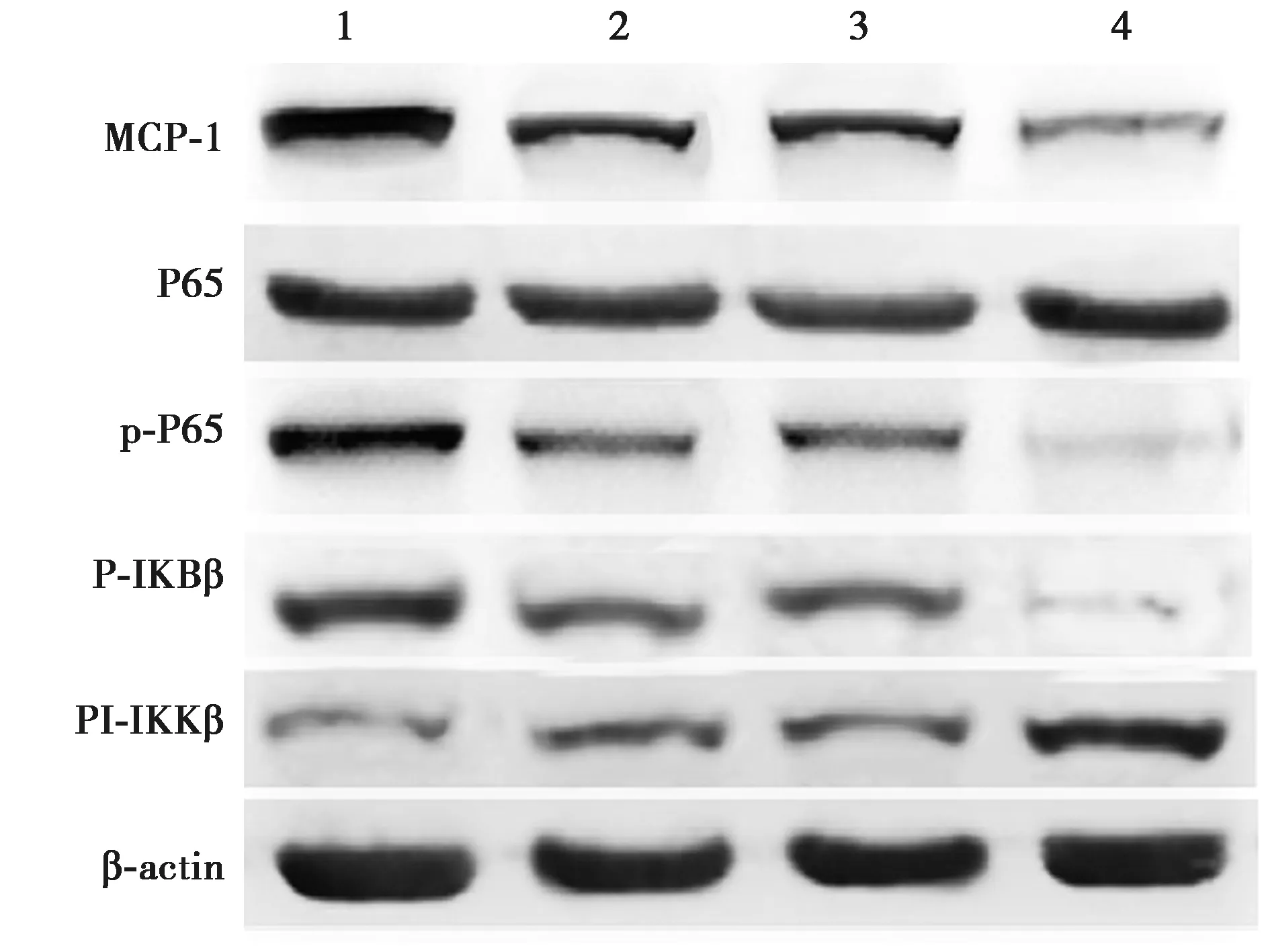
1~4:对照组,β2M抑制剂组,AA抑制剂组,β2M+AA抑制剂组图4 各组肾脏组织的相关蛋白表达
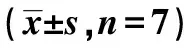
表4 各组肾脏组织相关蛋白表达
3 讨 论
据估计全世界慢性肾脏疾病的患病率为8%~16%〔6〕。目前,没有单一的治疗方法来改善慢性肾脏疾病患者的肾功能,肾功能的持续恶化会发展为肾衰竭〔7〕,因此,找到有效的治疗方法仍然是当务之急。炎症反应和氧化应激是慢性肾脏疾病发生和发展的共同特征和主要介质,炎症细胞的浸润及炎症介质的释放是肾脏损伤的发生和发展的始动因素〔8〕,氧化应激的持续性会伴有炎症反应的发生,因此控制相关发生因素可能是治疗慢性肾脏疾病的药物靶点。
β2M是人体核细胞产生的一种大分子蛋白,当β2M在体内产生量恒定时,易于肾小球滤过〔9〕。LTB4与TXA2是慢性肾脏疾病患者体内中间代谢产物,LTB4与TXA2水平的变化极容易导致肾脏局部缺血发生紊乱〔10〕,相关研究报道,LTB4与TXA2在血管平滑肌中促进细胞凋亡〔11〕。本研究结果提示慢性肾脏疾病的大鼠中β2M、LTB4与TXA2蛋白水平明显高于正常大鼠的水平,所以说β2M、LTB4与TXA2可能是衡量慢性肾脏疾病比较重要的指标。相关研究表明,当体内β2M水平显著升高时,证明肾功能对该物质的代谢量降低〔12〕。所以说明β2M、LTB4与TXA2分泌过多对肾脏产生不利的影响。
氧化应激反应是导致肾损伤的关键环节,慢性肾脏疾病中ROS的增加会伴随着肾脏内源性抗氧化防御系统的损伤〔13〕。以前的药理学研究集中在防止ROS的产生,或者增加细胞的抗氧化剂〔14〕,然而,这些方法受到各种复杂因素的限制,还有待于进一步的研究。肾组织产生过多的ROS会导致内皮损伤,增殖组织水肿和血管的渗透性〔15〕。酶和非酶系统是ROS的内源性防御机制,ROS产生过量和抗氧化能力的降低引起肾损伤的恶化〔16〕。SOD和CAT是肾脏中的中性粒细胞活化通过炎性因子以及ROS释放,能够促进肾损伤和远隔器官的损伤〔17〕。SOD催化超氧化物自由基,保护细胞不受ROS侵害。GSH-PX是一个硒蛋白家族,负责将其他有机过氧化物转化为水和氧〔18〕。CAT是一种常见的抗氧化酶,大量存在于肝脏、肺和肾脏中,CAT通过降解过氧化氢,在保护生物免受ROS氧化损伤方面发挥重要作用〔19〕。本研究结果说明有效抑制β2M、LTB4与TXA2水平,能够降低氧化应激的产生和相关因子的释放,从而缓解氧化应激对肾损伤的影响。
过度的氧化应激会导致炎症反应的发生,炎症反应也是肾损伤的重要生理过程〔20〕。MCP-1是一种趋化因子,趋化和激活巨噬细胞趋化和激活,促进IL-1β、IL-6和TNF-α等炎症物质大量分泌,损伤局部和远程组织〔21〕。考虑到通过DPP-4和HET0016可以显著下调ROS水平,就能够减少IL-1β、IL-6和TNF-α等炎症物质大量的释放,它有效地中和活性氧并帮助排毒有毒化学物质,抑制NF-κB核易位的磷酸化,调节MCP-1、P-P65、P-IKKβ和P-IKBα水平,阻碍炎性细胞因子的产生。
综上,β2M、LTB4和TXA2有可能成为慢性肾炎的生物标志物,抑制β2M、LTB4和TXA2,有助于增加抗氧化物的含量,来减少氧化应激反应,降低炎症反应,从根本上防止慢性肾脏疾病的进一步损伤,同时为临床上防治慢性肾脏疾病的进一步发展提供新的药物作用靶点。
