Bond Elut PBA固相萃取柱净化-高效液相色谱-串联质谱法同时测定鸡肉中金刚烷胺和利巴韦林的残留量
2023-03-21俞子萱李淑静
王 飞,俞子萱,李淑静
(天津海关动植物与食品检测中心,天津 300461)
金刚烷胺是最早用于抑制流感病毒的抗病毒药物,但其治疗剂量与产生副作用的剂量很接近。利巴韦林是核苷酸类药物,具有较强的致畸效应,会引起胚胎损害。在农业部第560号公告[1]《兽药地方标准废止目录》中,金刚烷胺、利巴韦林被明确列为禁止生产、销售和使用的兽药。为防止含有上述两种药物的动物源性食品对人体健康产生危害,有必要对市场中动物源性食品中的金刚烷胺和利巴韦林进行检测。禽肉中利巴韦林和金刚烷胺均是必须检测的项目,但这两种化合物极性差异较大,已有的检测方法[2-3]和标准[4-5]多是采用单独检测的方式。文献[6-7]采用Waters BEH HILIC 色谱柱同时分离利巴韦林和金刚烷胺,但利巴韦林和金刚烷胺均在1.5 min左右出峰,相较于采用C18色谱柱的传统方法,其保留效果极弱。文献[8]采用HILIC Silica色谱柱同时分离利巴韦林和金刚烷胺,利巴韦林和金刚烷胺均在4 min后出峰,二者虽然可以达到完全分离,但是色谱峰峰形存在较大差异,利巴韦林的峰形不太理想。鉴于此,本工作采用高效液相色谱-串联质谱法同时检测鸡肉中的利巴韦林和金刚烷胺,在保证金刚烷胺回收率稳定的前提下兼顾了利巴韦林极性较强的特性,并解决了鸡肉中目标物提取以及杂质净化问题。
1 试验部分
1.1 仪器与试剂
SHIMADZU 30A 型高效液相色谱仪;AB SCIEX QTRAP 6500型串联质谱仪;Mettler AL104型电子天平;Mili-Q 型净化水系统。Bond Elut PBA固相萃取柱(PBA 小柱,规格100 mg/3 mL);Sep-Pak C8固相萃取柱(C8小柱,规格500 mg/6 mL)。TSK gel Amide-80 色谱柱(150 mm×2.0 mm,5.0μm);Poroshell 120 SB-C18色谱柱(150 mm×2.1 mm,2.7 μm);Eclipse XDB-C8色谱柱(150 mm×4.6 mm,5.0μm)。
单标准储备溶液:100 mg·L-1,取适量利巴韦林、金刚烷胺标准品,用甲醇溶解和定容,摇匀备用。
混合标准中间液:1 mg·L-1,取适量利巴韦林、金刚烷胺单标准储备溶液,用甲醇定容,摇匀备用。
单内标储备溶液:100 mg·L-1,取适量利巴韦林-13C5、金刚烷胺-d6标准品,用甲醇溶解和定容,摇匀备用。
混合内标溶液:1 mg·L-1,取适量利巴韦林-13C5、金刚烷胺-d6单内标储备溶液,用甲醇定容,摇匀备用。
混合标准溶液系列:取适量混合标准中间液和混合内标溶液,用甲醇逐级稀释,配制成2,4,10,20,40μg·L-1的混合标准溶液系列,其中内标质量浓度为10μg·L-1。
利巴韦林、金刚烷胺、利巴韦林-13C5、金刚烷胺-d6标准品纯度均大于98%;甲醇、甲酸、乙腈、三氯乙酸等均为色谱纯;除另有说明,其他所用试剂均为分析纯;试验用水为纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Eclipse XDB-C8色谱柱(150 mm×4.6 mm,5.0μm);柱温25 ℃;流动相A 为含5 mmol·L-1乙酸铵的1%(体积分数,下同)甲酸溶液,B 为甲醇,C为水;流量300μL·min-1;进样量10μL。梯度洗脱程序见表1。
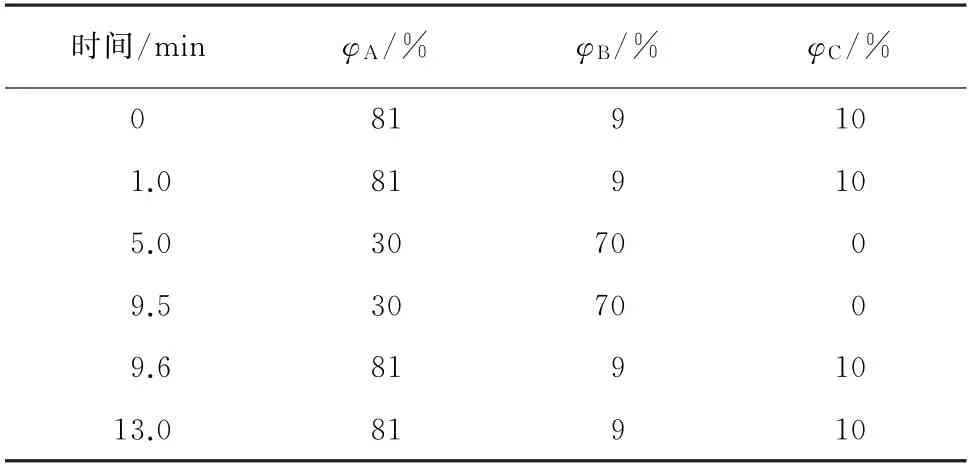
表1 梯度洗脱程序Tab.1 Gradient elution program
1.2.2 质谱条件
电喷雾离子源,正离子(ESI+)模式;毛细管电压5.5 k V;离子源温度450 ℃;多反应监测模式。其他质谱参数见表2,其中“*”代表定量离子。

表2 质谱参数Tab.2 MS parameters
1.3 试验方法
取市场购买的鸡肉样品约2.0 g(精确到0.1 g)于50 mL离心管中,加入100μg·L-1混合内标溶液100μL和体积比7∶3的20 g·L-1三氯乙酸溶液-乙腈的混合溶液(提取剂)15 mL,置于涡旋振荡器上,涡旋30 s,然后置于摇床上,以300 r·min-1转速振荡15 min,以10 000 r·min-1转速离心5 min,上层有机相转移至50 mL离心管中,在下层沉淀中加入提取剂15 mL,重复上述操作一次。合并上层有机相,过普通滤纸,用约100μL 氨水调节滤液pH 至8.5,待净化。
将PBA 小柱依次用乙腈3 mL、体积比1∶3的1%甲酸溶液-乙腈的混合溶液3 mL 和0.25 mol·L-1乙酸铵溶液(pH 8.5左右)3 mL 充分活化,将待净化的滤液全部转移至PBA 小柱中,依次以体积比9∶1的0.25 mol·L-1乙酸铵溶液-乙腈的混合溶液3 mL 和含5%(体积分数)氨水的甲醇溶液3 mL淋洗,以含2%(体积分数)甲酸的甲醇溶液4 mL洗脱。收集洗脱液,氮吹至干,加入体积比1∶9的乙腈-水的混合溶液1 mL,涡旋复溶后过0.22μm 滤膜,滤液供高效液相色谱-串联质谱仪分析。
2 结果与讨论
2.1 仪器工作条件的选择
2.1.1 质谱条件
较高的离子源温度能够得到更好的离子化效率,但在检测利巴韦林和金刚烷胺时,当离子源温度为550 ℃时,金刚烷胺和利巴韦林的离子化效率要比450℃时的低,且峰形受到严重影响。因此,试验选择的离子源温度为450 ℃。
2.1.2 色谱条件
利巴韦林属于强极性化合物,金刚烷胺属于中等极性化合物,选取合适的色谱柱、流动相及梯度洗脱程序是使这两种化合物获得良好分离的关键。
试验比较了亲水性TSK gel Amide-80色谱柱、中等极性Eclipse XDB-C8色谱柱和弱极性Poroshell 120 SB-C18色谱柱对100μg·L-1混合标准溶液中两种目标物分离效果。结果显示,利巴韦林在Poroshell 120 SB-C18色谱柱上的保留极弱,在2.0 min左右出峰,即使改变流动相的种类及梯度,也对其保留情况改善不大。TSK gel Amide-80色谱柱是键合酰胺基团的亲水性色谱柱,使用时不能长时间处于高有机相环境中,在此要求下,改变流动相的种类及梯度,利巴韦林、金刚烷胺的保留均很弱,均在2.0 min之前出峰;此外两种目标物在色谱柱上的残留现象比较严重,在柱子使用20次后,两种目标物的色谱峰峰形变差、响应强度降低[图1(a)和图1(b)]。利巴韦林和金刚烷胺在Eclipse XDB-C8色谱柱上有更强的保留,分别在4.30,9.13 min出峰;和有机相采用乙腈时的色谱分离效果[图1(c)]相比,有机相采用甲醇[图1(d)]时两种目标物的响应强度更高、峰形更好。因此,试验采用Eclipse XDB-C8色谱柱作固定相,采用甲醇作有机相来同时分离利巴韦林和金刚烷胺。

图1 不同色谱柱和不同有机相分离时混合标准溶液的总离子流色谱图Fig.1 Total ion chromatograms of the mixed standard solution separated with different columns and different organic phases
2.2 样品前处理条件的选择
2.2.1 提取剂及用量
考虑到利巴韦林极性很强以及禽肉基体复杂、油脂含量高等特点,试验考察了分别以体积比3∶7、1∶1、7∶3的10 g·L-1三氯乙酸溶液-乙腈的混合溶液(1,2,3组)、20 g·L-1三氯乙酸溶液-乙腈的混合溶液(4,5,6组)、10 g·L-1甲酸溶液-乙腈的混合溶液(7,8,9组)、10 g·L-1甲酸溶液-甲醇的混合溶液(10,11,12组)和10 g·L-1三氯乙酸溶液-甲醇的混合溶液(13,14,15组)作提取剂时对空白加标鸡肉样品(加标量10.0μg·kg-1)中利巴韦林、金刚烷胺峰面积的影响,结果见图2。
由图2可知,与含有甲酸的提取剂相比,含有三氯乙酸的提取剂所得的两种目标物峰面积普遍偏高,推测与三氯乙酸沉淀蛋白效果更好有关。当三氯乙酸的质量浓度为10 g·L-1时,提取液呈现浑浊状态,无法用滤纸过滤;当三氯乙酸的质量浓度为20 g·L-1时,提取液变澄清、分层明显,上清液过滤效果较好。与含有甲醇的提取剂相比,含有乙腈的提取剂所得的两种目标物峰面积普遍偏高;当采用20 g·L-1三氯乙酸溶液-乙腈的混合溶液作提取剂,且二者体积比为7∶3时两种目标物的峰面积较高。因此,试验选择的提取剂为体积比7∶3 的20 g·L-1三氯乙酸溶液-乙腈的混合溶液。
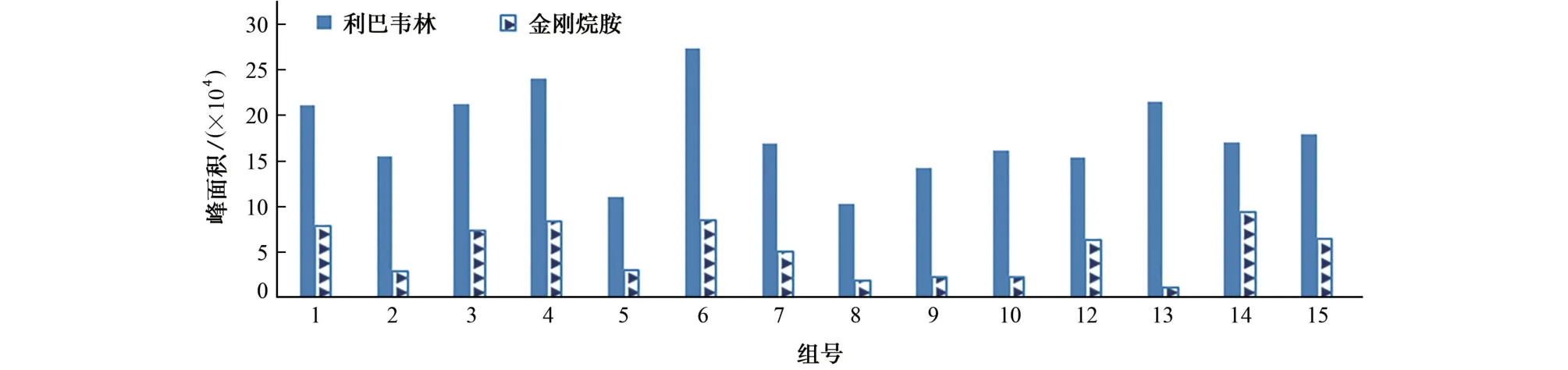
图2 提取剂对利巴韦林和金刚烷胺峰面积的影响Fig.2 Effect of extraction solvent on the peak area of ribavirin and amantadine
进一步考察了提取剂用量分别为5,10,15,20,50 mL时对空白加标鸡肉样品(加标量10.0μg·kg-1)中利巴韦林、金刚烷胺峰面积的影响。结果显示:提取剂用量小于15 mL 时,提取液分层不明显,回收率低于50.0%;以15 mL提取剂提取时,提取液分层明显,回收率均大于70.0%;提取剂用量继续增加,回收率变化不大。因此,试验选择的提取剂用量为15 mL。
2.2.2 净化方法
试验比较了正己烷脱脂法、固相萃取法的净化效果。试验结果显示,正己烷脱脂法仅适用于目标物质量分数大于2.0μg·kg-1样品的净化;若样品中目标物质量分数继续降低,将不能实现金刚烷胺的有效提取。固相萃取柱分别选用了中等极性的C8小柱和硅胶型的PBA 小柱,其中C8小柱依次以乙腈5 mL、体积比7∶3的10 g·L-1三氯乙酸溶液-乙腈的混合溶液5 mL 活化,将待净化的溶液全部过柱后,以体积比7∶3的10 g·L-1三氯乙酸溶液-乙腈的混合溶液5 mL淋洗,以乙腈5 mL洗脱,后续处理步骤同1.3节。结果显示:以C8小柱净化时,金刚烷胺的净化效果较好,而利巴韦林在C8小柱上保留很弱,未在仪器上得到相应的响应信号;以PBA 小柱净化时,金刚烷胺和利巴韦林的回收率分别为72.0%和90.0%,净化效果较好,这是由于PBA 小柱键合苯硼酸官能团,能够通过可逆的共价键保留目标物,专属性更强。因此,试验选择以PBA 小柱净化提取液。
2.3 标准曲线和检出限
按照仪器工作条件测定混合标准溶液系列,以各目标物的质量浓度为横坐标,其对应的色谱峰峰面积与内标物色谱峰峰面积的比值为纵坐标绘制标准曲线。结果显示,利巴韦林和金刚烷胺标准曲线均在2~40μg·L-1内线性关系良好,线性回归方程分别 为y=0.091 77x+0.002 917 和y=0.142 5x+0.011 50,相关系数分别为0.999 9 和0.991 4。
以3倍信噪比(S/N)计算检出限(3S/N),所得结果分别为0.3μg·kg-1和0.2μg·kg-1。
2.4 精密度和回收试验
取空白鸡肉样品18 份,进行3 个浓度水平(1.0,2.0,5.0μg·kg-1)的加标回收试验,每个浓度水平进行6次平行测定,计算回收率和测定值的相对标准偏差(RSD),所得结果见表3。
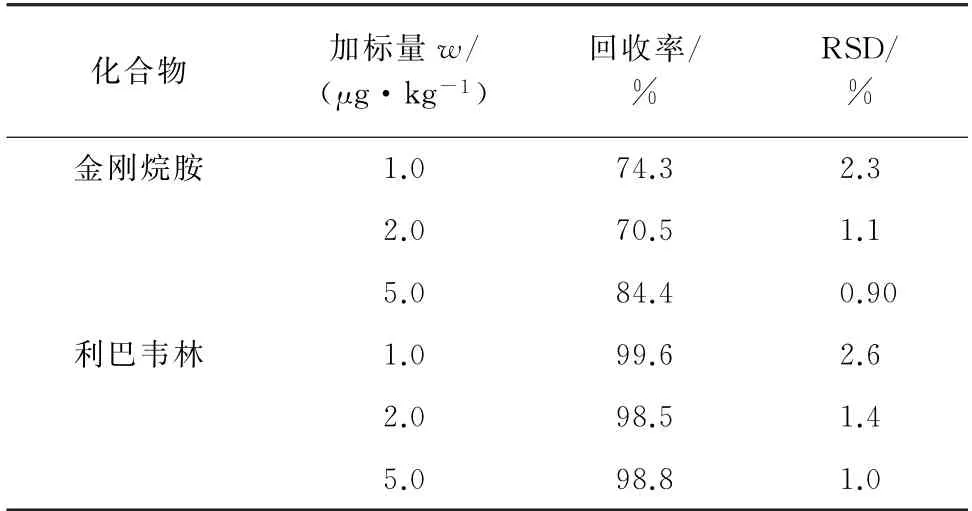
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
由表3可知,金刚烷胺和利巴韦林回收率分别为70.5%~84.4%和98.5%~99.6%,测定值的RSD 均小于5.0%。
本工作以体积比7∶3的20 g·L-1三氯乙酸溶液-乙腈的混合溶液作提取剂,以PBA 小柱净化,以高效液相色谱-串联质谱法同时测定鸡肉中利巴韦林和金刚烷胺的含量。方法检测快速、专属性强、灵敏度高,精密度和准确度好,可为动物源性食品中这两种化合物的快速、精确测定提供技术支持。
