基于高效液相色谱指纹图谱的不同产地不同采摘期昆仑雪菊的化学模式识别及抗氧化谱效关系探究
2023-03-21于佳萍章聚宝楚刚辉
赵 茜,于佳萍,章聚宝,楚刚辉
(1.新疆特色药食用植物资源化学重点实验室,喀什 844099; 2.喀什大学 化学与环境科学学院,喀什 844099)
昆仑雪菊,学名两色金鸡菊(Coreopsis tinctoria),与天山雪莲齐名。昆仑雪菊无毒无害[1],体外抗氧化效果很强,含有黄酮类、酚酸类、聚炔类、脂肪酸、挥发油、皂苷类、多糖、氨基酸等化合物。其中,黄酮类化合物在降血糖、抗氧化、抗炎症中起着不容小觑的作用,极具研究价值[2]。
中药谱效学是研究中药药效和指纹图谱相互关系的学科。在对中药进行谱效分析时,尚存在一些问题,如中药组成复杂,在色谱分析时可能出现鬼峰和错峰,导致标准品定性困难;所需标准品种类多,一些标准品难以购买、价格昂贵;难以对所有共有组分进行定量。为克服以上问题,避免前处理和色谱条件变化带来的结果偏差,可选择内标或者具有特定性质的共有组分作为参照,通过计算各共有组分的相对含量进行定量,但是针对昆仑雪菊的相关研究未见报道。
鉴于此,本工作在10批不同产地、不同时间采摘的昆仑雪菊样品的高效液相色谱(HPLC)指纹图谱中筛选出24个共有组分,以绿原酸作参照计算各共有组分含量,以相关性分析确认共有组分的代表性和质量稳定性,以聚类分析、主成分分析进行样品分类,以1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除法测定昆仑雪菊的抗氧化活性,并以灰色关联分析法建立共有组分峰数据与抗氧化活性的谱效关系,可为昆仑雪菊的开发利用提供技术支撑。
1 试验部分
1.1 仪器与试剂
LC-20A 型高效液相色谱仪,配SPD-M20A 型二极管阵列检测器、DGU-20A5型在线脱气机、LC-20AT 型高压泵、LCsolution 型工作站;T6 新悦型可见分光光度计;KQ3200DE型超声波清洗器;XA-1型多功能粉碎机。
对照品储备溶液:取绿原酸对照品12.5 mg,用60%(体积分数,下同)甲醇溶液溶解并定容至50 mL容量瓶中,得到质量浓度为250 mg·L-1对照品储备溶液,于4 ℃条件下密封保存。
抗坏血酸或丁基羟基茴香醚(BHA)储备溶液:取适量抗坏血酸或BHA,用60%甲醇溶液溶解并稀释成质量浓度为0.012 g·L-1的抗坏血酸或BHA 储备溶液。
抗坏血酸或BHA 溶液系列:用60%甲醇溶液逐级稀释抗坏血酸或BHA 储备溶液,配制成质量浓度为0.5,1,2,3,4 mg·L-1的抗坏血酸或BHA溶液系列,于4 ℃条件下保存。
DPPH 溶液:取DPPH 4.0 mg,用甲醇溶解并稀释,配制成0.04 g·L-1的DPPH 溶液,避光保存。
ABTS溶液:将适量0.07 mol·L-1ABTS 溶液溶于10 mL水中,得到7.00 mmol·L-1的ABTS储备溶液;将适量0.03 mol·L-1过硫酸钾溶液溶于10 mL水中,得到2.55 mmol·L-1的过硫酸钾溶液。将上述两种溶液等体积混合,于室温、避光条件下反应12 h左右,用水稀释成吸光度为0.700±0.020(检测波长734 nm)的溶液,即为ABTS溶液。
绿原酸对照品的纯度为98%;DPPH、ABTS的纯度为98%;BHA 的纯度为99%;过硫酸钾的纯度为99%;乙腈、甲醇为色谱纯;抗坏血酸、乙酸为分析纯;试验用水为娃哈哈纯净水。
10批昆仑雪菊样品均采摘于新疆地区,具体信息见表1。
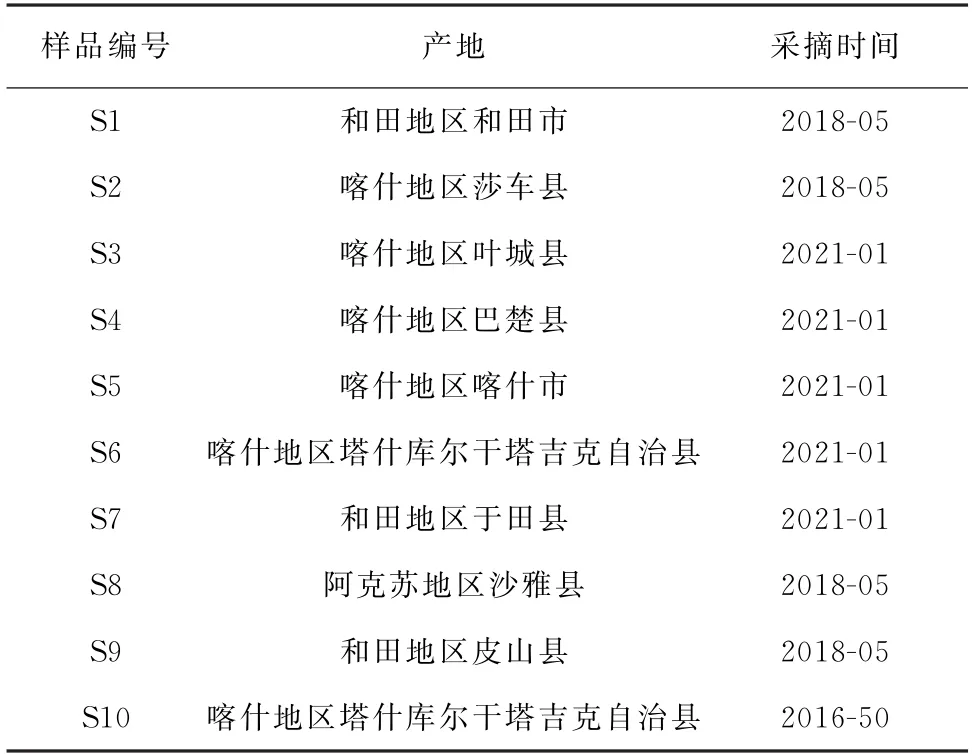
表1 10批昆仑雪菊样品信息Tab.1 Information of 10 batches of Coreopsis tinctoria samples
1.2 色谱条件
Agilent HC-C18色谱柱(250 mm×4.6 mm,5μm);柱温35 ℃;进样量20 μL;检测波长285 nm;流动相A为0.4%(体积分数,下同)乙酸溶液,B为乙腈;流量1.0 mL·min-1。梯度洗脱程序见表2。
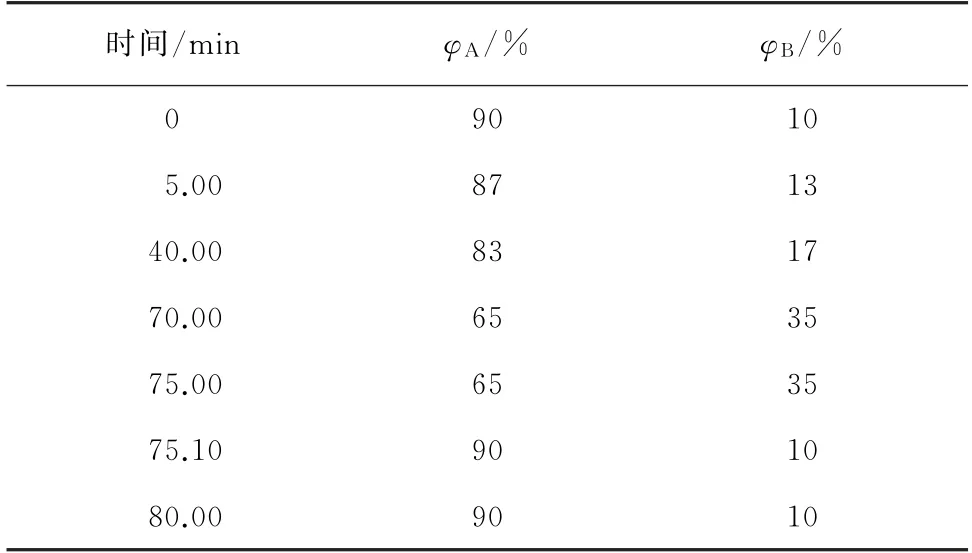
表2 梯度洗脱程序Tab.2 Gradient elution procedure
1.3 试验方法
1.3.1 HPLC检测
10批昆仑雪菊样品经干燥、粉碎后储于样品瓶中。分取0.2 g置于150 mL锥形瓶中,用60%甲醇溶液50 mL 溶解,摇匀后于室温、超声功率500 W条件下提取30 min。待溶液冷却至室温,过0.45μm 滤膜,所得供试品溶液(质量浓度为4 000 mg·L-1)按照色谱条件测定。
1.3.2 抗氧化活性检测
1)DPPH 自由基清除法 用60%甲醇溶液逐级稀释供试品溶液,配制成质量浓度为9.6,16,20,32,40 mg·L-1的供试品溶液系列。参考文献[3-6],在供试品溶液系列2 mL 中加入DPPH 溶液2 mL,振荡混匀后,避光反应30 min,以空气作参比,在517 nm 处测量上述溶液的吸光度(样品组A),每个质量浓度水平重复测定3次;在供试品溶液系列2 mL 中加入甲醇2 mL,按照上述方法处理,测量吸光度(对照组Aj);在60%甲醇溶液2 mL中加入DPPH 溶液2 mL,按照上述方法处理,测量吸光度(空白组A0),以1-(A-Aj)/A0计算DPPH自由基清除率。同时以抗坏血酸溶液系列和BHA 溶液系列作为阳性对照,按照上述方法测定,计算DPPH 自由基清除率。
2)ABTS自由基清除法 参考文献[3-6],将样品组和空白组中的DPPH 溶液替换为ABTS溶液,将对照组中的甲醇替换为水,选择测量波长为734 nm,避光反应时间为6 min,其他试验过程和自由基清除率计算方法同DPPH 自由基清除法。
2 结果与讨论
2.1 指纹图谱建立
将10批样品的谱图导入中药色谱指纹图谱相似度评价系统,以S10 图谱作为参照图谱,生成的指纹图谱、对照指纹图谱见图1(a)和图1(b)。同时测定对照品储备溶液,所得色谱图见图1(c)。
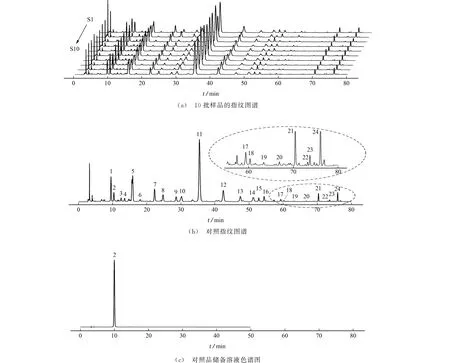
图1 10批样品指纹图谱、对照指纹图谱和对照品储备溶液的色谱图Fig.1 Ten batches of samples fingerprints,reference fingerprint and standard stock solution chromatogram
结果显示,10批样品的共有峰有24个,说明昆仑雪菊的共有组分有24个。与对照品储备溶液保留时间、吸收曲线进行比对,确定共有组分2为绿原酸。鉴于绿原酸保留时间较短且价廉易得,以绿原酸作参照,计算指纹图谱中其他共有组分峰面积与共有组分2的比值,作为其他共有组分的相对含量。
2.2 方法学考察结果
2.2.1 标准曲线和检出限
用60%甲醇溶液逐级稀释对照品储备溶液,配制成质量 浓度分别为5,12.5,20,30,35,45,50 mg·L-1的对照品溶液系列,按照1.2节色谱条件测定。以峰面积为纵坐标,绿原酸质量浓度为横坐标绘制标准曲线,所得标准曲线的线性范围为5~50 mg·L-1,线性回归方程为y=3.788×104x-2.814×104,相关系数为0.999 5。
以3倍信噪比(S/N)计算绿原酸的检出限(3S/N),所得结果为0.15 mg·L-1。
2.2.2 精密度试验
鉴于产自叶城县的样品中24个共有组分的相对含量较高,以该样品作研究对象,重复测定6次,计算共有组分1,2,10,11,12,20的峰面积以及保留时间的相对标准偏差(RSD),所得峰面积的RSD 分别为0.50%,0.20%,0.10%,0.40%,0.10%,1.30%,保留时间的RSD 分别为0.30%,0.40%,0.40%,0.50%,0.40%,0.10%,说明仪器精密度良好。
取产自叶城县的样品6份,分别按照1.3节方法制备供试品溶液,计算共有组分1,2,10,11,12,20相对含量的RSD,所得结果分别为1.6%,1.6%,2.0%,1.5%,2.1%,2.3%,说明该方法精密度良好。
2.2.3 稳定性试验
按照1.3节方法处理产自叶城县的样品,放置0,2,4,6,8,12,24 h后进样,计算共有组分1,2,10,11,12,20峰面积的RSD,所得峰面积的RSD 分别为1.20%,0.20%,0.40%,0.80%,0.20%,1.40%,说明供试品溶液在24 h内具有良好稳定性。
2.2.4 回收试验
对产自叶城县样品进行3个浓度水平的加标回收试验,计算绿原酸回收率,结果见表3。
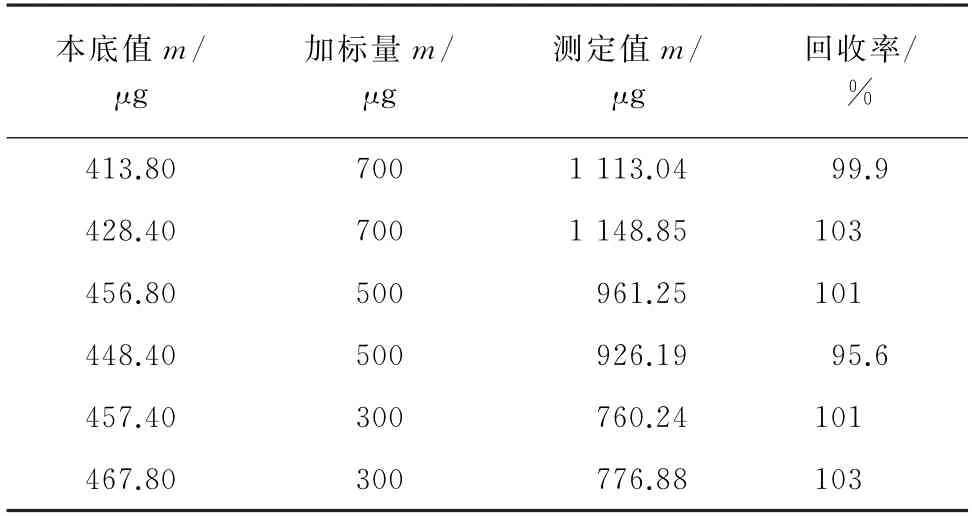
表3 回收试验结果Tab.3 Results of test for recovery
由表3 可知,绿原酸的回收率为95.6%~103%,满足实际检测需求。
2.2.5 样品分析
按照1.3.1节方法分析10批样品,测定其中绿原酸的含量,并根据相对含量计算其他共有组分的含量(即以绿原酸计的含量),结果见表4。
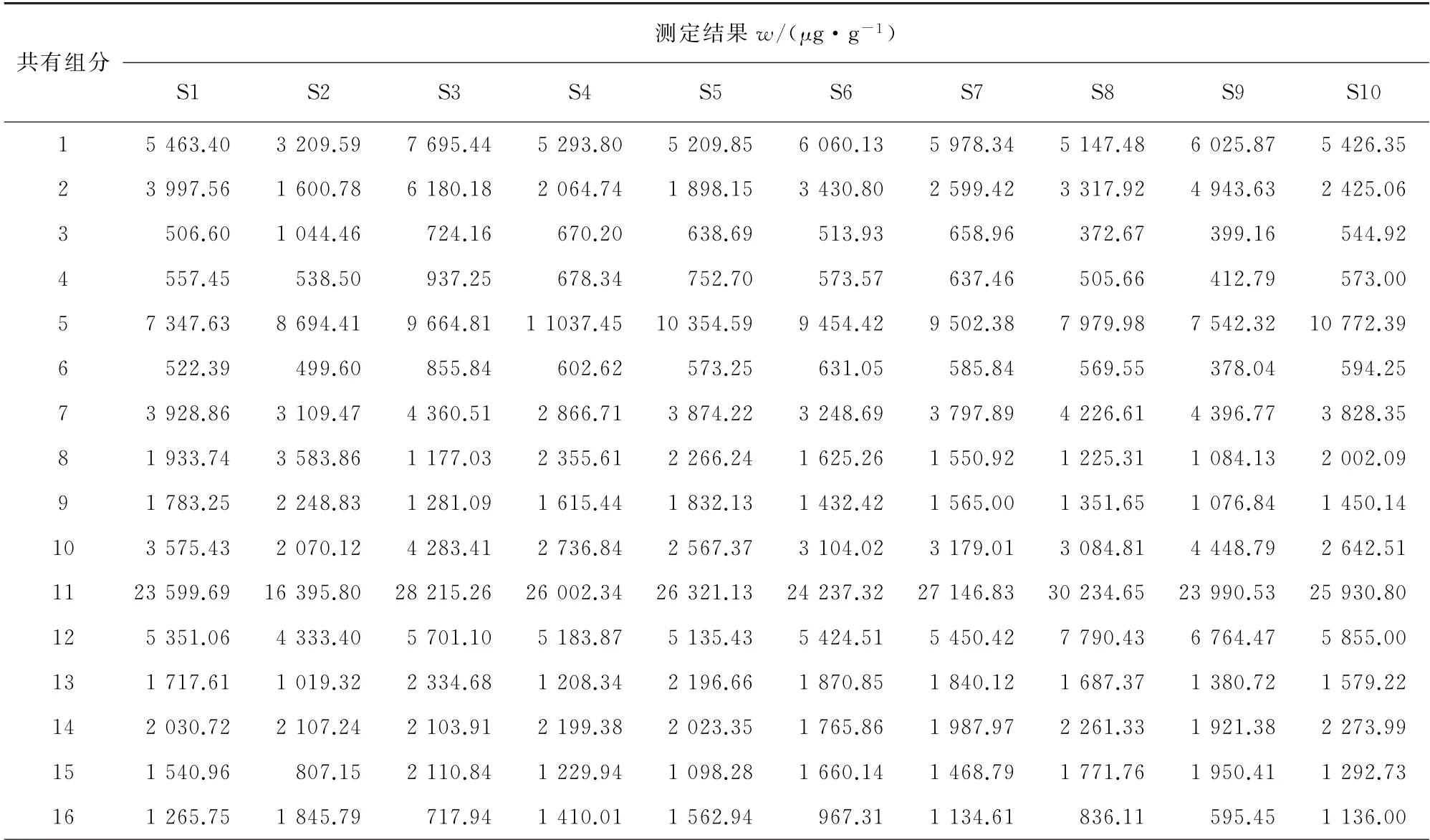
表4 以绿原酸计的24个共有组分的测定结果Tab.4 Determination results of the 24 common components calculated by chlorogenic acid
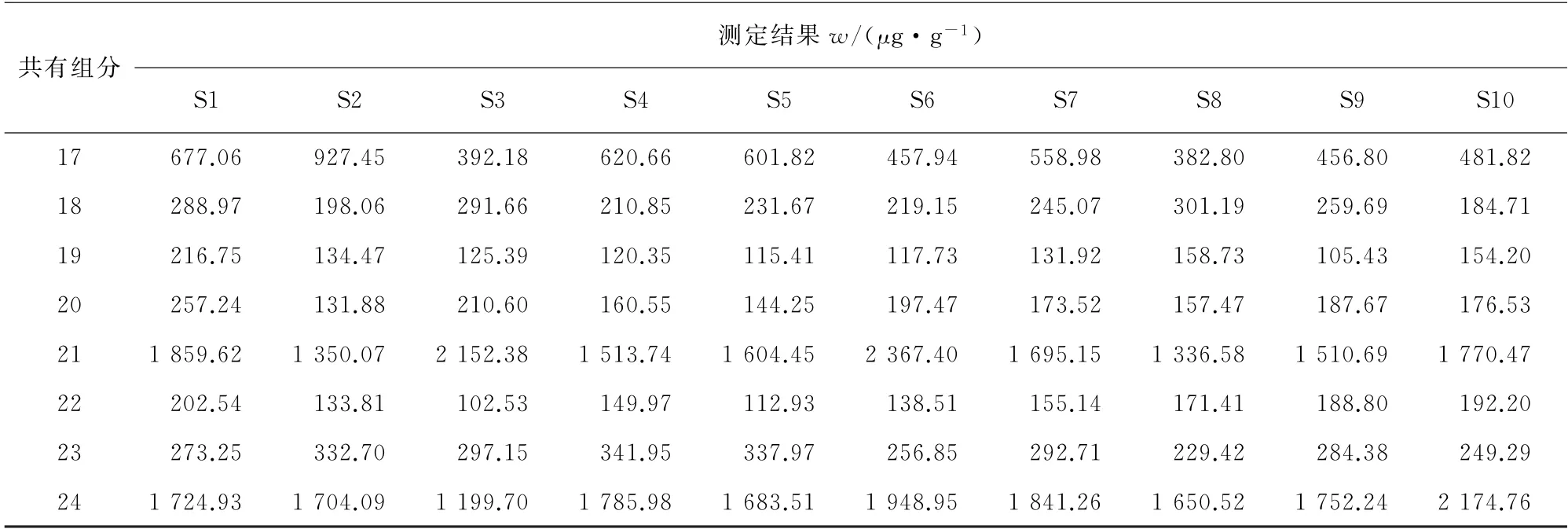
表4 (续)
2.3 抗氧化活性结果
半数清除浓度(IC50)可直观展现活性物质的抗氧化能力,IC50越小,抗氧化能力越强[7-9]。采用SPSS 25.0软件对DPPH 自由基清除法和ABTS自由基清除法所得清除率进行Logistic(逻辑)回归分析,计算IC50,结果见表5。
由表5可知:对于DPPH 自由基清除法,10批样品所得IC50大小排序依次为S6、S3、S9、S5、S1、S2、S7、S10、S4、S8,其中S8 样品的抗氧化能力最强;对于ABTS自由基清除法,10批样品所得IC50大小排序依次为S2、S6、S5、S10、S9、S1、S3、S4、S7、S8,其中S8样品的抗氧化能力最强。

表5 10批样品的抗氧化活性试验结果Tab.5 Results of test for antioxidant activity of 10 batches of samples
2.4 相似度评价结果
采用中药色谱指纹图谱相似度评价系统对10批样品的指纹图谱以及对照指纹图谱进行相似度评价,结果见表6。
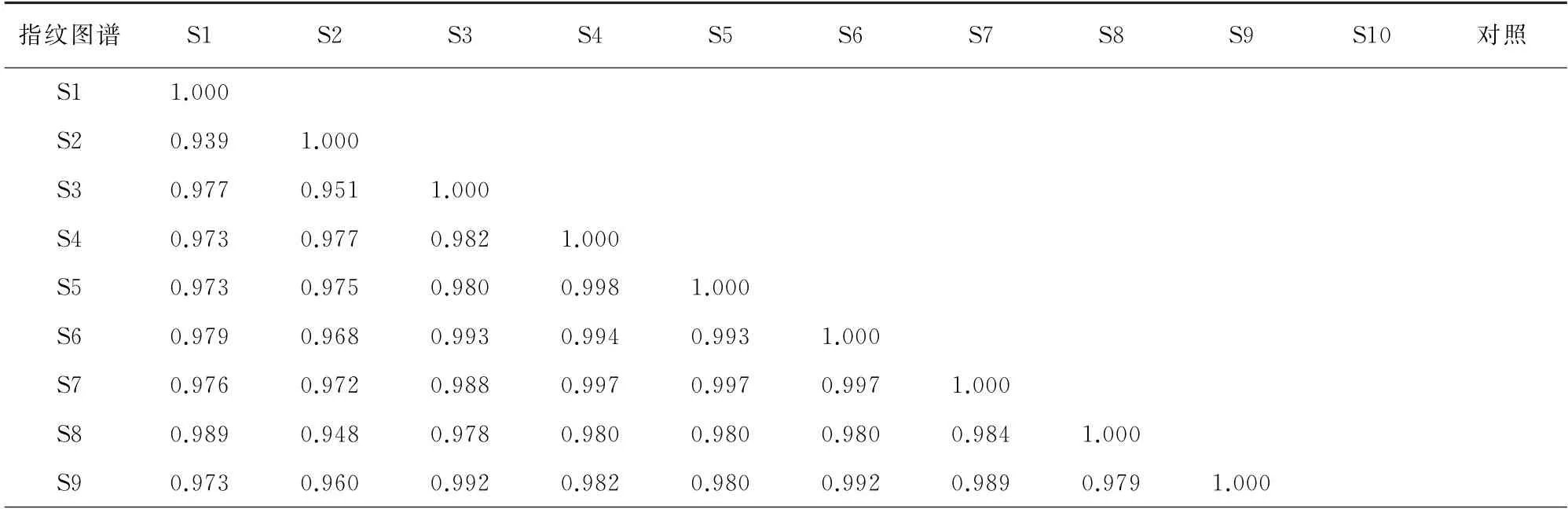
表6 指纹图谱的相似度评价结果Tab.6 Evaluation results of fingerprint similarity
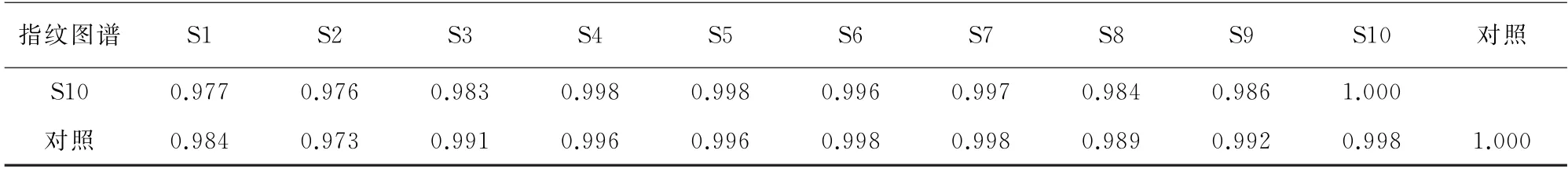
表6 (续)
由表6可知,10批样品的指纹图谱及它们与对照指纹图谱间的相似度结果均大于0.900,说明所选共有组分具有代表性,不同产地不同时间采摘的样品质量稳定性良好。
2.5 聚类分析结果
根据10批样品24个共有组分峰面积,整理出10×24阶原始数据矩阵,利用SPSS 25.0软件中的功能描述对数据矩阵实行Z-score标准化处理,将处理后的数据作为变量,样品编号作为个案标注依据,选择组间联接聚类法和平方欧氏距离进行聚类分析,所得结果见图2。

图2 10批样品聚类分析谱系图Fig.2 Hierarchical cluster analysis of 10 batches of samples
由图2可知,当平方欧式距离为10时,可将10批样品分为4类,即S4、S5、S6、S7、S10同属一类,S1、S8、S9同属一类,S2 一类,S3 一类。S1、S8、S9均为2018年5月采摘,S4、S5、S6、S7均为2021年1月采摘,说明采摘年份和季节可能影响聚类分析结果。S4、S5、S6、S10均采自喀什地区,S1、S9均采自和田地区,不同地区地势海拔不一,说明地理位置也可能影响聚类分析结果。S2、S3 单独归属于一类,可能是地理位置和采摘季节共同作用,导致产品质量产生较大差异。
2.6 主成分分析结果
将10批样品的24个共有组分的峰面积汇总为数据矩阵后进行标准化处理,导入SPSS 25.0软件中。将特征值设置为“>1”,通过相关性矩阵进行主成分分析,自动得出5个主成分的特征值、方差贡献率与成分载荷矩阵,特征值依次为10.803,4.805,2.564,2.120,1.815,方差贡献率依次为45.012%,20.019%,10.682%,8.835%,7.564%,累积方差贡献率为92.112%,说明这5个主成分能充分反映实际样品的基本特征和主要信息[10]。其中,10批样品组分的相似性可由主成分1所包含的各个组分反映出来[11]。主成分1得分来源于共有组分1,2,7,10,11,12,13,15,18,20的色谱峰,主成分2得分来源于共有组分3,4,5,6,21,23的色谱峰,主成分3得分来源于共有成分8,9,17的色谱峰,主成分4得分来源于共有成分14的色谱峰,主成分5得分来源于共有成分16,19,22,24的色谱峰。参考文献[11],由主成分1,2,3,4,5得分(Y1,Y2,Y3,Y4,Y5)计算10批样品的综合得分(Y),公式为Y=0.450 12Y1+0.200 19Y2+0.106 82Y3+0.088 35Y4+0.075 64Y5,10 批样品 的综合 得分分别为0.48,-2.95,3.12,-1.17,-0.52,0.24,0.08,0.85,0.58,-0.71,综合得分大小排序依次为S3、S8、S9、S1、S6、S7、S5、S10、S4、S2,说明产自叶城县的样品(S3)质量最优,其次为产自沙雅县(S8)和皮山县(S9)的样品。
鉴于主成分1,2,3 的方差贡献率较大,以这3个主成分得分建立三维坐标系,绘制得分散点图,结果见图3。
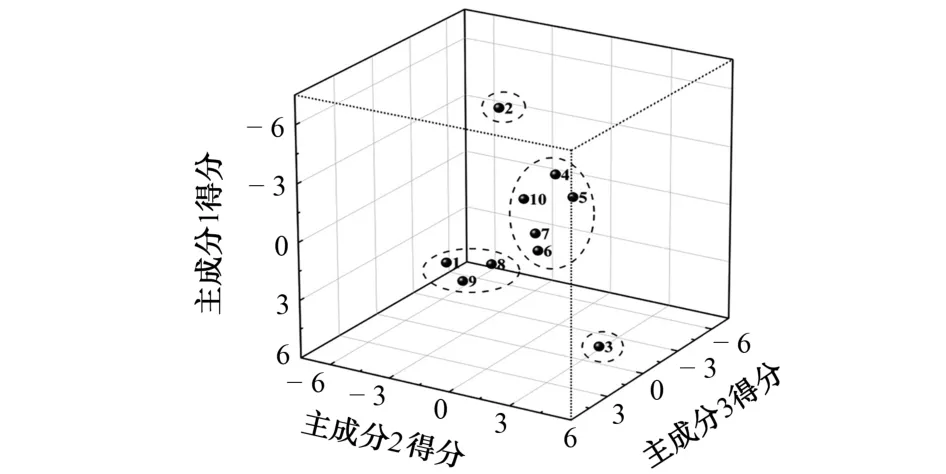
图3 主成分分析得分散点图Fig.3 Scatter chart of principal component analysis scores
由图3可知,S4、S5、S6、S7、S10同属一类,S1、S8、S9同属一类,S3一类,S2一类,该分类结果与聚类分析的一致[12-13]。
2.7 灰色关联分析结果
首先对原始数据进行标准化处理,然后将两种自由基清除法得到的两组IC50作为母序列,将24个共有组分峰面积数据作为子序列整合为数据矩阵,通过DPS数据处理系统进行灰色关联分析,并计算关联度[14-15],关联度越大,意味着该组分对抗氧化 活性的贡献越大,反之则越小[16]。结果见表7。

表7 灰色关联分析结果Tab.7 Gray correlation analysis results
由表7可知,24个共有组分与DPPH 自由基清除法或ABTS自由基清除法所得IC50的关联度均大于0.600,说明昆仑雪菊样品的强抗氧化活性是由多个组分协同作用产生的[15]。对于DPPH 自由基清除法,对样品抗氧化活性贡献较大(关联度不小于0.800)的共有组分有5个,大小排序依次是20,1,7,21,24;对于ABTS自由基清除法,贡献较大的共有组分也有5个,大小排序依次是14,24,23,1,11。可将上述8个共有组分作为后续开发利用昆仑雪菊的药效控制点,建议重点关注对两种方法抗氧化活性贡献均较大的共有组分1,24。
本工作通过相关性分析,发现所选的24个共有组分具有代表性,且质量稳定;通过聚类分析和主成分分析,将新疆不同产地不同采摘期的昆仑雪菊样品分为4类;通过灰色关联分析,探究了谱效关系,各提取出5个对抗氧化活性有较大贡献的关键组分,可为昆仑雪菊产品的质量保证、关键组分提取以及药理研究提供参考。
